Ácido aminolevulínico sintasa
Síntesis de ácido aminolevulico ()ALA synthase, ALASo delta-aminolevulinic acid synthase) es una enzima (EC 2.3.1.37) que cataliza la síntesis del ácido δ-aminolevulinico (ALA) el primer precursor común en la biosíntesis de todos los tetrapirroles como hemes, cobalaminas y clorofilas. La reacción es la siguiente:
- succinyl-CoA + glicina δ-aminolevulinic acid + CoA + CO2
Esta enzima se expresa en todos los eucariotas no vegetales y en la clase α de proteobacterias y la reacción que cataliza a veces se denomina vía Shemin para la formación de ALA. Otros organismos producen ALA a través de una vía de tres enzimas conocida como vía C5. El ALA se sintetiza mediante la condensación de glicina y succinil-CoA. En humanos, la transcripción de la ALA sintasa está estrechamente controlada por la presencia de elementos de unión a Fe2+, para evitar la acumulación de intermediarios de porfirina en ausencia de hierro. Hay dos formas de ALA sintasa en el cuerpo. Una forma se expresa en las células precursoras de los glóbulos rojos (ALAS2), mientras que la otra (ALAS1) se expresa de forma ubicua en todo el cuerpo. La forma de glóbulos rojos está codificada por un gen en el cromosoma x, mientras que la otra forma está codificada por un gen en el cromosoma 3.
La anemia sideroblástica ligada al cromosoma X es causada por mutaciones en el gen ALA sintasa en el cromosoma X, mientras que no se sabe que ninguna enfermedad sea causada por mutaciones en el otro gen. Recientemente se ha demostrado que las mutaciones de ganancia de función en el gen ALA sintasa específico de eritroides causan una forma previamente desconocida de porfiria conocida como protoporfiria dominante ligada al cromosoma X.
Estructura y propiedades de la enzima
Las enzimas dependientes de PLP prevalecen porque son necesarias para transformar los aminoácidos en otros recursos. ALAS es un homodímero con subunidades de tamaño similar y los sitios activos que consisten en cadenas laterales de aminoácidos como arginina, treonina y lisina existen en una interfaz de subunidad. La proteína, cuando se extrae de R. spheroids, contiene 1.600 veces y pesa alrededor de 80.000 daltons. La actividad enzimática varía según las diferentes fuentes de la enzima.
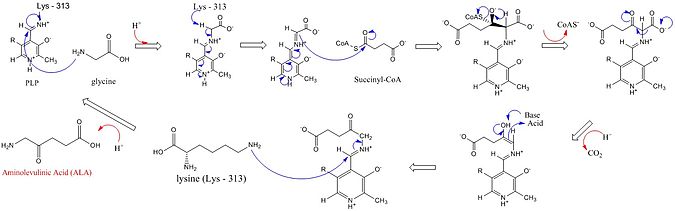
Mecanismo de reacción
Los sitios activos de ALAS utilizan tres cadenas laterales de aminoácidos clave: Arg-85, Thr-430 y Lys-313. Aunque se ha identificado que estos tres aminoácidos permiten que se lleve a cabo esta reacción, estarían inactivos sin la adición del cofactor piridoxal 5'-fosfato (PLP), cuyo papel en esta síntesis se detalla en la imagen a continuación. Antes de que pueda comenzar la reacción, el cofactor PLP se une a la cadena lateral de lisina para formar una base de Schiff que promueve el ataque del sustrato de glicina. La lisina actúa como base general durante este mecanismo. En el mecanismo de reacción detallado, los átomos de hidronio que se agregan provienen de una variedad de residuos que ofrecen enlaces de hidrógeno para facilitar la síntesis de ALA. La ALA sintasa elimina el grupo carboxilo de la glicina y el CoA de la succinil-CoA mediante su grupo protésico piridoxal fosfato (un derivado de la vitamina B6), formando ácido δ-aminolevulínico (dALA), llamado así porque el grupo amino está en el cuarto. átomo de carbono en la molécula. Este mecanismo de reacción es particularmente único en relación con otras enzimas que utilizan el cofactor PLP porque la glicina es inicialmente desprotonada por un sitio activo altamente conservado, lisina, lo que lleva a la condensación con succinil-CoA y la pérdida de CoA. La protonación del grupo carbonilo del intermedio por un sitio activo histidina conduce a la pérdida del grupo carboxilo. El último intermediario finalmente se reprotona para producir ALA. La disociación del ALA de la enzima es el paso limitante de la velocidad de la reacción enzimática y se demostró que depende de un cambio conformacional lento de la enzima. La función del fosfato de piridoxal es facilitar la eliminación de hidrógeno mediante la utilización del anillo electrófilo de piridinio como sumidero de electrones.
La ubicación de esta enzima en los sistemas biológicos es indicativa de la retroalimentación que puede recibir. La ALA sintasa se ha encontrado en bacterias, levaduras, hígado, células sanguíneas y médula ósea de aves y mamíferos. La ubicación de esta enzima en las células animales es dentro de las mitocondrias. Dado que la enzima parece estar ubicada cerca de su fuente de succinil-CoA y el final de la vía del hemo, indica que los puntos inicial y final de la biosíntesis del hemo sirven como retroalimentación para la ALA sintasa. La ALA sintasa también es inhibida por la hemina y la glucosa.

Función biológica
ALAS1 y ALAS2 catalizan el primer paso en el proceso de síntesis del hemo. Es el primer paso irreversible y también es limitante de la tasa. Esto significa que el inicio de la formación de hemos es muy intencional y está sujeto a una variedad de áreas de retroalimentación. Por ejemplo, los dos sustratos, oxaloacetato y glicina, se producen y utilizan en gran medida en otros procesos biológicos esenciales, como la glucólisis y el ciclo del TCA. La siguiente imagen ilustra la vía de síntesis del hemo y el papel que desempeña ALAS.

Relevancia de la enfermedad
La deficiencia de ácido aminolevulínico sintasa da como resultado una falta de capacidad para crear hemo, ya que su trabajo es catalizar el primer paso del proceso. Estas deficiencias suelen ser el resultado de una mutación genética que puede provocar una variedad de enfermedades. Una de esas enfermedades es la anemia sideroblástica ligada al cromosoma X, que provoca la aparición de glóbulos rojos en la médula ósea. Esta enfermedad está relacionada específicamente con mutaciones en los genes que codifican ALAS2.