Acidificación oceánica
La acidificación de los océanos es la disminución continua del valor del pH de los océanos de la Tierra, provocada por la absorción de dióxido de carbono (CO 2) de la atmósfera. La causa principal de la acidificación de los océanos es la quema humana de combustibles fósiles. A medida que aumenta la cantidad de dióxido de carbono en la atmósfera, también aumenta la cantidad de dióxido de carbono absorbido por el océano. Esto conduce a una serie de reacciones químicas en el agua de mar que tiene un efecto negativo sobre el océano y las especies que viven debajo del agua. Cuando el dióxido de carbono se disuelve en el agua de mar, forma ácido carbónico (H 2 CO 3). Algunas de las moléculas de ácido carbónico se disocian en un ion bicarbonato y un ion hidrógeno, lo que aumenta la acidez del océano (concentración de iones H). Entre 1751 y 1996, se estima que el valor de pH de la superficie del océano disminuyó de aproximadamente 8,25 a 8,14, lo que representa un aumento de casi el 30 % en la concentración de iones H en los océanos del mundo (la escala de pH es logarítmica, por lo que un cambio de un en la unidad de pH es equivalente a un cambio de diez veces en la concentración de iones H).
El valor de pH del océano a partir de 2020 era de 8,1, lo que significa que actualmente es ligeramente básico (el pH es superior a 7). La acidificación del océano dará como resultado un cambio hacia un valor de pH más bajo, lo que significa que el agua se volverá menos básica y, por lo tanto, más ácida. La acidificación de los océanos puede provocar una disminución de la producción de caparazones de mariscos y otras formas de vida acuática con caparazones de carbonato de calcio, así como otros desafíos fisiológicos para los organismos marinos. Los organismos con caparazón de carbonato de calcio no pueden reproducirse en aguas acidóticas altamente saturadas.
Hay una variación en el pH de la superficie del mar a nivel mundial con océanos más fríos y de mayor latitud que tienen la capacidad de disolver más CO 2 así como niveles más bajos de saturación de bicarbonato, lo que reduce aún más la capacidad de los organismos marinos para producir caparazones duros. Factores como las corrientes oceánicas, los grandes ríos continentales que diluyen la salinidad del agua de mar, el derretimiento del hielo y la deposición de nitrógeno y azufre de la quema de combustibles fósiles y la agricultura también influyen en la acidez de los océanos. La acidificación de los océanos ha ocurrido anteriormente en la historia de la Tierra, y el colapso ecológico resultante en los océanos tuvo efectos duraderos en el clima y el ciclo del carbono global.
Se cree que el aumento de la acidez tiene una variedad de consecuencias potencialmente dañinas para los organismos marinos, como la disminución de las tasas metabólicas y las respuestas inmunitarias en algunos organismos y la decoloración de los corales. La acidificación de los océanos está afectando a los ecosistemas de los entornos marinos que proporcionan alimentos, medios de subsistencia y otros servicios ecosistémicos a una gran proporción de la población humana. Alrededor de mil millones de personas dependen total o parcialmente de los servicios ecosistémicos proporcionados por los arrecifes de coral en términos de pesca, turismo y gestión costera.Al aumentar la presencia de iones de hidrógeno libres, el ácido carbónico adicional que se forma en los océanos finalmente da como resultado la conversión de iones de carbonato en iones de bicarbonato. La alcalinidad del océano no cambia por el proceso, o puede aumentar durante largos períodos de tiempo debido a la disolución del carbonato. Esta disminución neta en la cantidad de iones de carbonato disponibles puede dificultar que los organismos calcificadores marinos, como el coral y algunos plancton, formen carbonato de calcio biogénico, y tales estructuras se vuelven vulnerables a la disolución. Por lo tanto, la acidificación en curso de los océanos puede amenazar las futuras cadenas alimentarias vinculadas a los océanos.
La acidificación de los océanos es uno de varios efectos del cambio climático en los océanos. La principal solución a la acidificación de los océanos radica en reducir los niveles de CO 2 atmosférico. Como miembros del Panel Interacadémico, 105 academias de ciencias han emitido una declaración sobre la acidificación de los océanos en la que recomiendan que para 2050, las emisiones globales de CO 2 se reduzcan al menos en un 50 % en comparación con el nivel de 1990. El Objetivo de Desarrollo Sostenible 14 de las Naciones Unidas ("Vida bajo el agua") tiene como objetivo "minimizar y abordar los impactos de la acidificación de los océanos".
Causas y ciclo del carbono
Las actividades humanas, como la combustión de combustibles fósiles y los cambios en el uso de la tierra, han dado lugar a un nuevo flujo de CO2en la atmósfera. Alrededor del 45% ha permanecido en la atmósfera; la mayor parte del resto ha sido absorbida por los océanos, y parte por las plantas terrestres.
El ciclo del carbono describe los flujos de dióxido de carbono (CO2) entre los océanos, la biosfera terrestre, la litosfera y la atmósfera. El ciclo del carbono involucra tanto compuestos orgánicos como la celulosa y compuestos de carbono inorgánicos como el dióxido de carbono, el ion carbonato y el ion bicarbonato. Los compuestos inorgánicos son particularmente relevantes cuando se habla de la acidificación de los océanos, ya que incluyen muchas formas de CO2 disuelto.2presentes en los océanos de la Tierra.
cuando CO2disuelve, reacciona con el agua para formar un equilibrio de especies químicas iónicas y no iónicas: dióxido de carbono libre disuelto (CO2(ac)), ácido carbónico (H2CO3), bicarbonato (HCO3) y carbonato (CO3). La proporción de estas especies depende de factores como la temperatura, la presión y la salinidad del agua de mar (como se muestra en un diagrama de Bjerrum). Estas diferentes formas de carbono inorgánico disuelto son transferidas desde la superficie de un océano a su interior por la bomba de solubilidad del océano.
La resistencia de un área del océano a absorber el CO atmosférico2se conoce como el factor Revelle.
La acidificación de los océanos se ha comparado con el cambio climático antropogénico y se la ha llamado el "gemelo malvado del calentamiento global" y "el otro problema del CO 2 ". El aumento de la temperatura de los océanos y la pérdida de oxígeno actúan simultáneamente con la acidificación de los océanos y constituyen el "trío mortal" de las presiones del cambio climático sobre el medio ambiente marino. Los cuerpos de agua dulce también parecen estar acidificándose, aunque este es un fenómeno más complejo y menos obvio.
Se estima que entre el 30% y el 40% del dióxido de carbono de la actividad humana liberado a la atmósfera se disuelve en océanos, ríos y lagos.
Mecanismo de acidificación
Disolución de CO2en el agua de mar aumenta el ion hidrógeno (H) concentración en el océano, y por lo tanto disminuye el pH del océano, de la siguiente manera:CO 2 (aq) + H 2 O ⇌ H 2 CO 3 ⇌ HCO 3 + H ⇌ CO 3 + 2 H.
Aproximadamente un tercio del dióxido de carbono liberado a la atmósfera por la actividad humana se disuelve en los océanos, ríos y lagos, lo que resulta en niveles crecientes de acidificación. Los niveles de acidez de la superficie del océano han aumentado un 30% desde el comienzo de la revolución industrial.
Desde que comenzó la revolución industrial, el océano ha absorbido alrededor de un tercio del CO2que hemos producido desde entonces y se estima que el pH de la superficie del océano ha disminuido un poco más de 0,1 unidades en la escala logarítmica de pH, lo que representa un aumento de alrededor del 29 % en H. Se espera que disminuya entre 0,3 y 0,5 unidades de pH adicionales (una duplicación adicional o el triple de las concentraciones de ácido posindustrial actuales) para 2100 a medida que los océanos absorban más CO antropogénico.2, siendo los impactos más severos para los arrecifes de coral y el Océano Austral. Se predice que estos cambios se acelerarán a medida que aumente el CO antropogénico.2es liberado a la atmósfera y absorbido por los océanos. El grado de cambio en la química del océano, incluido el pH del océano, dependerá de las vías de mitigación y emisiones que tome la sociedad.
Aunque se esperan los mayores cambios en el futuro, un informe de científicos de la NOAA encontró que grandes cantidades de agua subsaturada en aragonito ya están aflorando cerca del área de la plataforma continental del Pacífico de América del Norte. Las plataformas continentales juegan un papel importante en los ecosistemas marinos, ya que la mayoría de los organismos marinos viven o se reproducen allí, y aunque el estudio solo abarcó el área desde Vancouver hasta el norte de California, los autores sugieren que otras áreas de la plataforma pueden estar experimentando efectos similares.
| Tiempo | pH | cambio de pH en relacióncon preindustrial | Fuente | Cambio de concentración de H enrelación con preindustrial |
|---|---|---|---|---|
| Preindustrial (siglo XVIII) | 8.179 | campo analizado | ||
| Pasado reciente (década de 1990) | 8.104 | −0,075 | campo | + 18,9% |
| Niveles actuales | ~8.069 | −0,11 | campo | + 28,8% |
| 2050 (2 × CO2= 560ppm) | 7.949 | −0.230 | modelo | + 69,8% |
| 2100 (IS92a) | 7.824 | −0,355 | modelo | + 126,5% |
En las regiones costeras y de plataforma poco profundas, una serie de factores interactúan para afectar el cambio de pH además del CO atmosférico2. Estos incluyen procesos biológicos, como la fotosíntesis y la respiración, y el afloramiento de agua en la costa puede verse modificado por estos procesos. Además, el metabolismo de los ecosistemas en las fuentes de agua dulce que llegan a las aguas costeras puede generar grandes cambios de pH allí, y las tasas de cambio de pH inducidas biológicamente dependen de la temperatura del agua local.
Tasas observadas
Si seguimos emitiendo CO 2 al mismo ritmo, para el año 2100 la acidez de los océanos aumentará en un 150 %, un ritmo que no se ha experimentado en al menos 400 000 años.
— Programa de Investigación de la Acidificación de los Océanos del Reino Unido, 2015
Uno de los primeros conjuntos de datos detallados para examinar cómo varió el pH durante 8 años en una ubicación costera templada del norte específica encontró que la acidificación tenía fuertes vínculos con la dinámica de las especies bénticas in situ y que la variación en el pH del océano puede causar que las especies calcáreas se desempeñen peor que las no calcáreas. especies en años con pH bajo y predice consecuencias para los ecosistemas bénticos cercanos a la costa.
Las tasas actuales de acidificación de los océanos se han comparado con el evento de efecto invernadero en el límite del Paleoceno-Eoceno (hace unos 55 millones de años) cuando las temperaturas de la superficie del océano aumentaron entre 5 y 6 grados centígrados. No se observó ninguna catástrofe en los ecosistemas de la superficie, pero los organismos que habitan en el fondo del océano experimentaron una gran extinción. La acidificación actual está en camino de alcanzar niveles más altos que los vistos en los últimos 65 millones de años, y la tasa de aumento es aproximadamente diez veces la tasa que precedió a la extinción masiva del Paleoceno-Eoceno. La acidificación actual y proyectada ha sido descrita como un evento geológico casi sin precedentes. Un estudio del Consejo Nacional de Investigación publicado en abril de 2010 también concluyó que "el nivel de ácido en los océanos está aumentando a un ritmo sin precedentes".Un artículo de 2012 en la revista Science examinó el registro geológico en un intento de encontrar un análogo histórico para las condiciones globales actuales y las del futuro. Los investigadores determinaron que la tasa actual de acidificación de los océanos es más rápida que en cualquier momento de los últimos 300 millones de años.
Una revisión realizada por científicos del clima en el blog RealClimate, de un informe de 2005 de la Royal Society of the UK destacó de manera similar la centralidad de las tasas de cambio en el actual proceso de acidificación antropogénica, escribiendo:
El pH natural del océano está determinado por la necesidad de equilibrar la deposición y el entierro de CaCO3en el fondo del mar contra la afluencia de Cay CO3en el océano al disolver las rocas en la tierra, lo que se denomina meteorización. Estos procesos estabilizan el pH del océano, por un mecanismo llamado CaCO3compensación... El punto de mencionarlo nuevamente es notar que si el CO2la concentración de la atmósfera cambia más lentamente que esto, como siempre lo ha hecho a lo largo del registro de Vostok, el pH del océano no se verá afectado relativamente porque CaCO3la compensación puede mantenerse. La acidificación [actual] de los combustibles fósiles es mucho más rápida que los cambios naturales, por lo que el pico de ácido será más intenso de lo que la Tierra ha visto en al menos 800.000 años.
Solo en el período de 15 años 1995-2010, la acidez ha aumentado un 6 por ciento en los 100 metros superiores del Océano Pacífico desde Hawai hasta Alaska. Según una declaración de julio de 2012 de Jane Lubchenco, jefa de la Administración Nacional Oceánica y Atmosférica de EE. UU., "las aguas superficiales están cambiando mucho más rápido de lo que sugerían los cálculos iniciales. Es otra razón más para estar muy preocupados por la cantidad de dióxido de carbono que está en la atmósfera ahora y la cantidad adicional que continuamos emitiendo".
Un estudio de 2013 afirmó que la acidez aumentaba a un ritmo 10 veces más rápido que en cualquiera de las crisis evolutivas de la historia de la Tierra. En un informe de síntesis publicado en Science en 2015, 22 destacados científicos marinos afirmaron que el CO 2de la quema de combustibles fósiles está cambiando la química de los océanos más rápidamente que en cualquier otro momento desde la Gran Mortandad, el evento de extinción más grave conocido en la Tierra, lo que enfatiza que el aumento máximo de temperatura de 2 °C acordado por los gobiernos refleja una reducción demasiado pequeña en las emisiones para evitar "impactos dramáticos" en los océanos del mundo, con el autor principal Jean-Pierre Gattuso comentando que "El océano ha sido mínimamente considerado en negociaciones climáticas anteriores. Nuestro estudio proporciona argumentos convincentes para un cambio radical en la conferencia de la ONU (en París) sobre el cambio climático ".
La tasa a la que ocurrirá la acidificación del océano puede estar influenciada por la tasa de calentamiento de la superficie del océano, porque los equilibrios químicos que gobiernan el pH del agua de mar dependen de la temperatura. Un mayor calentamiento del agua de mar podría conducir a un cambio menor en el pH para un aumento dado de CO 2. La diferencia en los cambios de temperatura y salinidad entre cuencas es una de las principales razones de las diferencias en las tasas de acidificación en diferentes localidades.
| Ubicación | Tasa de acidificación (10 unidades de pH / año) | Período | Fuente de datos |
|---|---|---|---|
| Islandia | -2.4 | 1984 – 2009 | Mediciones directas |
| Pasaje de Drake | -1.8 | 2002 – 2012 | Mediciones directas |
| Canarias (ESTOC) | -1.7 | 1995 – 2004 | Mediciones directas |
| Hawai (CALIENTE) | -1.9 | 1989 – 2007 | Mediciones directas |
| Bermudas (BATS) | -1.7 | 1984 – 2012 | Mediciones directas |
| mar de Coral | -0.2 | ~1700 – ~1990 | Reconstrucción de proxy |
| Mediterráneo oriental | -2.3 | 1964 – 2005 | Reconstrucción de proxy |
Tasas futuras previstas
Los Modelos del Sistema Terrestre proyectan que, alrededor de 2008, la acidez del océano superó los análogos históricos y, en combinación con otros cambios biogeoquímicos del océano, podría socavar el funcionamiento de los ecosistemas marinos e interrumpir la provisión de muchos bienes y servicios asociados con el océano a partir de 2100..
Si persiste el modelo de 'negocios como siempre' para la actividad humana, se estima que el pH del océano en el año 2100 podría disminuir entre 0,2 y 0,5 unidades en comparación con la actualidad. Los océanos no han experimentado este nivel de acidez durante 14 millones de años.
Se proyectó que se produciría un punto de inflexión ecológico para 2030 y no más tarde de 2038. Thomas Lovejoy, exasesor jefe de biodiversidad del Banco Mundial, ha sugerido que "la acidez de los océanos se duplicará con creces en los próximos 40 años. Él dice esto La tasa es 100 veces más rápida que cualquier cambio en la acidez del océano en los últimos 20 millones de años, por lo que es poco probable que la vida marina pueda adaptarse de alguna manera a los cambios". Se predice que, para el año 2100, si los cambios biogeoquímicos simultáneos influyen en la entrega de bienes y servicios oceánicos, entonces también podrían tener un efecto considerable en el bienestar humano para aquellos que dependen en gran medida del océano para obtener alimentos, trabajos y ingresos
Un panel de expertos que había participado previamente en los informes del IPCC determinó que aún no es posible determinar un umbral para la acidez del océano que no debe superarse.
Efectos sobre la calcificación
Los cambios en la química de los océanos pueden tener amplios efectos directos e indirectos sobre los organismos y sus hábitats. Una de las repercusiones más importantes del aumento de la acidez de los océanos se relaciona con la producción de conchas y placas a partir de carbonato de calcio (CaCO3). Este proceso se llama calcificación y es importante para la biología y supervivencia de una amplia gama de organismos marinos. La calcificación implica la precipitación de iones disueltos en CaCO sólido3estructuras, tales como cocolitos. Una vez formadas, tales estructuras son vulnerables a la disolución a menos que el agua de mar circundante contenga concentraciones saturadas de iones de carbonato (CO 3).
Mecanismo
Del dióxido de carbono adicional agregado a los océanos, parte permanece como dióxido de carbono disuelto, mientras que el resto contribuye a producir bicarbonato adicional (y ácido carbónico adicional). Esto también aumenta la concentración de iones de hidrógeno, y el aumento porcentual de hidrógeno es mayor que el aumento porcentual de bicarbonato, creando un desequilibrio en la reacción HCO 3 ⇌ CO 3 + H. Para mantener el equilibrio químico, algunos de los iones de carbonato que ya están en el océano se combinan con algunos de los iones de hidrógeno para producir más bicarbonato. Así se reduce la concentración de iones de carbonato en el océano, creando un desequilibrio en la reacción Ca + CO 3 ⇌ CaCO 3, y haciendo que la disolución de los formadosCaCO3estructuras más probables.
El aumento de las concentraciones de dióxido de carbono y bicarbonato disueltos y la reducción de carbonato se muestran en un gráfico de Bjerrum.
Estado de saturación
El estado de saturación (conocido como Ω) del agua de mar para un mineral es una medida del potencial termodinámico para que el mineral se forme o se disuelva, y para el carbonato de calcio se describe mediante la siguiente ecuación:
Aquí Ω es el producto de las concentraciones (o actividades) de los iones reaccionantes que forman el mineral (Cay CO3), dividido por el producto de las concentraciones de esos iones cuando el mineral está en equilibrio (Ksp), es decir, cuando el mineral no se está formando ni disolviendo. En el agua de mar, se forma un límite horizontal natural como resultado de la temperatura, la presión y la profundidad, y se conoce como horizonte de saturación. Por encima de este horizonte de saturación, Ω tiene un valor superior a 1, y CaCO3no se disuelve fácilmente. La mayoría de los organismos calcificadores viven en tales aguas. Por debajo de esta profundidad, Ω tiene un valor inferior a 1 y CaCO3se disolverá Sin embargo, si su tasa de producción es lo suficientemente alta como para compensar la disolución, CaCO3todavía puede ocurrir donde Ω es menor que 1. La profundidad de compensación de carbonato ocurre en la profundidad del océano donde la producción es excedida por la disolución.
La disminución en la concentración de CO 3 disminuye Ω y, por lo tanto, hace que CaCO3disolución más probable.
El carbonato de calcio se presenta en dos polimorfos comunes (formas cristalinas): aragonito y calcita. El aragonito es mucho más soluble que la calcita, por lo que el horizonte de saturación de aragonito siempre está más cerca de la superficie que el horizonte de saturación de calcita. Esto también significa que los organismos que producen aragonito pueden ser más vulnerables a los cambios en la acidez del océano que los que producen calcita. Aumento de CO2los niveles y el pH más bajo resultante del agua de mar disminuye el estado de saturación de CaCO3y eleva los horizontes de saturación de ambas formas más cerca de la superficie. Se cree que esta disminución en el estado de saturación es uno de los principales factores que conducen a la disminución de la calcificación en los organismos marinos, ya que la precipitación inorgánica de CaCO3es directamente proporcional a su estado de saturación.
Impactos
El aumento de la acidez tiene consecuencias posiblemente dañinas, como la disminución de las tasas metabólicas del calamar gigante, la disminución de las respuestas inmunitarias de los mejillones azules y la decoloración de los corales.
Los informes "Resumen de acidificación de los océanos para responsables de políticas 2013" y el "Informe especial sobre el océano y la criosfera en un clima cambiante" aprobado por el IPCC de 2019 describen los resultados de la investigación y los posibles impactos.
Blanqueamiento de corales
El fenómeno de la decoloración de los corales o blanqueamiento de corales y la degeneración de los ecosistemas de arrecifes coralinos es una de las consecuencias del aumento de la acidez de los océanos. Los ambientes tropicales y subtropicales, incluidas áreas como el Caribe y las regiones circundantes, Asia tropical (p. ej., Indonesia, Filipinas, Tailandia, Maldivas) y el Pacífico tropical (p. ej., la barrera de coral australiana, las islas del Pacífico, Papua Nueva Guinea) son los más afectados. por el blanqueamiento de los corales, ya que estas son las regiones del mundo que contienen los sistemas de arrecifes de coral más grandes y extensos.
Impactos en los organismos calcificadores oceánicos
El aumento de la acidificación de los océanos dificulta que los organismos que acumulan caparazones accedan a los iones de carbonato, esenciales para la producción de su caparazón exoesquelético duro. Los organismos calcificadores oceánicos abarcan la cadena alimentaria desde autótrofos hasta heterótrofos e incluyen organismos como cocolitóforos, corales, foraminíferos, equinodermos, crustáceos y moluscos.Como se describió anteriormente, en condiciones normales, la calcita y el aragonito son estables en las aguas superficiales ya que el ion carbonato se encuentra en concentraciones sobresaturadas. Sin embargo, a medida que cae el pH del océano, la concentración de iones de carbonato también disminuye, y cuando el carbonato se vuelve insuficiente, las estructuras hechas de carbonato de calcio son vulnerables a la disolución. Por tanto, incluso si no hay cambio en la tasa de calcificación, la tasa de disolución del material calcáreo aumenta.
Los corales, las algas cocolitóforas, las algas coralinas, los foraminíferos, los crustáceos y los pterópodos experimentan una calcificación reducida o una disolución mejorada cuando se exponen a niveles elevados de CO2.
La Royal Society publicó una descripción completa de la acidificación de los océanos y sus posibles consecuencias en junio de 2005. Sin embargo, algunos estudios han encontrado diferentes respuestas a la acidificación de los océanos, con la calcificación y la fotosíntesis de los cocolitóforos aumentando bajo una pCO 2 atmosférica elevada, una disminución igual en la primaria producción y calcificación en respuesta a niveles elevados de CO 2 o la dirección de la respuesta varía entre especies. Un estudio realizado en 2008 que examinó un núcleo de sedimento del Atlántico norte encontró que, si bien la composición de especies de cocolitofóridos se mantuvo sin cambios durante el período industrial de 1780 a 2004, la calcificación de los cocolitos aumentó hasta en un 40% durante el mismo tiempo.Un estudio de 2010 de la Universidad de Stony Brook sugirió que, si bien algunas áreas están sobreexplotadas y otras zonas de pesca se están restaurando, debido a la acidificación del océano, puede ser imposible recuperar muchas poblaciones anteriores de mariscos. Si bien las consecuencias ecológicas completas de estos cambios en la calcificación aún son inciertas, parece probable que muchas especies calcificadoras se vean afectadas negativamente.
Cuando se exponen en experimentos a un pH reducido de 0,2 a 0,4, las larvas de una estrella de mar templada, un pariente de la estrella de mar común, menos del 0,1 por ciento sobrevivieron más de ocho días. También hay una sugerencia de que una disminución en los cocolitóforos puede tener efectos secundarios sobre el clima, contribuyendo al calentamiento global al disminuir el albedo de la Tierra a través de sus efectos sobre la cubierta de nubes oceánicas. Todos los ecosistemas marinos de la Tierra estarán expuestos a cambios en la acidificación y varios otros cambios biogeoquímicos oceánicos.
El líquido en los compartimentos internos (el celenteron) donde los corales desarrollan su exoesqueleto también es extremadamente importante para el crecimiento de la calcificación. Cuando la tasa de saturación de aragonito en el agua de mar externa está a niveles ambientales, los corales desarrollarán sus cristales de aragonito rápidamente en sus compartimentos internos, por lo que su exoesqueleto crece rápidamente. Si el nivel de aragonito en el agua de mar externa es inferior al nivel ambiental, los corales tienen que trabajar más para mantener el equilibrio adecuado en el compartimento interno. Cuando eso sucede, el proceso de crecimiento de los cristales se ralentiza, y esto ralentiza la tasa de crecimiento de su exoesqueleto. Según la cantidad de aragonito que haya en el agua circundante, los corales pueden incluso dejar de crecer porque los niveles de aragonito son demasiado bajos para bombearlos al compartimiento interno.Bajo la progresión actual de las emisiones de carbono, alrededor del 70% de los corales de agua fría del Atlántico norte vivirán en aguas corrosivas para 2050–60.
Un estudio realizado por la Institución Oceanográfica Woods Hole en enero de 2018 mostró que el crecimiento esquelético de los corales en condiciones acidificadas se ve afectado principalmente por una capacidad reducida para construir exoesqueletos densos, en lugar de afectar la extensión lineal del exoesqueleto. Usando modelos climáticos globales, muestran que la densidad de algunas especies de corales podría reducirse en más del 20% para fines de este siglo.
Un experimento in situ en un parche de 400 m de la Gran Barrera de Coral para reducir el nivel de CO 2 del agua de mar (aumentar el pH) hasta acercarse al valor preindustrial mostró un aumento del 7 % en la calcificación neta. Un experimento similar para elevar el nivel de CO 2 del agua de mar in situ (pH más bajo) a un nivel esperado poco después de mediados de este siglo encontró que la calcificación neta disminuyó un 34 %.
La acidificación de los océanos puede obligar a algunos organismos a reasignar recursos fuera de los puntos finales productivos, como el crecimiento, para mantener la calcificación. Por ejemplo, se sabe que la ostra Magallana gigas experimenta cambios metabólicos junto con tasas de calcificación alteradas debido a las compensaciones energéticas que resultan de los desequilibrios del pH.
En algunos lugares, el dióxido de carbono burbujea desde el fondo del mar, cambiando localmente el pH y otros aspectos de la química del agua de mar. Los estudios de estas filtraciones de dióxido de carbono han documentado una variedad de respuestas de diferentes organismos. Las comunidades de arrecifes de coral ubicadas cerca de filtraciones de dióxido de carbono son de particular interés debido a la sensibilidad de algunas especies de corales a la acidificación. En Papua Nueva Guinea, la disminución del pH causada por las filtraciones de dióxido de carbono está asociada con la disminución de la diversidad de especies de coral. Sin embargo, en Palau, las filtraciones de dióxido de carbono no están asociadas con una diversidad reducida de especies de corales, aunque la bioerosión de los esqueletos de coral es mucho mayor en sitios con pH bajo.
La acidificación del océano puede afectar el secuestro de carbono de la atmósfera impulsado biológicamente por el océano hacia el interior del océano y los sedimentos del fondo marino, debilitando la llamada bomba biológica. La acidificación del agua de mar también podría hacer que el fitoplancton antártico sea más pequeño y menos efectivo para almacenar carbono. Dichos cambios se estudian y sintetizan cada vez más mediante el uso de marcos fisiológicos, incluido el marco de la vía de resultados adversos (AOP).
Otros impactos biológicos
Aparte de la desaceleración y/o reversión de la calcificación, los organismos pueden sufrir otros efectos adversos, ya sea indirectamente a través de impactos negativos en los recursos alimentarios, o directamente como efectos reproductivos o fisiológicos. Por ejemplo, los niveles oceánicos elevados de CO 2 pueden producir CO2acidificación inducida de los fluidos corporales, conocida como hipercapnia. Además, se cree que el aumento de la acidez de los océanos tiene una serie de consecuencias directas. Por ejemplo, se ha observado que el aumento de la acidez: reduce las tasas metabólicas en el calamar gigante; deprimir las respuestas inmunes de los mejillones azules. Esto posiblemente se deba a que la acidificación del océano puede alterar las propiedades acústicas del agua de mar, permitiendo que el sonido se propague más y aumentando el ruido del océano. Esto afecta a todos los animales que utilizan el sonido para la ecolocalización o la comunicación. Los huevos de calamar de aleta larga del Atlántico tardaron más en eclosionar en agua acidificada, y el estatolito del calamar era más pequeño y malformado en animales colocados en agua de mar con un pH más bajo. El PH más bajo se simuló con 20 a 30 veces la cantidad normal de CO 2.Sin embargo, al igual que con la calcificación, hasta el momento no existe una comprensión completa de estos procesos en los organismos o ecosistemas marinos.
Otro posible efecto sería un aumento de los eventos de marea roja, lo que podría contribuir a la acumulación de toxinas (ácido domoico, brevetoxina, saxitoxina) en organismos pequeños como las anchoas y los mariscos, lo que a su vez aumentaría los casos de intoxicación amnésica por mariscos, intoxicación neurotóxica por mariscos y envenenamiento paralizante por mariscos.
Aunque la marea roja es dañina, otros organismos fotosintéticos beneficiosos pueden beneficiarse del aumento de los niveles de dióxido de carbono. Lo más importante, los pastos marinos se beneficiarán. Un experimento realizado en 2018 concluyó que a medida que los pastos marinos aumentaban su actividad fotosintética, aumentaban las tasas de calcificación de las algas calcificantes. Esta podría ser una posible técnica de mitigación ante el aumento de la acidez.
La acidificación de los océanos puede beneficiar a algunas especies, por ejemplo, aumentando la tasa de crecimiento de la estrella de mar Pisaster ochraceus.
Larvas de pescado
La acidificación de los océanos también puede afectar a las larvas de peces marinos. Afecta internamente sus sistemas olfativos, que es una parte crucial de su desarrollo, especialmente en la etapa inicial de su vida. Las larvas de pez payaso anaranjado viven principalmente en arrecifes oceánicos que están rodeados de islas de vegetación. Con el uso de su sentido del olfato, se sabe que las larvas pueden detectar las diferencias entre los arrecifes rodeados de islas de vegetación y los arrecifes que no están rodeados de islas de vegetación. Las larvas de pez payaso deben poder distinguir entre estos dos destinos para tener la capacidad de ubicar un área que sea satisfactoria para su crecimiento. Otro uso de los sistemas olfativos de los peces marinos es ayudar a determinar la diferencia entre sus progenitores y otros peces adultos para evitar la endogamia.
En las instalaciones del acuario experimental de la Universidad James Cook, los peces payaso se mantuvieron en agua de mar no manipulada que obtuvo un pH de 8,15 ± 0,07, que es similar al pH de nuestro océano actual. Para probar los efectos de los diferentes niveles de pH, el agua de mar se manipuló a tres niveles de pH diferentes, incluido el pH no manipulado. Los dos niveles de pH opuestos se corresponden con los modelos de cambio climático que predicen los niveles futuros de CO 2 atmosférico. En el año 2100 el modelo predice que potencialmente podríamos adquirir CO 2niveles a 1.000 ppm, lo que se correlaciona con el pH de 7,8 ± 0,05. Los resultados de este experimento muestran que cuando las larvas se exponen a un pH de 7,8 ± 0,05, su reacción a las señales ambientales difiere drásticamente de la reacción de las larvas a las señales en un pH no manipulado. Al pH de 7,6 ± 0,05, las larvas no reaccionaron a ningún tipo de señal. Estos resultados muestran los resultados negativos que posiblemente podrían ser el futuro para las larvas de peces marinos. Sin embargo, estudios recientes publicados en 2021 y 2022 sugieren que los efectos de la acidificación de los océanos en el comportamiento de las larvas de peces pueden no ser universales o tan graves como se pensaba anteriormente.
Comportamiento de los peces
Múltiples estudios publicados en 2009 y 2010 informaron efectos drásticos de la acidificación del océano en el comportamiento de los peces de coral. Esto condujo a más de una década de investigación sobre los efectos de la acidificación de los océanos en el comportamiento animal, incluidos los peces y los invertebrados. Sin embargo, un estudio en 2020 cuestionó el impacto negativo potencial del nivel de acidificación del océano de fin de siglo en el comportamiento de los peces de coral, informando que los resultados de los estudios antes mencionados de 2009 a 2010 no eran replicables y sugiriendo que el efecto de la acidificación en los peces el comportamiento puede ser insignificante.Además, un metanálisis publicado en 2022 encontró que los tamaños del efecto de los estudios publicados que prueban los efectos de la acidificación del océano en el comportamiento de los peces han disminuido en un orden de magnitud durante la última década y han sido insignificantes durante los últimos cinco años, lo que constituye un ejemplo de libro de texto. del efecto decadencia en la ciencia.
Impactos en los ecosistemas amplificados por el calentamiento y la desoxigenación de los océanos
Si bien todavía se están documentando todas las implicaciones del CO 2 elevado en los ecosistemas marinos, existe un cuerpo sustancial de investigación que muestra que una combinación de acidificación de los océanos y temperatura oceánica elevada, impulsada principalmente por las emisiones de CO 2 y otros gases de efecto invernadero, tiene un efecto combinado. sobre la vida marina y el medio ambiente oceánico. Este efecto supera con creces el impacto dañino individual de cualquiera de los dos. Además, el calentamiento de los océanos exacerba la desoxigenación de los océanos, que es un factor de estrés adicional para los organismos marinos, al aumentar la estratificación de los océanos, a través de los efectos de densidad y solubilidad, lo que limita los nutrientes y, al mismo tiempo, aumenta la demanda metabólica.
Los metaanálisis han cuantificado la dirección y la magnitud de los efectos nocivos de la acidificación, el calentamiento y la desoxigenación de los océanos. Estos metanálisis han sido probados más a fondo por estudios de mesocosmos que simularon la interacción de estos factores estresantes y encontraron un efecto catastrófico en la red alimentaria marina, es decir, que los aumentos en el consumo debido al estrés térmico anulan con creces cualquier productor primario para herbívoros aumento de CO elevado 2.
Impactos no biológicos
Dejando de lado los efectos biológicos directos, se espera que la acidificación de los océanos en el futuro conduzca a una disminución significativa en el enterramiento de sedimentos carbonatados durante varios siglos, e incluso a la disolución de los sedimentos carbonatados existentes. Esto provocará una elevación de la alcalinidad del océano, lo que conducirá a la mejora del océano como reservorio de CO 2 con implicaciones para el cambio climático a medida que más CO 2 sale de la atmósfera hacia el océano.
Impactos en la industria humana
La amenaza de acidificación incluye una disminución de la pesca comercial y de la industria y la economía del turismo en el Ártico. Las pesquerías comerciales están amenazadas porque la acidificación daña los organismos calcificadores que forman la base de las redes alimentarias del Ártico.
Los pterópodos y las estrellas frágiles forman la base de las redes tróficas del Ártico y están gravemente dañados por la acidificación. Los caparazones de los pterópodos se disuelven con el aumento de la acidificación y las estrellas quebradizas pierden masa muscular cuando vuelven a crecer apéndices. Para que los pterópodos creen caparazones, necesitan aragonito que se produce a través de iones de carbonato y calcio disuelto. Los pterópodos se ven gravemente afectados porque los crecientes niveles de acidificación han disminuido constantemente la cantidad de agua sobresaturada con carbonato que se necesita para la creación de aragonito. Las aguas del Ártico están cambiando tan rápidamente que estarán subsaturadas con aragonito a principios de 2016. Además, los huevos de la estrella quebradiza mueren en unos pocos días cuando se exponen a las condiciones esperadas como resultado de la acidificación del Ártico.La acidificación amenaza con destruir las redes alimentarias del Ártico desde la base. Las redes alimentarias del Ártico se consideran simples, lo que significa que hay pocos pasos en la cadena alimentaria desde los organismos pequeños hasta los depredadores más grandes. Por ejemplo, los pterópodos son "una presa clave de varios depredadores superiores: plancton, peces, aves marinas y ballenas más grandes". Tanto los pterópodos como las estrellas de mar sirven como una importante fuente de alimento y su eliminación de la red alimentaria simple supondría una grave amenaza para todo el ecosistema. Los efectos sobre los organismos calcificadores en la base de las redes tróficas podrían potencialmente destruir las pesquerías. El valor del pescado capturado en las pesquerías comerciales de EE. UU. en 2007 se valoró en $ 3.8 mil millones y de ese 73% se derivó de calcificadores y sus depredadores directos.Otros organismos se dañan directamente como resultado de la acidificación. Por ejemplo, la disminución en el crecimiento de calcificadores marinos como la langosta americana, el quahog oceánico y las vieiras significa que hay menos carne de mariscos disponible para la venta y el consumo. Las pesquerías de cangrejo rey rojo también se encuentran en una seria amenaza porque los cangrejos son calcificadores y dependen de los iones de carbonato para el desarrollo del caparazón. El cangrejo real rojo bebé cuando se expuso a mayores niveles de acidificación experimentó una mortalidad del 100 % después de 95 días. En 2006, el cangrejo real rojo representó el 23% de los niveles de captura de referencia totales y una disminución grave en la población de cangrejo rojo amenazaría la industria de recolección de cangrejo.Es probable que varios bienes y servicios oceánicos se vean socavados por la futura acidificación de los océanos, lo que podría afectar los medios de subsistencia de entre 400 y 800 millones de personas, según el escenario de emisión.
Impactos en los pueblos indígenas
La acidificación podría dañar la economía turística del Ártico y afectar la forma de vida de los pueblos indígenas. Un pilar importante del turismo en el Ártico es la industria de la pesca y la caza deportivas. La industria de la pesca deportiva se ve amenazada por el colapso de las redes alimentarias que proporcionan alimento a los preciados peces. Una disminución en el turismo reduce la entrada de ingresos en el área y amenaza las economías que dependen cada vez más del turismo. La rápida disminución o desaparición de la vida marina también podría afectar la dieta de los pueblos indígenas.
Posibles respuestas
Reducir las emisiones de gases de efecto invernadero
Los miembros del Panel InterAcademy recomendaron que para 2050, las emisiones antropogénicas globales de CO 2 se reduzcan menos del 50% del nivel de 1990. La declaración de 2009 también instó a los líderes mundiales a:
- Reconocer que la acidificación de los océanos es una consecuencia directa y real del aumento de las concentraciones atmosféricas de CO 2 , ya está teniendo un efecto en las concentraciones actuales y es probable que cause graves daños a importantes ecosistemas marinos a medida que las concentraciones de CO 2 alcancen las 450 [partes por millón (ppm)] y superior;
- ... Reconocer que reducir la acumulación de CO 2 en la atmósfera es la única solución viable para mitigar la acidificación de los océanos;
- ... Revitalizar la acción para reducir los factores de estrés, como la sobrepesca y la contaminación, en los ecosistemas marinos para aumentar la resiliencia a la acidificación de los océanos.
La estabilización de las concentraciones atmosféricas de CO 2 en 450 ppm requeriría reducciones de emisiones a corto plazo, con reducciones más pronunciadas con el tiempo.
El Consejo Asesor Alemán sobre Cambio Global declaró:
Para evitar la interrupción de la calcificación de los organismos marinos y el riesgo resultante de alterar fundamentalmente las redes alimentarias marinas, se debe obedecer la siguiente regla de seguridad: el pH de las aguas cercanas a la superficie no debe caer más de 0,2 unidades por debajo del valor promedio preindustrial. en cualquier región oceánica más grande (ni en la media global).
Un objetivo político relacionado con la acidez de los océanos es la magnitud del calentamiento global futuro. Las partes de la Convención Marco de las Naciones Unidas sobre el Cambio Climático (CMNUCC) adoptaron el objetivo de limitar el calentamiento por debajo de 2 °C, en relación con el nivel preindustrial. Alcanzar este objetivo requeriría reducciones sustanciales en las emisiones antropogénicas de CO 2.
Limitar el calentamiento global por debajo de 2 °C implicaría una reducción del pH de la superficie del océano de 0,16 con respecto a los niveles preindustriales. Esto representaría una disminución sustancial en el pH de la superficie del océano.
El 25 de septiembre de 2015, la USEPA rechazó una petición de los ciudadanos del 30 de junio de 2015 que solicitaba a la EPA que regulara el CO 2 bajo la TSCA para mitigar la acidificación de los océanos. En la negación, la EPA dijo que los riesgos de la acidificación de los océanos estaban siendo "abordados de manera más eficiente y efectiva" bajo acciones nacionales, por ejemplo, bajo el Plan de Acción Climático Presidencial, y que se están buscando múltiples vías para trabajar con y en otras naciones para reducir las emisiones. y la deforestación y promover la energía limpia y la eficiencia energética.
El 28 de marzo de 2017, EE. UU. por orden ejecutiva rescindió el Plan de Acción Climática. El 1 de junio de 2017 se anunció que EE. UU. se retiraría de los acuerdos de París y el 12 de junio de 2017 que EE. UU. se abstendría del Compromiso de Cambio Climático del G7, dos importantes esfuerzos internacionales para reducir las emisiones de CO2.
Otras soluciones, como aumentar la superficie dedicada a los bosques y fomentar el crecimiento de plantas marinas que respiran CO2 , pueden mitigar la acidificación de los océanos.
Geoingeniería
Se ha propuesto la geoingeniería como una posible respuesta a la acidificación de los océanos. La declaración de IAP (2009) dijo que se necesita más investigación para demostrar que esto sería seguro, asequible y valioso:
Es probable que los enfoques de mitigación, como agregar productos químicos para contrarrestar los efectos de la acidificación, sean costosos, solo parcialmente efectivos y solo a una escala muy local, y pueden presentar riesgos adicionales imprevistos para el medio ambiente marino. Ha habido muy poca investigación sobre la viabilidad y los impactos de estos enfoques. Se necesita una investigación sustancial antes de poder aplicar estas técnicas.
Los informes del WGBU (2006), la Royal Society del Reino Unido (2009) y el Consejo Nacional de Investigación de EE. UU. (2011) advirtieron sobre los posibles riesgos y dificultades asociados con la ingeniería climática.
Fertilización con hierro
La fertilización con hierro del océano podría estimular la fotosíntesis en el fitoplancton (ver Hipótesis del hierro). El fitoplancton convertiría el dióxido de carbono disuelto del océano en carbohidratos y oxígeno gaseoso, parte del cual se hundiría en las profundidades del océano antes de oxidarse. Más de una docena de experimentos en mar abierto confirmaron que agregar hierro al océano aumenta la fotosíntesis en el fitoplancton hasta 30 veces. Si bien este enfoque se ha propuesto como una posible solución al problema de la acidificación de los océanos, la mitigación de la acidificación de la superficie del océano podría aumentar la acidificación en las profundidades del océano menos habitadas.
Un informe de la Royal Society del Reino Unido (2009) revisó el enfoque en cuanto a eficacia, asequibilidad, puntualidad y seguridad. La calificación de asequibilidad fue "media" o "no se esperaba que fuera muy rentable". Para los otros tres criterios, las calificaciones variaron de "bajo" a "muy bajo" (es decir, no bueno). Por ejemplo, con respecto a la seguridad, el informe encontró un "[alto] potencial de efectos secundarios ecológicos indeseables", y que la fertilización del océano "puede aumentar las regiones anóxicas del océano ('zonas muertas')".
Objetivos globales
El problema de la acidificación de los océanos está incluido en una de las metas del Objetivo de Desarrollo Sostenible 14 de las Naciones Unidas: la acidificación de los océanos se aborda directamente en la meta ODS 14.3. El título completo de la Meta 14.3 es: "Minimizar y abordar los impactos de la acidificación de los océanos, incluso mediante una mayor cooperación científica a todos los niveles". Esta meta tiene un indicador: el indicador 14.3.1 es la "acidez marina promedio (pH) medida en un conjunto acordado de estaciones de muestreo representativas".
La acidificación de los océanos en el pasado geológico
La acidificación de los océanos ha ocurrido anteriormente en la historia de la Tierra, y el colapso ecológico resultante en los océanos tuvo efectos duraderos en el clima y el ciclo del carbono global. El ejemplo más notable es el Máximo Térmico del Paleoceno-Eoceno (PETM), que ocurrió hace aproximadamente 56 millones de años cuando cantidades masivas de carbono ingresaron al océano y la atmósfera, y llevaron a la disolución de los sedimentos de carbonato en todas las cuencas oceánicas.
Tres de los cinco grandes eventos de extinción masiva en el pasado geológico estuvieron asociados con un rápido aumento en el dióxido de carbono atmosférico, probablemente debido al vulcanismo y/o la disociación térmica de los hidratos de gas marinos. Las primeras investigaciones se centraron en los efectos climáticos de los niveles elevados de CO 2 sobre la biodiversidad, pero en 2004 se sugirió que la disminución de la saturación de CaCO 3 debido a la absorción de CO 2 volcanicogénico por el agua de mar era un posible mecanismo de destrucción durante la extinción masiva marina a finales del Triásico..La crisis biótica del final del Triásico sigue siendo el ejemplo mejor establecido de una extinción masiva marina debido a la acidificación del océano, porque (a) la actividad volcánica, los cambios en los isótopos de carbono, la disminución de la sedimentación de carbonato y la extinción marina coincidieron precisamente en el registro estratigráfico., y (b) hubo una selectividad pronunciada de la extinción contra organismos con esqueletos aragoníticos gruesos, que se predice a partir de estudios experimentales. También se ha sugerido que la acidificación de los océanos es una causa de la extinción masiva del final del Pérmico y la crisis del final del Cretácico.
Galería
 pH de la superficie del mar "actual" (década de 1990)
pH de la superficie del mar "actual" (década de 1990) Alcalinidad actual
Alcalinidad actual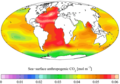 "Actualidad" (década de 1990) CO antropogénico en la superficie del mar2
"Actualidad" (década de 1990) CO antropogénico en la superficie del mar2 Inventario vertical de CO antropogénico "actual" (década de 1990)2
Inventario vertical de CO antropogénico "actual" (década de 1990)2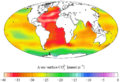 Cambio en la superficie CO3ion desde 1700 hasta 1990
Cambio en la superficie CO3ion desde 1700 hasta 1990 DIC actual
DIC actual DIC preindustrial
DIC preindustrial A NOAA (AOML) in situ CO2sensor de concentración (SAMI-CO2), conectado a una estación del sistema de alerta temprana de arrecifes de coral, utilizado para realizar estudios de acidificación del océano cerca de áreas de arrecifes de coral
A NOAA (AOML) in situ CO2sensor de concentración (SAMI-CO2), conectado a una estación del sistema de alerta temprana de arrecifes de coral, utilizado para realizar estudios de acidificación del océano cerca de áreas de arrecifes de coral Un CO autónomo amarrado de la NOAA (PMEL)2boya utilizada para medir CO2estudios de concentración y acidificación de los océanos
Un CO autónomo amarrado de la NOAA (PMEL)2boya utilizada para medir CO2estudios de concentración y acidificación de los océanos
Contenido relacionado
Calima (meteorología)
Fosa séptica
Destilación mundial
![{displaystyle {Omega }={frac {left[{ce {Ca^2+}}right]left[{ce {CO3^2-}}right]}{K_{sp} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0422ec8bbb280ae8547a20d486b928b0c21846f4)