Acetileno
Acetileno (nombre sistemático: etino) es el compuesto químico con la fórmula C2H2 y estructura H−C≡C−H. Es un hidrocarburo y el alquino más simple. Este gas incoloro se usa ampliamente como combustible y componente químico. Es inestable en su forma pura y, por lo tanto, generalmente se maneja como una solución. El acetileno puro es inodoro, pero los grados comerciales suelen tener un olor marcado debido a impurezas como el sulfuro de divinilo y la fosfina.
Como alquino, el acetileno no está saturado porque sus dos átomos de carbono están unidos en un enlace triple. El triple enlace carbono-carbono coloca a los cuatro átomos en la misma línea recta, con ángulos de enlace CCH de 180°.
Descubrimiento
El acetileno fue descubierto en 1836 por Edmund Davy, quien lo identificó como un "nuevo carburador de hidrógeno". Fue un descubrimiento accidental al intentar aislar el potasio metálico. Al calentar carbonato de potasio con carbón a temperaturas muy altas, produjo un residuo de lo que ahora se conoce como carburo de potasio (K2C2), que reaccionó con agua para liberar el nuevo gas. Fue redescubierta en 1860 por el químico francés Marcellin Berthelot, quien acuñó el nombre acétylène. Fórmula empírica de Berthelot para el acetileno (C4H2), así como el nombre alternativo "quadricarbure d'hydrogène" (cuadricarburo de hidrógeno), eran incorrectos porque muchos químicos en ese momento usaban la masa atómica incorrecta para el carbono (6 en lugar de 12). Berthelot pudo preparar este gas haciendo pasar vapores de compuestos orgánicos (metanol, etanol, etc.) a través de un tubo al rojo vivo y recogiendo el efluente. También descubrió que el acetileno se formaba al generar electricidad a través de una mezcla de gases de cianógeno e hidrógeno. Más tarde, Berthelot obtuvo acetileno directamente pasando hidrógeno entre los polos de un arco de carbón.
Preparación
Desde la década de 1950, el acetileno se fabrica principalmente mediante la combustión parcial de metano. Es un subproducto recuperado en la producción de etileno por craqueo de hidrocarburos. En 1983 se produjeron aproximadamente 400.000 toneladas con este método. Su presencia en el etileno suele ser indeseable debido a su carácter explosivo y su capacidad para envenenar los catalizadores de Ziegler-Natta. Se hidrogena selectivamente en etileno, generalmente utilizando catalizadores de Pd-Ag.
Hasta la década de 1950, cuando el petróleo reemplazó al carbón como principal fuente de carbono reducido, el acetileno (y la fracción aromática del alquitrán de hulla) era la principal fuente de productos químicos orgánicos en la industria química. Fue preparado por la hidrólisis del carburo de calcio, una reacción descubierta por Friedrich Wöhler en 1862 y todavía familiar para los estudiantes:
- Ca(OH)2 + C2H_{2 ^}}}}" xmlns="http://www.w3.org/1998/Math/MathML">CaC2+2H2Orestablecimiento restablecimiento Ca()Oh.)2+C2H2↑ ↑ {displaystyle {ce {CaC2 + 2H2O - titulada Ca(OH)2 + C2H_{2 ^}}}
Ca(OH)2 + C2H_{2 ^}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6052f9c74ee50be51eeb859165bc069f47b2fe94" style="vertical-align: -1.338ex; width:38.499ex; height:3.343ex;"/>
La producción de carburo de calcio requiere temperaturas extremadamente altas, ~2000 °C, lo que requiere el uso de un horno de arco eléctrico. En los EE. UU., este proceso fue una parte importante de la revolución química de finales del siglo XIX que permitió el enorme proyecto de energía hidroeléctrica en las Cataratas del Niágara.
Vínculos
En términos de la teoría del enlace de valencia, en cada átomo de carbono el orbital 2s se hibrida con un orbital 2p formando así un híbrido sp. Los otros dos orbitales 2p permanecen sin hibridar. Los dos extremos de los dos orbitales híbridos sp se superponen para formar un fuerte enlace de valencia σ entre los carbonos, mientras que en cada uno de los otros dos extremos los átomos de hidrógeno también se unen mediante enlaces σ. Los dos orbitales 2p sin cambios forman un par de enlaces π más débiles.
Dado que el acetileno es una molécula simétrica lineal, posee el grupo puntual D∞h.
Propiedades físicas
Cambios de estado
A presión atmosférica, el acetileno no puede existir como líquido y no tiene un punto de fusión. El punto triple del diagrama de fase corresponde al punto de fusión (−80,8 °C) a la presión mínima a la que puede existir acetileno líquido (1,27 atm). A temperaturas por debajo del punto triple, el acetileno sólido puede convertirse directamente en vapor (gas) por sublimación. El punto de sublimación a presión atmosférica es −84,0 °C.
Otro
A temperatura ambiente, la solubilidad del acetileno en acetona es de 27,9 g por kg. Para la misma cantidad de dimetilformamida (DMF), la solubilidad es de 51 g. En 20,26 bar, la solubilidad aumenta a 689,0 y 628,0 g para acetona y DMF, respectivamente. Estos solventes se utilizan en cilindros de gas a presión.
Aplicaciones
Soldadura
Aproximadamente el 20 % del acetileno es suministrado por la industria de gases industriales para soldadura y corte con gas oxiacetileno debido a la alta temperatura de la llama. La combustión de acetileno con oxígeno produce una llama de más de 3600 K (3330 °C; 6020 °F), liberando 11,8 kJ/g. El oxiacetileno es el gas combustible común de combustión más caliente. El acetileno es la tercera llama química natural más caliente después de los 5260 K (4990 °C; 9010 °F) del dicianoacetileno y el cianógeno a 4798 K (4525 °C; 8177 °F). La soldadura con oxiacetileno fue un proceso de soldadura popular en décadas anteriores. El desarrollo y las ventajas de los procesos de soldadura por arco han hecho que la soldadura con oxígeno y combustible casi se haya extinguido para muchas aplicaciones. El uso de acetileno para soldadura se ha reducido significativamente. Por otro lado, el equipo de soldadura de oxiacetileno es bastante versátil, no solo porque se prefiere el soplete para algunos tipos de soldadura de hierro o acero (como en ciertas aplicaciones artísticas), sino también porque se presta fácilmente a la soldadura fuerte, la soldadura fuerte, el calentamiento de metales (para recocer o templar, doblar o formar), el aflojamiento de tuercas y pernos corroídos y otras aplicaciones. Los técnicos de reparación de cables de Bell Canada todavía usan juegos de sopletes portátiles alimentados con acetileno como herramienta de soldadura para sellar empalmes de manguitos de plomo en pozos de visita y en algunas ubicaciones aéreas. La soldadura de oxiacetileno también se puede usar en áreas donde la electricidad no es fácilmente accesible. El corte con oxiacetileno se usa en muchos talleres de fabricación de metales. Para uso en soldadura y corte, las presiones de trabajo deben ser controladas por un regulador, ya que por encima de 15 psi (100 kPa), si se somete a una onda de choque (causada, por ejemplo, por un retroceso), el acetileno se descompone explosivamente en hidrógeno y carbono.
Iluminación portátil
La combustión del acetileno produce una luz fuerte y brillante y la ubicuidad de las lámparas de carburo impulsó gran parte de la comercialización del acetileno a principios del siglo XX. Las aplicaciones comunes incluyeron faros costeros, luces de calles y faros de automóviles y minería. En la mayoría de estas aplicaciones, la combustión directa es un riesgo de incendio, por lo que el acetileno se reemplazó, primero por iluminación incandescente y muchos años después por LED de baja potencia y alto lumen. Sin embargo, las lámparas de acetileno siguen teniendo un uso limitado en áreas remotas o inaccesibles y en países con una red eléctrica central débil o poco confiable.
Plásticos y derivados del ácido acrílico
El acetileno se puede semihidrogenar a etileno, proporcionando una materia prima para una variedad de plásticos de polietileno. Otra aplicación importante del acetileno, especialmente en China, es su conversión en derivados del ácido acrílico. Estos derivados forman productos como fibras acrílicas, vidrios, pinturas, resinas y polímeros.
Excepto en China, el uso de acetileno como materia prima química ha disminuido en un 70 % entre 1965 y 2007 debido a consideraciones ambientales y de costo.
Aplicaciones de nicho
En 1881, el químico ruso Mikhail Kucherov describió la hidratación de acetileno a acetaldehído utilizando catalizadores como el bromuro de mercurio (II). Antes de la llegada del proceso Wacker, esta reacción se realizaba a escala industrial.
La polimerización de acetileno con catalizadores Ziegler-Natta produce películas de poliacetileno. El poliacetileno, una cadena de centros CH con enlaces simples y dobles alternantes, fue uno de los primeros semiconductores orgánicos descubiertos. Su reacción con el yodo produce un material altamente conductor de electricidad. Aunque tales materiales no son útiles, estos descubrimientos condujeron al desarrollo de semiconductores orgánicos, como reconoció el Premio Nobel de Química en 2000 a Alan J. Heeger, Alan G MacDiarmid y Hideki Shirakawa.
En la década de 1920, se utilizó experimentalmente acetileno puro como anestésico por inhalación.
El acetileno se usa a veces para la cementación (es decir, el endurecimiento) del acero cuando el objeto es demasiado grande para caber en un horno.
El acetileno se usa para volatilizar el carbono en la datación por radiocarbono. El material carbonoso de una muestra arqueológica se trata con litio metálico en un pequeño horno de investigación especializado para formar carburo de litio (también conocido como acetiluro de litio). Luego, el carburo se puede hacer reaccionar con agua, como de costumbre, para formar gas acetileno para alimentar un espectrómetro de masas para medir la relación isotópica de carbono-14 a carbono-12.
Ocurrencia natural
La riqueza energética del triple enlace C≡C y la bastante alta solubilidad del acetileno en agua lo convierten en un sustrato adecuado para las bacterias, siempre que se disponga de una fuente adecuada. Se han identificado varias bacterias que viven en el acetileno. La enzima acetileno hidratasa cataliza la hidratación del acetileno para dar acetaldehído:
- CH3CHO}}}" xmlns="http://www.w3.org/1998/Math/MathML">C2H2+H2Orestablecimiento restablecimiento CH3CHO{displaystyle {ce {C2H2 + H2O - Conf. CH3CHO!
CH3CHO}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/fbc2f4de84ff6c3da1258f5bc2b0cdcbf99d6fc6" style="vertical-align: -1.005ex; width:27.776ex; height:2.843ex;"/>
El acetileno es una sustancia química moderadamente común en el universo, a menudo asociada con las atmósferas de los gigantes gaseosos. Un curioso descubrimiento de acetileno se encuentra en Encelado, una luna de Saturno. Se cree que el acetileno natural se forma a partir de la descomposición catalítica de hidrocarburos de cadena larga a temperaturas de 1700 K (1430 °C; 2600 °F) y superiores. Dado que tales temperaturas son muy poco probables en un cuerpo distante tan pequeño, este descubrimiento sugiere potencialmente reacciones catalíticas dentro de esa luna, lo que la convierte en un sitio prometedor para buscar química prebiótica.
Reacciones
Reacciones de vinilación
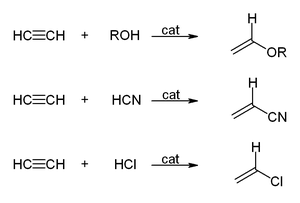
En las reacciones de vinilación, los compuestos H−X se suman a través del triple enlace. Los alcoholes y fenoles se agregan al acetileno para dar éteres de vinilo. Los tioles dan vinil tioéteres. De manera similar, la vinilpirrolidona y el vinilcarbazol se producen industrialmente por vinilación de 2-pirrolidona y carbazol.
La hidratación del acetileno es una reacción de vinilación, pero el alcohol vinílico resultante se isomeriza a acetaldehído. La reacción es catalizada por sales de mercurio. Esta reacción alguna vez fue la tecnología dominante para la producción de acetaldehído, pero ha sido desplazada por el proceso Wacker, que produce acetaldehído por oxidación de etileno, una materia prima más barata. Una situación similar se aplica a la conversión de acetileno en el valioso cloruro de vinilo por hidrocloración frente a la oxicloración de etileno.
Etinilación
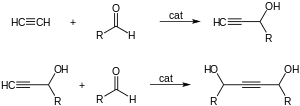
El acetileno se suma a los aldehídos y cetonas para formar alcoholes α-etinílicos:
La reacción con formaldehído se utiliza industrialmente en la producción de butinediol, formando alcohol propargílico como subproducto. Se utiliza acetiluro de cobre como catalizador.
Debido a que los halógenos se suman a través del triple enlace, los acetilenos sustituidos difluoroacetileno, dicloroacetileno, dibromoacetileno y diyodoacetileno no se pueden producir directamente a partir de acetileno. Una solución común es deshidratar los dihaloetenoles de vinilo.
Carbonilación
Walter Reppe descubrió que, en presencia de catalizadores, el acetileno reacciona para dar lugar a una amplia gama de sustancias químicas de importancia industrial.
Con el monóxido de carbono, el acetileno reacciona para dar ácido acrílico o ésteres acrílicos, que se pueden usar para producir vidrio acrílico.
Química organometálica
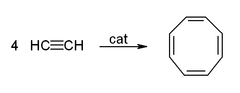
El acetileno y sus derivados (2-butino, difenilacetileno, etc.) forman complejos con los metales de transición. Su unión al metal es algo similar a la de los complejos de etileno. Estos complejos son intermedios en muchas reacciones catalíticas, como la trimerización de alquinos en benceno, la tetramerización en ciclooctatetraeno y la carbonilación en hidroquinona:
- 2 C6H4(OH)2 + FeCO3}}}" xmlns="http://www.w3.org/1998/Math/MathML">Fe()CO)5+4C2H2+2H2Orestablecimiento restablecimiento 2C6H4()Oh.)2+FeCO3{displaystyle {ce {Fe(CO)5 + 4 C2H2 + 2 H2O - titulada 2 C6H4(OH)2 + FeCO3}}
2 C6H4(OH)2 + FeCO3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/3c59ae636489f38762189451d9c93143484d0bae" style="vertical-align: -1.005ex; width:56.336ex; height:3.009ex;"/> en condiciones básicas (50–80 °C20...25 m).
En presencia de ciertos metales de transición, los alquinos sufren metátesis de alquinos.
Acetilidos metálicos, especies de fórmula LnM−C2R, también son comunes. El acetiluro de cobre (I) y el acetiluro de plata se pueden formar en soluciones acuosas con facilidad debido a un equilibrio de solubilidad deficiente.
Reacciones ácido-base
El acetileno tiene un pKa de 25, el acetileno puede ser desprotonado por una superbase para formar un acetiluro:
- RH + HC#CM}}}" xmlns="http://www.w3.org/1998/Math/MathML">HC↑ ↑ CH+RMrestablecimiento restablecimiento RH+HC↑ ↑ CM{displaystyle {ce {cHC#CH + RM - titulada RH + HC#CM}}
RH + HC#CM}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f579f973acd0d4d62e3da5fe185d867ae4fb5fbf" style="vertical-align: -0.505ex; width:35.761ex; height:2.343ex;"/>
Varios reactivos organometálicos e inorgánicos son efectivos.
Seguridad y manejo
El acetileno no es especialmente tóxico, pero cuando se genera a partir de carburo de calcio, puede contener impurezas tóxicas, como trazas de fosfina y arsina, que le dan un olor característico a ajo. También es altamente inflamable, como lo son la mayoría de los hidrocarburos ligeros, de ahí su uso en soldadura. Su peligro más singular está asociado con su inestabilidad intrínseca, especialmente cuando está presurizado: bajo ciertas condiciones, el acetileno puede reaccionar en una reacción de tipo de adición exotérmica para formar una serie de productos, típicamente benceno y/o vinilacetileno, posiblemente además de carbono y hidrógeno. En consecuencia, el acetileno, si se inicia con calor intenso o una onda de choque, puede descomponerse explosivamente si la presión absoluta del gas supera los 200 kilopascales (29 psi). La mayoría de los reguladores y manómetros de los equipos informan sobre la presión manométrica y, por lo tanto, el límite seguro para el acetileno es de 101 kPamanométrico, o 15 psig. Por tanto, se suministra y almacena disuelto en acetona o dimetilformamida (DMF), contenido en una botella de gas con relleno poroso (Agamassan), lo que lo hace seguro para su transporte y uso, con una correcta manipulación. Los cilindros de acetileno deben usarse en posición vertical para evitar extraer acetona durante el uso.
La OSHA, la Asociación de Gas Comprimido, la Administración de Salud y Seguridad Minera de los Estados Unidos (MSHA), la EIGA y otras agencias proporcionan información sobre el almacenamiento seguro de acetileno en cilindros verticales.
El cobre cataliza la descomposición del acetileno y, como resultado, el acetileno no debe transportarse en tuberías de cobre.
Los cilindros deben almacenarse en un área separada de los oxidantes para evitar una reacción exacerbada en caso de incendio o fuga. Los cilindros de acetileno no deben almacenarse en espacios confinados, vehículos cerrados, garajes y edificios, para evitar fugas involuntarias que den lugar a una atmósfera explosiva. En los EE. UU., el Código Eléctrico Nacional (NEC) exige tener en cuenta las áreas peligrosas, incluidas aquellas en las que se puede liberar acetileno durante accidentes o fugas. La consideración puede incluir la clasificación eléctrica y el uso de componentes eléctricos del Grupo A enumerados en EE. UU. En NFPA 497 se encuentra más información sobre cómo determinar las áreas que requieren consideración especial. En Europa, ATEX también requiere consideración para áreas peligrosas donde se pueden liberar gases inflamables durante accidentes o fugas.
Contenido relacionado
Bórax
Selenocisteína
Tiol