Acetaldehído
El acetaldehído (nombre sistemático de la IUPAC etanal) es un compuesto químico orgánico con la fórmula CH3CHO, a veces abreviada por los químicos como MeCHO (Me = metilo). Es un líquido o gas incoloro que hierve cerca de la temperatura ambiente. Es uno de los aldehídos más importantes, se encuentra ampliamente en la naturaleza y se produce a gran escala en la industria. El acetaldehído se encuentra naturalmente en el café, el pan y la fruta madura, y lo producen las plantas. También es producido por la oxidación parcial del etanol por la enzima hepática alcohol deshidrogenasa y es una causa que contribuye a la resaca después del consumo de alcohol. Las vías de exposición incluyen el aire, el agua, la tierra o las aguas subterráneas, así como la bebida y el humo. El consumo de disulfiram inhibe la acetaldehído deshidrogenasa, la enzima responsable del metabolismo del acetaldehído, lo que hace que se acumule en el cuerpo.
La Agencia Internacional para la Investigación del Cáncer (IARC) ha incluido el acetaldehído como carcinógeno del Grupo 1. El acetaldehído es "una de las toxinas del aire que se encuentran con mayor frecuencia con un riesgo de cáncer superior a uno en un millón".
Historia
El acetaldehído fue observado por primera vez por el farmacéutico/químico sueco Carl Wilhelm Scheele (1774); luego fue investigado por los químicos franceses Antoine François, conde de Fourcroy y Louis Nicolas Vauquelin (1800), y los químicos alemanes Johann Wolfgang Döbereiner (1821, 1822, 1832) y Justus von Liebig (1835). En 1835, Liebig lo llamó "aldehído"; el nombre se modificó más tarde a "acetaldehído".
Producción
En 2003, la producción mundial fue de alrededor de 1 millón de toneladas. Antes de 1962, el etanol y el acetileno eran las principales fuentes de acetaldehído. Desde entonces, el etileno es la materia prima dominante.
El principal método de producción es la oxidación de etileno mediante el proceso Wacker, que implica la oxidación de etileno utilizando un sistema homogéneo de paladio/cobre:
En la década de 1970, la capacidad mundial del proceso de oxidación directa de Wacker-Hoechst superó los 2 millones de toneladas anuales.
Se pueden preparar cantidades más pequeñas mediante la oxidación parcial de etanol en una reacción exotérmica. Este proceso generalmente se lleva a cabo sobre un catalizador de plata a aproximadamente 500–650 °C.
Este método es una de las rutas más antiguas para la preparación industrial de acetaldehído.
Otros métodos
Hidratación de acetileno
Antes del proceso Wacker y de la disponibilidad de etileno barato, el acetaldehído se producía mediante la hidratación del acetileno. Esta reacción está catalizada por sales de mercurio (II):
El mecanismo implica la intermediación del alcohol vinílico, que se tautomeriza a acetaldehído. La reacción se lleva a cabo a 90–95 °C, y el acetaldehído formado se separa del agua y el mercurio y se enfría a 25–30 °C. En el proceso de oxidación húmeda, se utiliza sulfato de hierro (III) para volver a oxidar el mercurio a la sal de mercurio (II). El sulfato de hierro (II) resultante se oxida en un reactor separado con ácido nítrico.
Deshidrogenación de etanol
Tradicionalmente, el acetaldehído se producía mediante la deshidrogenación parcial del etanol:
En este proceso endotérmico, el vapor de etanol pasa a 260-290 °C sobre un catalizador a base de cobre. El proceso alguna vez fue atractivo debido al valor del coproducto de hidrógeno, pero en los tiempos modernos no es económicamente viable.
Hidroformilación de metanol
La hidroformilación de metanol con catalizadores como sales de cobalto, níquel o hierro también produce acetaldehído, aunque este proceso no tiene importancia industrial. De manera similar, no competitivo, el acetaldehído surge del gas de síntesis con una selectividad modesta.
Reacciones
Tautomerización de acetaldehído a alcohol vinílico
Al igual que muchos otros compuestos carbonílicos, el acetaldehído se tautomeriza para dar un enol (alcohol vinílico; nombre IUPAC: etenol):
- CH3CH=O ⇌ CH2=CHOH ▪H298,g = +42,7 kJ/mol
La constante de equilibrio es 6×10−7 a temperatura ambiente, por lo que la cantidad relativa de la forma de enol en una muestra de acetaldehído es muy pequeña. A temperatura ambiente, el acetaldehído (CH3CH=O) es más estable que el alcohol vinílico (CH2=CHOH) en 42,7 kJ/mol: En general, la tautomerización de ceto-enol ocurre lentamente pero es catalizada por ácidos.
La tautomerización de ceto-enol fotoinducida es viable en condiciones atmosféricas o estratosféricas. Esta fototautomerización es relevante para la atmósfera terrestre, porque se cree que el alcohol vinílico es un precursor de los ácidos carboxílicos en la atmósfera.
Reacciones de condensación
El acetaldehído es un electrófilo común en la síntesis orgánica. En las reacciones de condensación, el acetaldehído es proquiral. Se utiliza principalmente como fuente de "CH3C+H(OH)" synthon en aldol y reacciones de condensación relacionadas. Los reactivos de Grignard y los compuestos de organolitio reaccionan con MeCHO para dar derivados de hidroxietilo. En una de las reacciones de condensación más espectaculares, se agregan tres equivalentes de formaldehído a MeCHO para dar pentaeritritol, C(CH2OH)4.
En una reacción de Strecker, el acetaldehído se condensa con cianuro y amoníaco para dar, después de la hidrólisis, el aminoácido alanina. El acetaldehído puede condensarse con aminas para producir iminas; por ejemplo, con ciclohexilamina para dar N-etilidenciclohexilamina. Estas iminas se pueden usar para dirigir reacciones posteriores como una condensación aldólica.
También es un componente básico en la síntesis de compuestos heterocíclicos. En un ejemplo, se convierte, tras el tratamiento con amoníaco, en 5-etil-2-metilpiridina ("aldehído-colidina").
Formas poliméricas
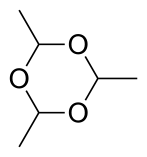
Tres moléculas de acetaldehído se condensan para formar 'paraldehído', un trímero cíclico que contiene enlaces simples C-O. De manera similar, la condensación de cuatro moléculas de acetaldehído da la molécula cíclica de metaldehído. El paraldehído se puede producir con buenos rendimientos, utilizando un catalizador de ácido sulfúrico. El metaldehído solo se obtiene con un rendimiento de un pequeño porcentaje y con enfriamiento, a menudo usando HBr en lugar de H2SO4 como catalizador. A -40 °C en presencia de catalizadores ácidos, se produce poliacetaldehído. Hay dos estereómeros de paraldehído y cuatro de metaldehído.
El químico alemán Valentin Hermann Weidenbusch (1821–1893) sintetizó paraldehído en 1848 tratando el acetaldehído con ácido (ya sea ácido sulfúrico o nítrico) y enfriándolo a 0 °C. Encontró bastante notable que cuando el paraldehído se calentaba con una traza del mismo ácido, la reacción iba en sentido contrario, recreando el acetaldehído.
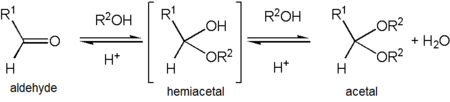
Derivados de acetal
El acetaldehído forma un acetal estable al reaccionar con etanol en condiciones que favorecen la deshidratación. El producto, CH3CH(OCH2CH3)2, se denomina formalmente 1,1-dietoxietano pero comúnmente se le conoce como "acetal". Esto puede causar confusión ya que "acetal" se usa más comúnmente para describir compuestos con los grupos funcionales RCH(OR')2 o RR'C(OR'')2 en lugar de referirse a este compuesto específico; de hecho, el 1,1-dietoxietano también se describe como el dietil acetal del acetaldehído.
Precursora del ácido vinilfosfónico
(feminine)El acetaldehído es un precursor del ácido vinilfosfónico, que se utiliza para fabricar adhesivos y membranas conductoras de iones. La secuencia de síntesis comienza con una reacción con tricloruro de fósforo:
- PCl3 + CH3CHO → CH3CH(O)−)PCl3+
- CH3CH(O)−)PCl3+ + 2 CH3CO2H → CH3CH(Cl)PO(OH)2 + 2 CH3COCl
- CH3CH(Cl)PO(OH)2 → CH2=CHPO(OH)2 + HCl
Bioquímica
En el hígado, la enzima alcohol deshidrogenasa oxida el etanol en acetaldehído, que luego se oxida aún más en ácido acético inofensivo por la acetaldehído deshidrogenasa. Estas dos reacciones de oxidación van acompañadas de la reducción de NAD+ a NADH. En el cerebro, la enzima catalasa es la principal responsable de oxidar el etanol a acetaldehído, y la alcohol deshidrogenasa desempeña un papel menor. Los últimos pasos de la fermentación alcohólica en bacterias, plantas y levaduras implican la conversión de piruvato en acetaldehído y dióxido de carbono por la enzima piruvato descarboxilasa, seguida de la conversión de acetaldehído en etanol. La última reacción es nuevamente catalizada por una alcohol deshidrogenasa, que ahora opera en la dirección opuesta.
Usos
Tradicionalmente, el acetaldehído se usaba principalmente como precursor del ácido acético. Esta aplicación ha disminuido porque el ácido acético se produce de manera más eficiente a partir del metanol mediante los procesos de Monsanto y Cativa. El acetaldehído es un importante precursor de los derivados de piridina, pentaeritritol y crotonaldehído. La urea y el acetaldehído se combinan para dar una resina útil. El anhídrido acético reacciona con el acetaldehído para dar diacetato de etilideno, un precursor del acetato de vinilo, que se usa para producir acetato de polivinilo.
El mercado mundial del acetaldehído está en declive. La demanda se ha visto afectada por los cambios en la producción de alcoholes plastificantes, que se ha desplazado porque el n-butiraldehído se produce con menos frecuencia a partir de acetaldehído, en lugar de generarse por hidroformilación de propileno. Asimismo, el ácido acético, una vez producido a partir de acetaldehído, se produce predominantemente mediante el proceso de carbonilación de metanol de menor costo. El impacto en la demanda ha provocado un aumento de los precios y, por lo tanto, una desaceleración del mercado.
Consumo de acetaldehído (103 t) en 2003
(* Incluido en otros -glioxal/ácido glioxálico, crotonaldehído, ácido láctico, n-butanol, 2-etilhexanol)
| Producto | USA | México | W. Europa | Japón | Total |
|---|---|---|---|---|---|
| Ácido acético/anhidrato acético | - | 11 | 89 | 47 | 147 |
| Esteres de acetato | 35 | 8 | 54 | 224 | 321 |
| Pentaerythritol | 26 | – | 43 | 11 | 80 |
| Bases de piridina y piridina | 73 | – | 10 | * | 83 |
| Ácido peracetico | 23 | – | – | * | 23 |
| 1,3-Butylene glycol | 14 | – | – | * | 14 |
| Otros | 5 | 3 | 10 | 80 | 98 |
| Total | 176 | 22 | 206 | 362 | 766 |
China es el mayor consumidor de acetaldehído del mundo y representó casi la mitad del consumo mundial en 2012. El principal uso ha sido la producción de ácido acético. Se espera que otros usos, como las piridinas y el pentaeritritol, crezcan más rápido que el ácido acético, pero los volúmenes no son lo suficientemente grandes como para compensar la disminución del ácido acético. Como consecuencia, el consumo general de acetaldehído en China puede crecer ligeramente a un 1,6 % anual hasta 2018. Europa occidental es el segundo mayor consumidor de acetaldehído en todo el mundo, y representó el 20 % del consumo mundial en 2012. Al igual que China, el acetaldehído de Europa occidental Se espera que el mercado aumente solo muy levemente a un 1% por año durante 2012–2018. Sin embargo, Japón podría emerger como un consumidor potencial de acetaldehído en los próximos cinco años debido al nuevo uso en la producción comercial de butadieno. El suministro de butadieno ha sido volátil en Japón y el resto de Asia. Esto debería proporcionar el impulso que tanto necesita el mercado plano, a partir de 2013.
Seguridad
Límites de exposición
El valor límite del umbral es de 25 ppm (STEL/valor máximo) y la MAK (Concentración máxima en el lugar de trabajo) es de 50 ppm. A 50 ppm de acetaldehído, no se observa irritación ni daño tisular local en la mucosa nasal. Cuando es absorbido por el organismo, el acetaldehído se metaboliza rápidamente en el hígado a ácido acético. Solo una pequeña proporción se exhala sin cambios. Después de la inyección intravenosa, la vida media en la sangre es de aproximadamente 90 segundos.
Peligros
Toxicidad
Se han registrado muchos casos graves de intoxicación aguda. El acetaldehído se descompone naturalmente en el cuerpo humano.
Irritación
El acetaldehído es un irritante de la piel, los ojos, las membranas mucosas, la garganta y las vías respiratorias. Esto ocurre en concentraciones tan bajas como 1000 ppm. Los síntomas de exposición a este compuesto incluyen náuseas, vómitos y dolor de cabeza. Estos síntomas pueden no ocurrir inmediatamente. El umbral de percepción para el acetaldehído en el aire está en el rango entre 0,07 y 0,25 ppm. A tales concentraciones, el olor afrutado del acetaldehído es evidente. Se han observado irritaciones conjuntivales después de una exposición de 15 minutos a concentraciones de 25 y 50 ppm, pero se ha informado conjuntivitis transitoria e irritación del tracto respiratorio después de una exposición a 200 ppm de acetaldehído durante 15 minutos.
Carcinogenicidad
El acetaldehído es cancerígeno en humanos. En 1988, la Agencia Internacional para la Investigación del Cáncer declaró: "Hay pruebas suficientes de la carcinogenicidad del acetaldehído (el principal metabolito del etanol) en animales de experimentación". En octubre de 2009, la Agencia Internacional para la Investigación del Cáncer actualizó la clasificación del acetaldehído indicando que el acetaldehído incluido y generado endógenamente a partir de bebidas alcohólicas es un carcinógeno humano del Grupo I. Además, el acetaldehído daña el ADN y provoca un desarrollo muscular anormal, ya que se une a las proteínas.
Enlaces cruzados de ADN
El acetaldehído induce enlaces cruzados entre cadenas de ADN, una forma de daño en el ADN. Estos pueden repararse mediante cualquiera de las dos vías de reparación del ADN acopladas a la replicación. La primera se conoce como vía FA, porque emplea productos genéticos defectuosos en pacientes con anemia de Fanconi. Esta vía de reparación da como resultado una mayor frecuencia de mutación y un espectro mutacional alterado. La segunda ruta de reparación requiere la convergencia de la horquilla de replicación, la ruptura del enlace cruzado de acetaldehído, la síntesis de translesión por una ADN polimerasa de la familia Y y la recombinación homóloga.
Factores agravantes
Enfermedad de Alzheimer
Las personas con una deficiencia genética de la enzima responsable de la conversión de acetaldehído en ácido acético pueden tener un mayor riesgo de enfermedad de Alzheimer. "Estos resultados indican que la deficiencia de ALDH2 es un factor de riesgo de LOAD [enfermedad de Alzheimer de inicio tardío]..."
Condiciones genéticas
Un estudio de 818 bebedores empedernidos encontró que aquellos expuestos a más acetaldehído de lo normal a través de una variante genética del gen que codifica la alcohol deshidrogenasa tienen un mayor riesgo de desarrollar cáncer del tracto gastrointestinal superior y del hígado.
Disulfiram
El fármaco disulfiram (Antabuse) inhibe la acetaldehído deshidrogenasa, una enzima que oxida el compuesto en ácido acético. El metabolismo del etanol forma acetaldehído antes de que la acetaldehído deshidrogenasa forme ácido acético, pero con la inhibición de la enzima, se acumula acetaldehído. Si uno consume etanol mientras toma disulfiram, el efecto de resaca del etanol se siente más rápida e intensamente. Como tal, el disulfiram a veces se usa como elemento disuasorio para los alcohólicos que desean mantenerse sobrios.
Fuentes de exposición
Aire interior
El acetaldehído es un contaminante potencial en el lugar de trabajo, en interiores y en ambientes ambientales. Además, la mayoría de los humanos pasan más del 90 % de su tiempo en ambientes interiores, lo que aumenta la exposición y el riesgo para la salud humana.
En un estudio realizado en Francia, la concentración media de acetaldehídos en interiores medida en 16 hogares fue aproximadamente siete veces mayor que la concentración de acetaldehídos en el exterior. El salón tenía una media de 18,1±17,5 μg m−3 y el dormitorio de 18,2±16,9 μg m−3, mientras que el aire exterior tenía una concentración media de 2,3 ±2,6 μg·m−3.
Se ha llegado a la conclusión de que los compuestos orgánicos volátiles (COV) como el benceno, el formaldehído, el acetaldehído, el tolueno y los xilenos deben considerarse contaminantes prioritarios con respecto a sus efectos sobre la salud. Se ha señalado que en edificios renovados o completamente nuevos, los niveles de concentración de COV suelen ser varios órdenes de magnitud más altos. Las principales fuentes de acetaldehídos en los hogares incluyen materiales de construcción, laminados, pisos de PVC, pisos de madera barnizada y pisos de corcho/pino barnizados (que se encuentran en el barniz, no en la madera). También se encuentra en plásticos, pinturas a base de aceite y agua, en techos de madera compuesta, tableros de partículas, madera contrachapada, madera de pino tratada y muebles de aglomerado laminado.
Aire exterior
El uso de acetaldehído está muy extendido en diferentes industrias y puede liberarse a las aguas residuales o al aire durante la producción, el uso, el transporte y el almacenamiento. Las fuentes de acetaldehído incluyen emisiones de combustión de combustible de motores de combustión interna estacionarios y plantas de energía que queman combustibles fósiles, madera o basura, extracción de petróleo y gas, refinerías, hornos de cemento, aserraderos y fábricas de papel. El acetaldehído también está presente en los gases de escape de automóviles y diesel. Como resultado, el acetaldehído es "uno de los tóxicos del aire encontrados con mayor frecuencia con un riesgo de cáncer mayor a uno en un millón".
Humo de tabaco
Se ha demostrado que los polisacáridos naturales del tabaco, incluida la celulosa, son los principales precursores que hacen del acetaldehído un componente importante del humo del tabaco. Se ha demostrado que tiene un efecto sinérgico con la nicotina en estudios de adicción con roedores. El acetaldehído es también el carcinógeno más abundante en el humo del tabaco; se disuelve en la saliva mientras se fuma.
Humo de cannabis
Se ha encontrado acetaldehído en el humo del cannabis. Este hallazgo surgió mediante el uso de nuevas técnicas químicas que demostraron que el acetaldehído presente estaba causando daños en el ADN en entornos de laboratorio.
Consumo de alcohol
Muchos microbios producen acetaldehído a partir del etanol, pero tienen una menor capacidad para eliminar el acetaldehído, lo que puede conducir a la acumulación de acetaldehído en la saliva, el ácido estomacal y el contenido intestinal. Los alimentos fermentados y muchas bebidas alcohólicas también pueden contener cantidades significativas de acetaldehído. El acetaldehído, derivado de la oxidación microbiana o de las mucosas del etanol, el humo del tabaco y la dieta, parece actuar como carcinógeno acumulativo en el tracto digestivo superior de los seres humanos. De acuerdo con la 'Opinión sobre el acetaldehído' del Comité Científico de Seguridad del Consumidor (SCCS) de la Comisión Europea (2012) el límite de riesgo especial de los productos cosméticos es de 5 mg/L y no se debe usar acetaldehído en productos de enjuague bucal.
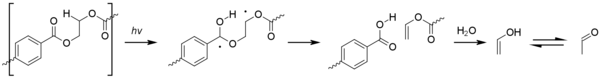
Plásticos
El acetaldehído se puede producir mediante la fotooxidación del tereftalato de polietileno (PET), a través de una reacción de Norrish de tipo II.
Aunque los niveles producidos por este proceso son diminutos, el acetaldehído tiene un umbral de sabor/olor extremadamente bajo de alrededor de 20 a 40 ppb y puede causar un mal sabor en el agua embotellada. El nivel al que un consumidor promedio podría detectar acetaldehído sigue siendo considerablemente más bajo que cualquier toxicidad.
Crecimiento excesivo de cándida
Se ha demostrado queCandida albicans en pacientes con enfermedades orales potencialmente cancerígenas produce acetaldehído en cantidades suficientes para causar problemas.
Contenido relacionado
Espectroscopia de transformada de Fourier
Espectroscopia de absorción atómica
Día del topo