Acción correctiva y preventiva
La acción correctiva y preventiva (CAPA o simplemente acción correctiva) consiste en mejoras a los procesos de una organización que se llevan a cabo para eliminar las causas de las no conformidades u otras situaciones indeseables. Por lo general, se trata de un conjunto de acciones, leyes o reglamentos que una organización debe llevar a cabo en materia de fabricación, documentación, procedimientos o sistemas para rectificar y eliminar las no conformidades recurrentes. La no conformidad se identifica después de una evaluación y un análisis sistemáticos de la causa raíz de la no conformidad. La no conformidad puede ser una queja del mercado o de un cliente, un fallo de la maquinaria o de un sistema de gestión de la calidad, o una interpretación errónea de las instrucciones escritas para realizar el trabajo. La acción correctiva y preventiva la diseña un equipo que incluye personal de control de calidad y personal involucrado en el punto de observación real de la no conformidad. Debe implementarse y observarse sistemáticamente para comprobar su capacidad de eliminar la recurrencia de dicha no conformidad. El método de resolución de problemas de ocho disciplinas, o marco 8D, se puede utilizar como un método eficaz para estructurar un CAPA.
Acción correctiva: Acción adoptada para eliminar las causas de las no conformidades u otras situaciones indeseables, de manera que se evite su recurrencia.
Acción preventiva: Acción adoptada para evitar la ocurrencia de dichas no conformidades, generalmente como resultado de un análisis de riesgos.
En ciertos mercados e industrias, la CAPA puede ser necesaria como parte del sistema de gestión de calidad, como en las industrias de dispositivos médicos y farmacéutica en los Estados Unidos. En este caso, no cumplir con el manejo adecuado de la CAPA se considera una violación de las regulaciones federales de los EE. UU. sobre buenas prácticas de fabricación. Como consecuencia, un medicamento o dispositivo médico puede considerarse adulterado o de calidad inferior si la empresa no ha investigado, registrado y analizado la causa raíz de una no conformidad y no ha diseñado e implementado una CAPA eficaz.
CAPA se utiliza para lograr mejoras en los procesos de una organización y, a menudo, se lleva a cabo para eliminar las causas de las no conformidades u otras situaciones indeseables. CAPA es un concepto dentro de las buenas prácticas de fabricación (BPF), el Análisis de peligros y puntos críticos de control/Análisis de peligros y controles preventivos basados en riesgos (HACCP/HARPC) y numerosas normas empresariales ISO. Se centra en la investigación sistemática de las causas fundamentales de los problemas identificados o los riesgos identificados en un intento de prevenir su recurrencia (para acciones correctivas) o de prevenir su ocurrencia (para acciones preventivas).
Se implementan acciones correctivas en respuesta a quejas de clientes, niveles inaceptables de no conformidad de productos, problemas identificados durante una auditoría interna, así como tendencias adversas o inestables en el monitoreo de productos y procesos, como las que se identificarían mediante el control estadístico de procesos (CEP). Se implementan acciones preventivas en respuesta a la identificación de posibles fuentes de no conformidad.
Para garantizar que las acciones correctivas y preventivas sean eficaces, la investigación sistemática de las causas fundamentales de los fallos es fundamental. CAPA forma parte del sistema de gestión de calidad (SGC) general.
Conceptos
- Fuentes de datos claramente identificadas que identifican problemas para investigar
- Análisis de causa raíz que identifica la causa de una discrepancia o desviación, y sugiere acciones correctivas
Un error muy común es creer que el objetivo de las medidas preventivas es evitar que se produzca un problema potencial similar. Este proceso forma parte de las medidas correctivas porque consiste en determinar las similitudes que deben aplicarse en caso de que se produzca una discrepancia.
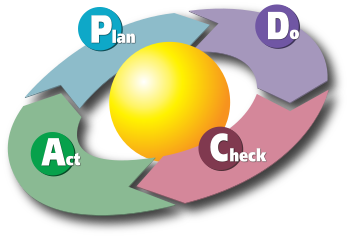
La acción preventiva es cualquier método proactivo utilizado para determinar posibles discrepancias antes de que ocurran y para garantizar que no ocurran (lo que incluye, por ejemplo, el mantenimiento preventivo, la revisión por parte de la dirección u otras formas comunes de prevención de riesgos). Las acciones correctivas y preventivas incluyen etapas de investigación, acción, revisión y, en caso de ser necesario, acciones posteriores. Se puede observar que ambas se ajustan a la filosofía PDCA (planificar-hacer-verificar-actuar) determinada por el ciclo Deming-Shewhart.
Las investigaciones para determinar la causa raíz pueden concluir que no se requieren acciones correctivas o preventivas y, además, pueden sugerir correcciones simples a un problema sin una causa raíz sistémica identificada. Cuando varias investigaciones concluyen que no se toman medidas correctivas, se puede generar un nuevo enunciado del problema con un alcance ampliado y realizar una investigación más exhaustiva para determinar la causa raíz.
La implementación de acciones correctivas y preventivas es el camino hacia la mejora y la eficacia de los sistemas de gestión de la calidad. Las acciones correctivas no son más que acciones basadas en la identificación de problemas. El problema o una no conformidad se puede identificar internamente a través de sugerencias del personal, revisiones de la dirección, revisiones de documentos o auditorías internas. Las pistas externas para encontrar la causa raíz del problema pueden incluir quejas y sugerencias de los clientes; rechazos de los clientes; no conformidades detectadas en auditorías de clientes o de terceros; recomendaciones de los auditores.
Una causa raíz es la identificación e investigación de la fuente del problema en la que se identifica a la(s) persona(s), sistema, proceso o factor externo como la causa de la no conformidad. El análisis de la causa raíz se puede realizar a través de los 5 por qué u otros métodos, por ejemplo, un diagrama de Ishikawa.
La corrección es la acción de eliminar una no conformidad o no conformidad detectada.
La acción preventiva incluye la predicción de problemas y los intentos de evitar que se produzcan (a prueba de fallos) mediante acciones y análisis de iniciativa propia relacionados con los procesos o productos. Esto puede iniciarse con la ayuda de la participación activa de los miembros del personal y los trabajadores a través de equipos de mejora, reuniones de mejora, oportunidades de mejora durante las auditorías internas, revisión de la dirección, retroalimentación de los clientes y la decisión de objetivos propios cuantificados en términos de crecimiento empresarial, reducción de rechazos, uso eficaz de los equipos, etc.
Dispositivos médicos y cumplimiento de la FDA
Para cumplir con el código FDA 21 CFR 820.100 de la Administración de Alimentos y Medicamentos de los Estados Unidos, las empresas de dispositivos médicos deben establecer un proceso CAPA dentro de su sistema de gestión de calidad. Esta parte del sistema puede estar en papel o en formato digital, pero es algo que se busca durante una visita de la FDA. En 2015, se detectaron más de 450 problemas con los sistemas CAPA de las empresas de dispositivos médicos. Para tener un sistema de gestión de calidad que cumpla con la FDA, se requiere la capacidad de capturar, revisar, aprobar, controlar y recuperar procesos de circuito cerrado.
Una acción correctiva también puede ser una corrección de campo, una acción que se lleva a cabo para corregir problemas con productos no conformes. Un ejemplo es la empresa farmacéutica Avanos Medical, que en 2022 llevó a cabo una corrección de campo voluntaria después de recibir informes de 60 lesiones y 23 muertes de pacientes relacionadas con sondas de alimentación nasogástricas mal colocadas mientras usaban su sistema de acceso enteral CORTRAK* 2.
La corrección voluntaria de campo llevó a Avanos Medical a retirar el producto. La FDA lo identificó como un retiro de Clase I, el tipo de retiro más grave.
Ejemplos de acciones correctivas
- Prueba de error
- Alarmas visibles o Audibles
- Rediseño de procesos
- Rediseño de productos
- Definir y aplicar el Plan de Acción
- Capacitación o mejora o modificación de los programas de capacitación existentes
- Mejoras de los calendarios de mantenimiento
- Mejoras en el manejo o almacenamiento de materiales
En algunos casos, puede ser necesaria una combinación de dichas acciones para corregir el problema por completo.
Véase también
- Ocho disciplinas problema solución
- Buenas prácticas de documentación
- Buena práctica de fabricación automatizada (GAMP)
Referencias
- ^ Pruitt, W. Frazier (mayo 2019). "Un enfoque disciplinado". Progreso de calidad. 52 5): 64. Retrieved 31 de octubre 2019.
- ^ Sistema de gestión de calidad ISO 9000 - Fundamentos y vocabulario. ISO. 2005.
- ^ "Tomando el primer paso con PDCA". 2 de febrero de 2009. Retrieved 17 de marzo 2011.
- ^ ISO 9000:2015 (3.12.3)
- ^ "CFR - Código de Reglamento Federal Título 21". www.accessdata.fda.gov. Retrieved 2016-05-20.
- ^ "CAPA Process". 2020. Archivado desde el original el 2022-01-05.
- ^ "¿Tu proceso CAPA necesita una CAPA?". SOLABS. Retrieved 2016-08-29.
- ^ "Guidance for Industry- Q10 Pharmaceutical Quality System" (PDF). www.fda.gov. Retrieved 2016-08-29.
- ^ "Field Correction definition". lawinsider.com. Retrieved 2023-03-09.
- ^ "URGENT: FIELD CORRECTION CORTRAK* 2 Enteral Access System (EAS)" (PDF). static.foxnews.com. Retrieved 2023-03-09.
- ^ "Avanos Medical Recalls Cortrak*2 Enteral Access System for Risk of Misplaced Enteral Tubes could Cause Patient Harm". fda.gov16 de mayo de 2022. Retrieved 2023-03-09.
Enlaces externos
- Quality Systems Approach to Pharmaceutical CGMP Regulations (FDA)