Α-Lactoalbúmina
Sinopsis
La α-lactalbúmina es una proteína que regula la producción de lactosa en la leche de casi todas las especies de mamíferos. En los primates, la expresión de α-lactalbúmina aumenta en respuesta a la hormona prolactina y aumenta la producción de lactosa.
La α-lactalbúmina forma la subunidad reguladora del heterodímero de la lactosa sintasa (LS) y la β-1,4-galactosiltransferasa (beta4Gal-T1) forma el componente catalítico. Juntas, estas proteínas permiten que la LS produzca lactosa mediante la transferencia de fracciones de galactosa a la glucosa. Como multímero, la α-lactalbúmina se une fuertemente a los iones de calcio y zinc y puede poseer actividad bactericida o antitumoral. Una variante de plegamiento de la α-lactalbúmina humana que puede formarse en entornos ácidos como el estómago, llamada HAMLET, probablemente induce apoptosis en células tumorales e inmaduras. La dinámica de plegamiento correspondiente de la α-lactalbúmina es, por lo tanto, muy inusual.
Cuando se forma un complejo con Gal-T1, una galactosiltransferasa, la α-lactalbúmina, aumenta la afinidad de la enzima por la glucosa unas 1000 veces e inhibe la capacidad de polimerizar múltiples unidades de galactosa. Esto da lugar a una vía para la formación de lactosa mediante la conversión de Gal-TI en lactosa sintasa.
Propiedades físicas
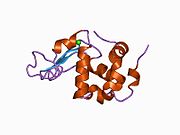
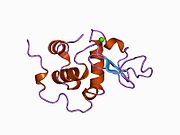
La estructura de la α-lactalbúmina es bien conocida y está compuesta por 123 aminoácidos y 4 puentes disulfuro. El peso molecular es 14178 Da, y el punto isoeléctrico está entre 4,2 y 4,5. La α-lactalbúmina tiene dos formas prominentes: estado holo y estado apo. El estado holo es la forma natural, plegada y unida por calcio. El estado apo se produce en condiciones ácidas y está asociado con la liberación de iones de calcio y el desdoblamiento de la lámina beta. Una de las principales diferencias estructurales con la beta-lactoglobulina es que no tiene ningún grupo tiol libre que pueda servir como punto de partida para una reacción de agregación covalente. Como resultado, la α-lactalbúmina pura no formará geles tras la desnaturalización y la acidificación. La α-lactalbúmina es una proteína que se une al Ca2+ con un único punto fuerte de unión al calcio que se ve a continuación. El calcio se une a los grupos carboxílicos de tres residuos de aspartato (Asp 82, 87, 88), que se ven en azul, y a los grupos carbonilo de la lisina 79 y el aspartato 84, que se ven en violeta. Esta unión está coordinada por dos moléculas de agua (rojas). Estos sitios de unión de residuos se conservan en la mayoría de las especies que contienen α-lactoalbúmina.
Evolución
La comparación de secuencias de la α-lactalbúmina muestra una fuerte similitud con la de las lisozimas, específicamente la c-lisozima que se une al Ca2+. Estas dos proteínas comparten gran parte de su estructura física, pero contienen menos de la mitad de la misma secuencia de aminoácidos y, por lo tanto, varían drásticamente en su función. Por lo tanto, la historia evolutiva esperada es que la duplicación del gen de la c-lisozima fue seguida por una mutación, lo que resultó en la pérdida de la actividad catalítica de la lisozima en la α-lactalbúmina. Este gen es anterior al último ancestro común de los mamíferos y las aves, lo que probablemente sitúa su origen en unos 300 Ma.
Funciones
Las investigaciones actuales están encontrando nuevas aplicaciones de la α-lactoalbúmina más allá de la producción fisiológica de lactosa.
Nutrición: La α-lactalbúmina es esencial para la nutrición del recién nacido. Esta proteína proporciona aminoácidos esenciales y compuestos bioactivos necesarios para un crecimiento, desarrollo y salud óptimos. La α-lactalbúmina es la proteína de suero más abundante en la leche materna y se han investigado sus propiedades para incluirla en fórmulas infantiles para replicar los compuestos de la leche materna. Esta proteína es una fuente importante de aminoácidos ramificados, cisteína y residuos de triptófano, cada uno con beneficios correlacionados para la salud.
Usos clínicos: La α-lactalbúmina se ha investigado en relación con muchas afecciones médicas diferentes y se cree que se correlaciona con resultados positivos. Muchos de estos beneficios se deben a los compuestos bioactivos que la componen y a la capacidad de la proteína para unirse a complejos.
SOP: El síndrome de ovario poliquístico (SOP) es una enfermedad en la que los niveles elevados de α-lactalbúmina se han relacionado con el alivio de los síntomas. Esta afección está estrechamente relacionada con la disbiosis intestinal causada por la inflamación del revestimiento intestinal y un desequilibrio de la microbiota. La α-lactalbúmina promueve cepas bacterianas saludables como Lactobacillus acidophilus, Bifidobacterium short y Bifidobacterium longum. Estas bacterias producen ácidos grasos de cadena corta (AGCC) que mejoran el bioma intestinal. En un estudio controlado, el grupo que consumió una dieta más rica en α-lactalbúmina experimentó una disminución de los síntomas asociados con el SOP y niveles más altos de bacterias saludables. Si bien no existe una cura para esta afección, este podría ser un remedio a corto plazo.
Salud mental: La α-lactalbúmina es una fuente de aminoácidos que están relacionados con una mejor salud mental. Esta proteína es rica en residuos de triptófano, que son precursores de la serotonina, un neurotransmisor asociado con estados de ánimo positivos. La proteína también aumenta la concentración plasmática de otros aminoácidos neutros grandes (LNAA) que ayudan a equilibrar las hormonas. Los residuos de cisteína ayudan en la síntesis de glutatión, que es un antioxidante importante.
Cáncer: Se han realizado numerosas investigaciones sobre los efectos apoptóticos que potencialmente tiene la α-lactalbúmina cuando forma un complejo con el ácido oleico llamado HAMLET (alfa-lactalbúmina humana letal para las células tumorales). Este complejo HAMLET altera la estructura de la membrana cuando se une, lo que promueve la muerte celular para proteger la integridad del organismo. Este complejo puede translocarse a los núcleos de las células cancerosas, pero no a los de las células sanas. En numerosos estudios se ha demostrado que este complejo proteína-OA, cuando se encuentra en las células cancerosas, ralentiza la progresión de los tumores. El estado nativo de la α-lactalbúmina no muestra estas mismas funciones anticancerígenas, por lo que es probable que el ácido oleico exprese las funciones apoptóticas mientras que la α-lactalbúmina es responsable de dirigirse a líneas celulares específicas, como las células cancerosas de colon, vejiga y glioblastoma.
Referencias
- ^ a b c GRCh38: Ensembl release 89: ENSG00000167531 – Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00022991 – Ensembl, May 2017
- ^ "Human PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Entrez Gene: LALBA lactalbumin, alpha-".
- ^ Hall L, Davies MS, Craig RK (enero 1981). "La construcción, identificación y caracterización de plasmides que contienen secuencias humanas de alfa-lactalbumin cDNA". Nucleic Acids Research. 9 (1): 65–84. doi:10.1093/nar/9.1.65. PMC 326669. PMID 6163135.
- ^ Hall L, Emery DC, Davies MS, Parker D, Craig RK (marzo de 1987). "Organización y secuencia del gen humano de alfa-lactalbumin". The Biochemical Journal. 242 (3): 735-742. doi:10.1042/bj2420735. PMC 1147772. PMID 2954544.
- ^ a b Qasba PK, Kumar S (1997). "Inmersión molecular de las lisozimas y alfa-lactalbumin". Critical Reviews in Bioquímica y Biología Molecular. 32 (4): 255–306. doi:10.3109/10409239709082574. PMID 9307874.
- ^ Kleinberg DL, Todd J, Babitsky G (julio de 1983). "Inhibición por estradiol del efecto lactogénico de la prolactina en tejido mamífero primate: reversión por antiestrógenos LY 156758 y tamoxifeno". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 80 (13): 4144–4148. Bibcode:1983PNAS...80.4144K doi:10.1073/pnas.80.13.4144. PMC 394217. PMID 6575400.
- ^ Bu Z, Cook J, Callaway DJ (septiembre 2001). "Regimientos y dinámicas estructurales correlativas en alfa-lactalbumin nativo y denaturizado". Journal of Molecular Biology. 312 (4): 865–873. doi:10.1006/jmbi.2001.5006. PMID 11575938.
- ^ a b c Permyakov EA (agosto 2020). "α-Lactalbumin, Increíble Calcio-Binding Protein". Biomolecules. 10 (9): 1210. doi:10.3390/biom10091210. PMC 7565966. PMID 32825311.
- ^ Acharya KR, Stuart DI, Walker NP, Lewis M, Phillips DC (julio de 1989). "La estructura refinada de babuon alpha-lactalbumin a 1.7 A resolución. Comparación con lysozyme tipo C". Journal of Molecular Biology. 208 (1): 99–127. doi:10.1016/0022-2836(89)90091-0. PMID 2769757.
- ^ a b c El-Fakharany EM, Redwan EM (noviembre 2019). "Complejos proteína-lípidos: estructura molecular, escenarios actuales y mecanismos de citotoxicidad". RSC Advances. 9 (63): 36890-36906 Código:2019RSCAd...936890E. doi:10.1039/C9RA07127J. PMC 9075609. PMID 35539089.
- ^ Prager EM, Wilson AC (1988). "Ancient origin of lactalbumin from lysozyme: analysis of DNA and amino acid sequences". Journal of Molecular Evolution. 27 (4): 326-335. Código: 1988JMolE..27..326P. doi:10.1007/BF02101195. PMID 3146643. S2CID 10039589.
- ^ a b Almeida CC, Mendonça Pereira BF, Leandro KC, Costa MP, Spisso BF, Conte-Junior CA (2021-05-14). Spigno G (ed.). "Compuestos Bioactivos en la Fórmula Infantil y sus Efectos en la Nutrición y la Salud Infantil: Una Revisión de Literatura Sistemática". International Journal of Food Science. 2021: 8850080. doi:10.1155/2021/8850080. PMC 8140835. PMID 34095293.
- ^ a b Cardinale V, Lepore E, Basciani S, Artale S, Nordio M, Bizzarri M, Unfer V (agosto 2022). "Efectos positivos de α-Lactalbumin en la gestión de síntomas del síndrome de ovario poliquístico". Nutrientes. 14 (15): 3220. doi:10.3390/nu14153220. PMC 9370664. PMID 35956395.
Más lectura
- Heine WE, Klein PD, Reeds PJ (marzo de 1991). "La importancia del alfa-lactalbumin en la nutrición infantil". The Journal of Nutrition. 121 (3): 277–283. doi:10.1093/jn/121.3.277. PMID 2002399.
- Permyakov EA, Berliner LJ (mayo de 2000). "alpha-Lactalbumin: estructura y función". Cartas FEBS. 473 (3): 269–274. doi:10.1016/S0014-5793(00)01546-5. PMID 10818224. S2CID 83964232.
- Hall L, Emery DC, Davies MS, Parker D, Craig RK (marzo de 1987). "Organización y secuencia del gen humano de alfa-lactalbumin". The Biochemical Journal. 242 (3): 735-742. doi:10.1042/bj2420735. PMC 1147772. PMID 2954544.
- Davies MS, West LF, Davis MB, Povey S, Craig RK (Julio 1987). "El gen de alfa-lactalbumin humano se asigna al cromosoma 12q13". Annals of Human Genetics. 51 (3): 183–188. doi:10.1111/j.1469-1809.1987.tb00869.x. PMID 3479943. S2CID 37901087.
- Findlay JB, Brew K (mayo de 1972). "La secuencia completa de aminoácidos de -lactalbumin humano". European Journal of Biochemistry. 27 (1): 65–86. doi:10.1111/j.1432-1033.1972.tb01812.x. PMID 5049057.
- Hall L, Craig RK, Edbrooke MR, Campbell PN (junio de 1982). "Comparison of the nucleotide sequence of cloned human and guinea-pig pre-alpha-lactalbumin cDNA with that of gar poll pre-lysozyme cDNA suggests evolution from a common ancestral gene". Nucleic Acids Research. 10 (11): 3503–3515. doi:10.1093/nar/10.11.3503. PMC 320727. PMID 6285305.
- Håkansson A, Zhivotovsky B, Orrenius S, Sabharwal H, Svanborg C (agosto de 1995). "Apoptosis inducida por una proteína de leche humana". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 92 (17): 8064–8068. Código:1995PNAS...92.8064H. doi:10.1073/pnas.92.17.8064. PMC 41287. PMID 7644538.
- Stacey A, Schnieke A, Kerr M, Scott A, McKee C, Cottingham I, et al. (marzo de 1995). "La acción se interrumpe por deficiencia de alfa-lactalbumin y puede ser restaurada por el reemplazo humano del gen alpha-lactalbumin en ratones". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 92 (7): 2835–2839. Bibcode:1995PNAS...92.2835S. doi:10.1073/pnas.92.7.2835. PMC 42313. PMID 7708733.
- Fujiwara Y, Miwa M, Takahashi R, Hirabayashi M, Suzuki T, Ueda M (junio de 1997). "Position-independiente and high-level expression of human alpha-lactalbumin in the milk of transgenic rats carrying a 210-kb YAC DNA". Reproducción y desarrollo molecular. 47 (2): 157–163. doi:10.1002/(SICI)1098-2795(199706)47:2 obtenidos157:::AID-MRD5 confidencial3.0.CO;2-L. PMID 9136116. S2CID 43232515.
- Lindner RA, Kapur A, Carver JA (octubre de 1997). "La interacción de la chaperona molecular, alfa-cristalina, con glóbulos fundidos estados de bovino alfa-lactalbumin". El Diario de Química Biológica. 272 (44): 27722–27729. doi:10.1074/jbc.272.44.27722. PMID 9346914.
- Giuffrida MG, Cavaletto M, Giunta C, Neuteboom B, Cantisani A, Napolitano L, et al. (noviembre de 1997). "El triplete aminoácido inusual Asn-Ile-Cys es un sitio de consenso de glicosislación en alfa-lactalbumin humano". Diario de Química Proteína. 16 (8): 747–753. doi:10.1023/A:1026359715821. PMID 9365923. S2CID 42107172.
- Chandra N, Brew K, Acharya KR (abril de 1998). "Evidencia estructural para la presencia de un sitio de unión de calcio secundario en alfa-lactalbumin humano". Bioquímica. 37 (14): 4767–4772. doi:10.1021/bi973000t. PMID 9537992.
- Håkansson A, Andréasson J, Zhivotovsky B, Karpman D, Orrenius S, Svanborg C (febrero de 1999). "El alfa-lactalbumin multitérmico de la leche humana induce apoptosis a través de un efecto directo en los núcleos celulares". Experimental Cell Research. 246 (2): 451-460. doi:10.1006/excr.1998.4265. PMID 9925761.
- Svensson M, Sabharwal H, Håkansson A, Mossberg AK, Lipniunas P, Leffler H, et al. (marzo de 1999). "Caracterización molecular de variantes plegables de alfa-lactalbumin que inducen apoptosis en células tumorales". El Diario de Química Biológica. 274 (10): 6388–6396. doi:10.1074/jbc.274.10.6388. PMID 10037730.
- Harata K, Abe Y, Muraki M (marzo de 1999). "Evaluación citográfica del movimiento interno de alfa-lactalbumin humano refinada por el método de mínimos cuadrados de masa completa". Journal of Molecular Biology. 287 (2): 347–358. doi:10.1006/jmbi.1999.2598. PMID 10080897.
- Última AM, Schulman BA, Robinson CV, Redfield C (agosto de 2001). "Probar diferencias sutiles en el comportamiento del intercambio de hidrógeno de variantes del glóbulo fundido de alfa-lactalbumin humano utilizando espectrometría de masas". Journal of Molecular Biology. 311 (4): 909-919. doi:10.1006/jmbi.2001.4911. PMID 11518539.
- Bai P, Peng Z (noviembre de 2001). "El plegamiento cooperativo del dominio alfa-helical aislado de la lisozima blanca de huevo de gallina". Journal of Molecular Biology. 314 (2): 321–329. doi:10.1006/jmbi.2001.5122. PMID 11718563.
- Andrews P (agosto de 1970). "Purificación de lactosa sintetase una proteína de la leche humana y demostración de su interacción con alfa-lactalbumin". Cartas FEBS. 9 (5): 297–300. doi:10.1016/0014-5793(70)80382-9. PMID 11947697. S2CID 23041445.
Enlaces externos
- alpha-Lactalbumin en la Biblioteca Nacional de Medicina de los EE.UU.
- Localización del genoma LALBA humano y página de detalles del gen LALBA en el explorador del genoma UCSC.