Α-glucosidasa
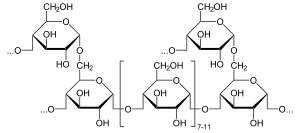

La α-glucosidasa (EC 3.2.1.20, (nombre sistemático α-D-glucósido glucohidrolasa) es una glucosidasa ubicada en el borde en cepillo del intestino delgado que actúa sobre los enlaces α(1→4):
- Hidrolisis de terminal, no reducción (1→4)-vinculado α-D- Residuos de glucosa con liberación de D-glucosa
Esto contrasta con la β-glucosidasa EC 3.2.1.21.
Terminología
GO:0090599, el sentido amplio
La entrada GO:0090599 de Gene Ontology representa el sentido amplio de "alfa-glucosidasa". Se define como "catálisis de la hidrólisis de residuos de alfa-D-glucosa terminales no reductores unidos a alfa con liberación de alfa-D-glucosa". En este sentido, la "alfa-glucosidasa" puede abarcar una amplia gama de actividades enzimáticas, que difieren por el enlace de su terminal (1→3, 1→4 o 1→6), la identidad específica de su sustrato (sacarosa, maltosa o almidón), entre otros aspectos.
EC 3.2.1.20, el sentido estrecho
La definición asociada con el número 3.2.1.20 de la Comisión de Enzimas es más limitada. Requiere que el enlace sea 1→4 y que el sustrato preferido sean oligosacáridos más pequeños (en lugar de polisacáridos más grandes como el almidón: de lo contrario, se incluiría la alfa-amilasa). Los genes humanos que producen enzimas con actividades especificadas por este número EC incluyen:
- MGAM es el "maltase-glucoamylase", encontrado en la frontera del pincel intestino.
- GAA es el "ácido alfa-glucosidase", encontrado en el lisoso.
- GANC, "neutral alpha-glucosidase C".
Entre los sinónimos mencionados por la Comisión se encuentran: maltasa, glucoinvertasa, glucosidosucrasa, maltasa-glucoamilasa, α-glucopiranosidasa, glucosidoinvertasa, α-D-glucosidasa, α-glucósido hidrolasa, α-1,4-glucosidasa, α-D-glucósido glucohidrolasa. No se recomiendan estos nombres porque pueden referirse únicamente a una actividad específica de la enzima o a una proteína específica que tenga esa actividad.
Mecanismo
La α-glucosidasa hidroliza los residuos de α-glucosa no reductores (1→4) terminales para liberar una única molécula de α-glucosa. La α-glucosidasa es una carbohidrato-hidrolasa que libera α-glucosa en lugar de β-glucosa. Los residuos de β-glucosa pueden ser liberados por la glucoamilasa, una enzima funcionalmente similar. La selectividad del sustrato de la α-glucosidasa se debe a las afinidades de subsitios del sitio activo de la enzima. Dos mecanismos propuestos incluyen un desplazamiento nucleofílico y un ion oxocarbenio intermedio.

- Rhodnius prolixus, un insecto chupa sangre, forma hemozoina (Hz) durante la digestión de la hemoglobina anfitriona. La síntesis de hemozoína depende del sitio de unión de sustrato de α-glucosidase.
- El hígado de trucha α-glucosidases fueron extraídos y caracterizados. Se demostró que para una de las truchas hepáticas α-glucosidasas la actividad máxima de la enzima se incrementó un 80% durante el ejercicio en comparación con una trucha de reposo. Este cambio se mostró correlacionado con un aumento de actividad para la fosforilasa de glucógeno hepático. Se propone que la α-glucosidase en el camino glucosídico juega una parte importante en la complementación de la vía fosforolítica en la respuesta metabólica del hígado a las exigencias energéticas del ejercicio.
- Levadura y rata pequeñas α-glucosidasas intestinales han demostrado ser inhibidas por varios grupos de flavonoides.
Estructura

Las α-glucosidasas pueden dividirse, según su estructura primaria, en dos familias. El gen que codifica la α-glucosidasa lisosomal humana tiene una longitud de aproximadamente 20 kb y su estructura ha sido clonada y confirmada.
- Se ha estudiado la α-glucosidasa lisosomal humana para la significación del Asp-518 y otros residuos en proximidad del sitio activo de la enzima. It was found that substituting Asp-513 with Glu-513 interferes with posttranslational modification and intracellular transport of α-glucosidase's precursor. Además, los residuos Trp-516 y Asp-518 se han considerado críticos para la funcionalidad catalítica de la enzima.
- Los cambios cinéticos en la α-glucosidasa han sido inducidos por denaturantes como el cloruro de guanidiio (GdmCl) y las soluciones SDS. Estos desnaturalizadores causan pérdida de actividad y cambio conformacional. Una pérdida de actividad enzimática se produce en concentraciones mucho más bajas de denaturantes que requeridas para cambios conformacionales. Esto lleva a una conclusión de que la conformación del sitio activo de la enzima es menos estable que la conformación de la enzima entera en respuesta a los dos desnaturalizadores.
Importancia de la enfermedad
- Enfermedad de almacenamiento de glucógeno tipo II, también llamado Enfermedad de Pompe: un trastorno en el que la α-glucosidase es deficiente. En 2006, el fármaco alglucosidase alfa se convirtió en el primer tratamiento liberado para la enfermedad de Pompe y actúa como análogo a α-glucosidase. Otros estudios de alglucosidase alfa revelaron que los iminosugares exhiben inhibición de la enzima. Se encontró que una molécula compuesta se une a una sola molécula de enzima. Se demostró que 1-deoxynojirimycin (DNJ) ataba el más fuerte de los azúcares probados y bloqueaban casi por completo el sitio activo de la enzima. Los estudios mejoraron el conocimiento del mecanismo por el cual α-glucosidase se une a los azúcares imino.
- Diabetes: La acarbosa, un inhibidor de α-glucosidase, inhibe competitiva y reversiblemente la α-glucosidase en los intestinos. Esta inhibición reduce la tasa de absorción de glucosa a través de la digestión retardada de carbohidratos y el tiempo prolongado de digestión. La acarbosa puede prevenir el desarrollo de síntomas diabéticos. Por lo tanto, los inhibidores de la α-glucosidasa (como la acarbosa) se utilizan como medicamentos antidiabéticos en combinación con otros medicamentos antidiabéticos. La luteolina ha sido encontrada como un fuerte inhibidor de la α-glucosidasa. El compuesto puede inhibir la enzima hasta un 36% con una concentración de 0,5 mg/ml. A partir de 2016, esta sustancia está siendo probada en ratas, ratones y cultura celular. Se han demostrado analógicas Flavonoide con actividad de inhibición.
- Azoospermia: El diagnóstico de azoospermia tiene potencial para ser ayudado por la medición de la actividad α-glucosidasa en plasma seminal. La actividad en el plasma seminal corresponde a la funcionalidad de la epididiamis.
- Antivirales: Muchos virus animales poseen un sobre externo compuesto por glicoproteínas virales. Estos son a menudo necesarios para el ciclo de vida viral y utilizan maquinaria celular para la síntesis. Los inhibidores de α-glucosidasa muestran que la enzima está involucrada en la vía para N-glycans for virus such as HIV and human hepatitis B virus (HBV). La inhibición de la α-glucosidasa puede prevenir la fusión del VIH y la secreción del HBV.
Véase también
- Alglucosidase alfa
- Inhibidor de la glucosidasa alfa
Algunas otras glucosidasas:
- Cellulase
- Beta-glucosidase
- Glycogen demarcaching enzima
Referencias
- ^ alpha-Glucosidases en la Biblioteca Nacional de Medicina de los EE.UU.
- ^ Bruni, C.B.; Sica, V.; Auricchio, F.; Covelli, I. (1970). "Más caracterización cinética y estructural de la glucohidrolasa lisosomal α-D-glucoside del hígado de ganado". Biochim. Biofias. Acta. 212 (3): 470-477. doi:10.1016/0005-2744(70)90253-6. PMID 5466143.
- ^ Flanagan, P.R.; Forstner, G.G. (1978). "Purificación de la maltasa intestinal de rata/glucoamilasa y su disociación anómala ya sea por calor o por pH bajo". Biochem. J. 173 (2): 553-563. doi:10.1042/bj1730553. PMC 1185809. PMID 29602.
- ^ Larner, J.; Lardy, H.; Myrback, K. (1960). "Otros glucosidases". En Boyer, P.D. (ed.). Las EnzimasVol. 4 (2a edición). New York: Academic Press. pp. 369–378.
- ^ Sivikami, S.; Radhakrishnan, A.N. (1973). "Purificación de glucoamilasa intestinal de conejo por cromatografía afinidad el Sephadex G-200". Indian J. Biochem. Biophys. 10 (4): 283–284. PMID 4792946.
- ^ Sørensen, S.H.; Norén, O.; Sjöström, H.; Danielsen, E.M. (1982). "Microvillus maltase/glucoamylase intestinal de cerdo fifílico. Estructura y especificidad". Eur. J. Biochem. 126 (3): 559-568. doi:10.1111/j.1432-1033.1982.tb06817.x. PMID 6814909.
- ^ "Actividad alfa-glucosidase Termo de ontología genética (GO:0090599)". www.informatics.jax.org. Ver: Definición, Vista del Árbol GO.
- ^ "ENZYME - 3.2.1.20 alpha-glucosidase". enzima.expasy.org.
Grupo de enzimas cuya especificidad se dirige principalmente hacia la exohidrolisis de los vínculos 1,4-alfa-glucosidicos, y que hidrolizan los oligosacáridos rápidamente, en relación con los polisacáridos, que se hidrolizan relativamente lentamente, o no en absoluto.
- ^ "ExplorEnz: EC 3.2.1.20". www.enzyme-database.org.
- ^ "EC 3.2.1.20". ExPASy. Retrieved 1 de marzo 2012.
- ^ a b c Chiba S (agosto de 1997). "Molecular mechanism in α-glucosidase and glucoamylase". Biosci. Biotechnol. Biochem. 61 (8): 1233–9. doi:10.1271/bbb.61.1233. PMID 9301101.
- ^ Mury FB, da Silva JR, Ferreira LS, et al. (2009). "α-Glucosidase promueve la formación de hemozoina en un error de chupa sangre: una historia evolutiva". PLOS ONE. 4 (9): e6966. Bibcode:2009PLoSO...4.6966M. doi:10.1371/journal.pone.0006966. PMC 2734994. PMID 19742319.
- ^ Mehrani H, Storey KB (octubre de 1993). "Caracterización de α-glucosidases del hígado de trucha arco iris". Arch. Biochem. Biophys. 306 (1): 188–94. doi:10.1006/abbi.1993.1499. PMID 8215402.
- ^ Tadera K, Minami Y, Takamatsu K, Matsuoka T (abril de 2006). "Inhibición de α-glucosidase y α-amilase por flavonoides". J. Nutr. Sci. Vitaminol. 52 (2): 149–53. doi:10.3177/jnsv.52.149. PMID 16802696.
- ^ Hoefsloot L; M Hoogeveen-Westerveld; A J Reuser; B A Oostra (1 de diciembre de 1990). "Caracterización del gen lisosomal humano α-glucosidase". Biochem. J. 272 (2): 493-497. doi:10.1042/bj2720493. PMC 1149727. PMID 2268276.
- ^ Hermans, Monique; Marian Kroos; Jos Van Beeumen; Ben Oostra; Arnold Reuser (25 de julio de 1991). "Human Lysosomal a-Glucosidase Characterization of The Catalytic Site". El Diario de Química Biológica21. 266 (21): 13507–13512. doi:10.1016/S0021-9258(18)927-4. Retrieved 1 de marzo 2012.
- ^ Wu XQ, Xu H, Yue H, Liu KQ, Wang XY (diciembre de 2009). "Cinetica de inhibición y la agregación de α-glucosidase por diferentes denaturantes". Protein J. 28 (9–10): 448–56. doi:10.1007/s10930-009-9213-0. PMID 19921411. S2CID 36546023.
- ^ "FDA aprueba el primer tratamiento para la enfermedad de Pompe". FDA Comunicado de prensa. FDA. Retrieved 1 de marzo 2012.
- ^ Yoshimizu, M.; Tajima, Y; Matsuzawa, F; Aikawa, S; Iwamoto, K; Kobayashi, T; Edmunds, T; Fujishima, K; Tsuji, D; Itoh, K; Ikekita, M; Kawashima, I; Sugawara, K; Ohyanagi, N; Suzuki, T; Togawa, Ohno, K; Sakuraba, H (mayo de 2008). "Parámetros finales y termodinámica de la interacción de azúcares imino con un ácido humano recombinante α-glucosidase (alglucosidase alfa): visión del complejo mecanismo de formación". Clin Chim Acta. 391 (1–2): 68–73. doi:10.1016/j.cca.2008.02.014. PMID 18328816.
- ^ Bischoff H (agosto de 1995). "El mecanismo de inhibición α-glucosidasa en la gestión de la diabetes". Clin Invest Med. 18 (4): 303–11. PMID 8549017.
- ^ Kim JS, Kwon CS, Son KH (noviembre de 2000). "Inhibición de α-glucosidase y amilasa por luteolina, un flavonoide". Biosci. Biotechnol. Biochem. 64 11): 2458-61. doi:10.1271/bbb.64.2458. PMID 11193416. S2CID 5757649.
- ^ Zhen, et al. (noviembre de 2017). "Synthesis of novel flavonoid alkaloids as α-glucosidasehibiors". Bioorgánico & Medicinal Química. 25 (20): 5355–64. doi:10.1016/j.bmc.2017.07.055. PMID 28797772.
- ^ Mahmoud AM, Geslevich J, Kint J, et al. (marzo de 1998). "Actividad de plasma seminal α-glucosidase e infertilidad masculina". Hum. Reprod. 13 (3): 591-5. doi:10.1093/humrep/13.3.591. PMID 9572418.
- ^ Mehta, Anand; Zitzmann, Nicole; Rudd, Pauline M; Block, Timothy M; Dwek, Raymond A (23 de junio de 1998). "α-Glucosidase inhibidores como potenciales agentes antivirales de base amplia". Cartas FEBS. 430 (1–2): 17–22. doi:10.1016/S0014-5793(98)00525-0. PMID 9678587. S2CID 25156942.