Titulação

Titulação (também conhecida como titrimetria e análise volumétrica) é um método laboratorial comum de análise química quantitativa para determinar a concentração de um produto identificado. analito (uma substância a ser analisada). Um reagente, denominado titulante ou titulador, é preparado como uma solução padrão de concentração e volume conhecidos. O titulante reage com uma solução de analito (que também pode ser denominado titrante) para determinar a concentração do analito. O volume de titulante que reagiu com o analito é denominado volume de titulação.
História e etimologia
A palavra "titulação" descende da palavra francesa titrer (1543), significando a proporção de ouro ou prata em moedas ou em obras de ouro ou prata; isto é, uma medida de finura ou pureza. Tiltre tornou-se título, que passou a significar a 'finura da liga de ouro' e, em seguida, a 'concentração de uma substância em um determinado amostra". Em 1828, o químico francês Joseph Louis Gay-Lussac usou pela primeira vez titre como verbo (titrer), que significa “determinar a concentração de uma substância em um determinado amostra".
A análise volumétrica teve origem na França do final do século XVIII. François-Antoine-Henri Descroizilles (fr) desenvolveu a primeira bureta (que era semelhante a um cilindro graduado) em 1791. Gay-Lussac desenvolveu uma versão melhorada da bureta que incluía um braço lateral e inventou os termos "pipeta& #34; e "bureta" em um artigo de 1824 sobre a padronização de soluções índigo. A primeira bureta verdadeira foi inventada em 1845 pelo químico francês Étienne Ossian Henry (1798-1873). Uma grande melhoria no método e popularização da análise volumétrica deveu-se a Karl Friedrich Mohr, que redesenhou a bureta em um formato simples e conveniente, e que escreveu o primeiro livro sobre o tema, Lehrbuch der chemisch-analytischen Titrirmethode (Livro didático de métodos de titulação de química analítica), publicado em 1855.
Procedimento

Uma titulação típica começa com um béquer ou frasco Erlenmeyer contendo uma quantidade muito precisa do analito e uma pequena quantidade de indicador (como fenolftaleína) colocado sob uma bureta calibrada ou seringa de pipetagem química contendo o titulante. Pequenos volumes do titulante são então adicionados ao analito e ao indicador até que o indicador mude de cor em reação ao limite de saturação do titulante, representando a chegada ao ponto final da titulação, o que significa que a quantidade de titulante equilibra a quantidade de analito presente, de acordo com o reação entre os dois. Dependendo do ponto final desejado, gotas únicas ou menos de uma gota do titulante podem fazer a diferença entre uma mudança permanente e temporária no indicador.
Técnicas de preparação
Titulações típicas exigem que o titulante e o analito estejam na forma líquida (solução). Embora os sólidos sejam geralmente dissolvidos em uma solução aquosa, outros solventes, como ácido acético glacial ou etanol, são usados para fins especiais (como na petroquímica, especializada em petróleo). Analitos concentrados são frequentemente diluídos para melhorar a precisão.
Muitas titulações não ácido-base requerem um pH constante durante a reação. Portanto, uma solução tampão pode ser adicionada à câmara de titulação para manter o pH.
Nos casos em que dois reagentes em uma amostra podem reagir com o titulante e apenas um é o analito desejado, uma solução de mascaramento separada pode ser adicionada à câmara de reação, o que elimina o efeito do íon indesejado.
Algumas reações de redução-oxidação (redox) podem exigir o aquecimento da solução da amostra e a titulação enquanto a solução ainda está quente para aumentar a taxa de reação. Por exemplo, a oxidação de algumas soluções de oxalato requer aquecimento a 60 °C (140 °F) para manter uma taxa razoável de reação.
Curvas de titulação
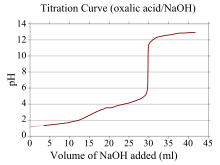
Uma curva de titulação é uma curva no gráfico cuja coordenada x representa o volume de titulante adicionado desde o início da titulação, e a coordenada y de que representa a concentração do analito no estágio correspondente da titulação (em uma titulação ácido-base, a coordenada y geralmente representa o pH da solução).
Em uma titulação ácido-base, a curva de titulação representa a força do ácido e da base correspondentes. Para um ácido forte e uma base forte, a curva será relativamente suave e muito íngreme perto do ponto de equivalência. Por causa disso, uma pequena alteração no volume do titulante perto do ponto de equivalência resulta em uma grande alteração no pH e muitos indicadores seriam apropriados (por exemplo, tornassol, fenolftaleína ou azul de bromotimol).
Se um reagente for um ácido ou base fraco e o outro for um ácido ou base forte, a curva de titulação é irregular e o pH muda menos com pequenas adições de titulante perto do ponto de equivalência. Por exemplo, é mostrada a curva de titulação para a titulação entre ácido oxálico (um ácido fraco) e hidróxido de sódio (uma base forte). O ponto de equivalência ocorre entre pH 8-10, indicando que a solução é básica no ponto de equivalência e um indicador como a fenolftaleína seria apropriado. As curvas de titulação correspondentes a bases fracas e ácidos fortes apresentam comportamento semelhante, sendo a solução ácida no ponto de equivalência e indicadores como laranja de metila e azul de bromotimol sendo os mais apropriados.
Titulações entre um ácido fraco e uma base fraca têm curvas de titulação muito irregulares. Por causa disso, nenhum indicador definido pode ser apropriado e um medidor de pH é frequentemente usado para monitorar a reação.
O tipo de função que pode ser usada para descrever a curva é chamada de função sigmóide.
Tipos de titulações
Existem muitos tipos de titulações com diferentes procedimentos e objetivos. Os tipos mais comuns de titulação qualitativa são titulações ácido-base e titulações redox.
Titulação ácido-base

| Indicador | Cor no lado ácido | Gama de mudança de cor (pH) | Cor no lado básico |
|---|---|---|---|
| Violeta de Methyl | Amarelo | 0.0—1.6 | Violeta |
| Bromophenol azul | Amarelo | 3,0 - 4,6 | Azul |
| laranja metil | Vermelho | 3.1 — 4 | Amarelo |
| Methyl vermelho | Vermelho | 4.4 — 6.3 | Amarelo |
| Litmus. | Vermelho | 5.0—8.0 | Azul |
| Bromothymol azul | Amarelo | 6.0-7.6 | Azul |
| Phenolphthalein | Sem cor | 8.3—10.0 | Rosa |
| Alizarina amarela | Amarelo | 10.1—12.0 | Vermelho |
As titulações ácido-base dependem da neutralização entre um ácido e uma base quando misturados em solução. Além da amostra, um indicador de pH apropriado é adicionado à câmara de titulação, representando a faixa de pH do ponto de equivalência. O indicador ácido-base indica o ponto final da titulação mudando de cor. O ponto final e o ponto de equivalência não são exatamente iguais porque o ponto de equivalência é determinado pela estequiometria da reação, enquanto o ponto final é apenas a mudança de cor do indicador. Assim, uma seleção cuidadosa do indicador reduzirá o erro do indicador. Por exemplo, se o ponto de equivalência estiver em um pH de 8,4, então o indicador fenolftaleína seria usado em vez do Amarelo Alizarina porque a fenolftaleína reduziria o erro do indicador. Indicadores comuns, suas cores e a faixa de pH em que mudam de cor são fornecidos na tabela acima. Quando são necessários resultados mais precisos, ou quando os reagentes são um ácido fraco e uma base fraca, utiliza-se um medidor de pH ou um medidor de condutância.
Para bases muito fortes, como reagente organolítio, amidas metálicas e hidretos, a água geralmente não é um solvente adequado e os indicadores cujo pKa está na faixa de alterações de pH aquoso são de pouca utilidade. Em vez disso, o titulante e o indicador utilizados são ácidos muito mais fracos e são utilizados solventes anidros como o THF.

O pH aproximado durante a titulação pode ser aproximado por três tipos de cálculos. Antes do início da titulação, a concentração de Não.H. H. H.+][H+]}}} é calculado em uma solução aquosa de ácido fraco antes de adicionar qualquer base. Quando o número de toupeiras de bases adicionadas equivale ao número de toupeiras de ácido inicial ou assim chamado ponto de equivalência, uma de hidrólise e o pH é calculado da mesma forma que as bases conjugadas do ácido titrated foi calculado. Entre os pontos iniciais e finais, Não.H. H. H.+][H+]}}} é obtido a partir da equação Henderson-Hasselbalch e mistura de titulação é considerado como buffer. Na equação Henderson-Hasselbalch [acid] e [base] dizem ser as molares que teriam estado presentes mesmo com dissociação ou hidrólise. Num cofre, Não.H. H. H.+][H+]}}} pode ser calculado exatamente mas a dissociação de HAIA, a hidrólise de A- Sim. - Sim. (A-}}} e a auto-ionização da água deve ser levada em conta. Quatro equações independentes devem ser utilizadas:
- Não.H. H. H.+]Não.Oh!- Sim. - Sim. ]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =10.- Sim. - Sim. 14[displaystyle [{ce {H+}}][{ce {OH-}}]=10^{-14}}]
- Não.H. H. H.+]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KKumNão.HAIA]Não.A- Sim. - Sim. ]Não. [[H+}}]K_{a}{ce {{frac {HA}{[HA] A^{-}]}}}
- Não.HAIA]+Não.A- Sim. - Sim. ]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =(nA+nB)VNão. [{ce {HA}}]+[{ce {A-}}]={frac {n_{{ce {A}}}+n_{{ce {B}}}}{V}}}
- Não.H. H. H.+]+nBV= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.A- Sim. - Sim. ]+Não.Oh!- Sim. - Sim. ]Não. (H+)+ - Não. {B}}{V}}=[{ce] {A-}}+[{ce {OH-}}}
Nas equações, nANão. N_{{ce {A}} e nBNão. n_{{ce {B}} são as toupeiras de ácido (HAIA) e sal (XA onde X é o cation), respectivamente, usado no buffer, e o volume da solução é V. A lei da ação em massa é aplicada à ionização da água e à dissociação do ácido para derivar as primeiras e segunda equações. O equilíbrio de massa é usado na terceira equação, onde a soma de VNão.HAIA]Não. V[{ce {HA}] e VNão.A- Sim. - Sim. ](A-}}) deve ser igual ao número de toupeiras de ácido dissolvido e base, respectivamente. O equilíbrio de carga é usado na quarta equação, onde o lado esquerdo representa a carga total das cações e o lado direito representa a carga total das ânions: nBV(em inglês) {B}}{V}}} é a molaridade da cação (por exemplo, sódio, se o sal de sódio do ácido ou hidróxido de sódio é usado na fabricação do tampão).
Titulação redox
As titulações redox são baseadas em uma reação de redução-oxidação entre um agente oxidante e um agente redutor. Um potenciômetro ou indicador redox é geralmente usado para determinar o ponto final da titulação, como quando um dos constituintes é o agente oxidante dicromato de potássio. A mudança de cor da solução de laranja para verde não é definitiva, portanto é utilizado um indicador como a difenilamina sódica. A análise de vinhos em busca de dióxido de enxofre requer iodo como agente oxidante. Neste caso, o amido é utilizado como indicador; um complexo amido-iodo azul é formado na presença de excesso de iodo, sinalizando o ponto final.
Algumas titulações redox não necessitam de indicador, devido à cor intensa dos constituintes. Por exemplo, na permanganometria, uma leve cor rosa persistente sinaliza o ponto final da titulação devido à cor do excesso do agente oxidante permanganato de potássio. Na iodometria, em concentrações suficientemente grandes, o desaparecimento do íon triiodeto vermelho-marrom profundo pode ser usado como ponto final, embora em concentrações mais baixas a sensibilidade seja melhorada pela adição do indicador de amido, que forma um complexo intensamente azul com o triiodeto.

Titulação da fase gasosa
Titulações em fase gasosa são titulações feitas na fase gasosa, especificamente como métodos para determinar espécies reativas por reação com um excesso de algum outro gás, atuando como titulante. Em uma titulação comum em fase gasosa, o ozônio gasoso é titulado com óxido de nitrogênio de acordo com a reação
- O3 + NÃO → O2 + NÃO2.
A titulação em fase gasosa tem diversas vantagens sobre a espectrofotometria simples. Primeiro, a medição não depende do comprimento do caminho, porque o mesmo comprimento do caminho é usado para a medição do excesso de titulante e do produto. Em segundo lugar, a medição não depende de uma mudança linear na absorvância em função da concentração do analito, conforme definido pela lei de Beer-Lambert. Terceiro, é útil para amostras contendo espécies que interferem em comprimentos de onda normalmente utilizados para o analito.
Titulação complexométrica
As titulações complexométricas baseiam-se na formação de um complexo entre o analito e o titulante. Em geral, requerem indicadores complexométricos especializados que formam complexos fracos com o analito. O exemplo mais comum é o uso do indicador de amido para aumentar a sensibilidade da titulação iodométrica, sendo o complexo azul escuro do amido com iodo e iodeto mais visível do que o iodo sozinho. Outros indicadores complexométricos são o Eriocromo Black T para a titulação de íons de cálcio e magnésio, e o agente quelante EDTA usado para titular os íons metálicos em solução.
Titulação do potencial Zeta
Titulações de potencial Zeta são titulações em que a conclusão é monitorada pelo potencial zeta, e não por um indicador, a fim de caracterizar sistemas heterogêneos, como colóides. Uma das utilizações é determinar o ponto isoelétrico quando a carga superficial se torna zero, conseguida alterando o pH ou adicionando surfactante. Outro uso é determinar a dose ideal para floculação ou estabilização.
Ensaio
Um ensaio é um tipo de titulação biológica usada para determinar a concentração de um vírus ou bactéria. As diluições em série são realizadas numa amostra numa proporção fixa (tal como 1:1, 1:2, 1:4, 1:8, etc.) até que a última diluição não dê um teste positivo para a presença do vírus. O valor positivo ou negativo pode ser determinado inspecionando visualmente as células infectadas ao microscópio ou por um método imunoenzimático, tal como ensaio imunoenzimático (ELISA). Este valor é conhecido como título.
Medindo o ponto final de uma titulação
Diferentes métodos para determinar o endpoint incluem:
- Indicador: Uma substância que muda a cor em resposta a uma mudança química. Um indicador ácido-base (por exemplo, fenolphthalein) muda a cor dependendo do pH. Uma gota de solução indicadora é adicionada à titulação no início; o ponto final foi alcançado quando a cor muda.
- Potenciômetro: Um instrumento que mede o potencial do eletrodo da solução. Estes são usados para titulações redox; o potencial do eletrodo de trabalho irá repentinamente mudar à medida que o ponto final é alcançado.

- p H medidor: Um potenciômetro com um eletrodo cujo potencial depende da quantidade de H+ íon presente na solução. (Este é um exemplo de um eletrodo ion-seletivo.) O pH da solução é medido ao longo da titulação, mais precisamente do que com um indicador; no ponto final haverá uma mudança súbita no pH medido.
- Condutividade: Uma medição de íons em uma solução. A concentração de íons pode mudar significativamente em uma titulação, o que muda a condutividade. (Por exemplo, durante uma titulação ácido-base, o H+ e OH- Sim. íons reagem à forma neutra H. H. H.2O. Como a condução total depende de todos os íons presentes na solução e nem todos os íons contribuem igualmente (devido à mobilidade e à força iônica), prever a mudança na condutividade é mais difícil do que medi-la.
- Mudança de cor: Em algumas reações, a solução muda de cor sem qualquer indicador adicionado. Isso é frequentemente visto em titrações redox quando os diferentes estados de oxidação do produto e reagente produzem cores diferentes.
- Precipitação: Se uma reação produz um sólido, um precipitado se formará durante a titulação. Um exemplo clássico é a reação entre Ag+ e Cl- Sim. para formar o sal insolúvel AgCl. Os precipitados nublados geralmente tornam difícil determinar o ponto final precisamente. Para compensar, as titulações de precipitação muitas vezes têm de ser feitas como titulações "de volta" (veja abaixo).
- Calômetro de titulação isotérmica: Um instrumento que mede o calor produzido ou consumido pela reação para determinar o ponto final. Usado em titulações bioquímicas, como a determinação de como os substratos se ligam às enzimas.
- titulação termométrica: Diferenciada da titulação calorimétrica porque o calor da reação (como indicado pelo aumento da temperatura ou queda) não é usado para determinar a quantidade de analito na solução amostral. Em vez disso, o ponto final é determinado por a taxa de mudança de temperatura.
- Espectroscopia: Usado para medir a absorção da luz pela solução durante a titulação se o espectro do reagente, titulante ou produto é conhecido. A concentração do material pode ser determinada pela Lei de Cerveja.
- Amperometria: Mede a corrente produzida pela reação de titulação como resultado da oxidação ou redução do analito. O ponto final é detectado como uma mudança na corrente. Este método é mais útil quando o excesso de titulante pode ser reduzido, como na titulação de halides com Ag+.
Ponto final e ponto de equivalência
Embora os termos ponto de equivalência e ponto final sejam frequentemente usados de forma intercambiável, eles são termos diferentes. Ponto de equivalência é a conclusão teórica da reação: o volume de titulante adicionado no qual o número de moles de titulante é igual ao número de moles de analito, ou algum múltiplo dele (como em ácidos polipróticos). Endpoint é o que é realmente medido, uma mudança física na solução determinada por um indicador ou instrumento mencionado acima.
Há uma pequena diferença entre o ponto final e o ponto de equivalência da titulação. Este erro é conhecido como erro de indicador e é indeterminado.
Titulação reversa
A retrotitulação é uma titulação feita ao contrário; em vez de titular a amostra original, um excesso conhecido de reagente padrão é adicionado à solução e o excesso é titulado. Uma retrotitulação é útil se o ponto final da titulação reversa for mais fácil de identificar do que o ponto final da titulação normal, como acontece com as reações de precipitação. As retrotitulações também são úteis se a reação entre o analito e o titulante for muito lenta ou quando o analito estiver em um sólido insolúvel.
Métodos gráficos
O processo de titulação cria soluções com composições que variam de ácido puro a base pura. Identificar o pH associado a qualquer etapa do processo de titulação é relativamente simples para ácidos e bases monopróticos. A presença de mais de um grupo ácido ou base complica esses cálculos. Métodos gráficos, como o equilígrafo, têm sido usados há muito tempo para explicar a interação de equilíbrios acoplados.
Usos específicos

Titulações ácido-base
- Para o combustível biodiesel: o óleo vegetal residual (WVO) deve ser neutralizado antes que um lote possa ser processado. Uma porção de WVO é titulada com uma base para determinar a acidez, de modo que o resto do lote pode ser neutralizado corretamente. Isso remove ácidos graxos livres do WVO que normalmente reagiriam para fazer sabão em vez de combustível biodiesel.
- Método Kjeldahl: uma medida de conteúdo de nitrogênio em uma amostra. O nitrogênio orgânico é digerido em amônia com ácido sulfúrico e sulfato de potássio. Finalmente, a amônia é torcida de volta com ácido bórico e depois carbonato de sódio.
- Valor ácido: a massa em miligramas de hidróxido de potássio (KOH) necessário para titular totalmente um ácido em um grama de amostra. Um exemplo é a determinação do conteúdo de ácido graxo livre.
- Valor de Saponificação: a massa em miligramas de KOH necessário para saponificar um ácido gordo em um grama de amostra. A Saponificação é usada para determinar o comprimento médio da cadeia de ácidos graxos na gordura.
- Valor Ester (ou índice de éster): um índice calculado. Valor Ester = Valor de Saponificação – Valor ácido.
- Valor de amina: a massa em miligramas de KOH igual ao teor de amina em um grama de amostra.
- Valor hidroxil: a massa em miligramas de KOH correspondente a grupos hidroxiais em um grama de amostra. O analyte é acetilado usando anidrido acético, em seguida, titrated com KOH.
Titulações redox
- Teste de Winkler para oxigênio dissolvido: Usado para determinar a concentração de oxigênio na água. O oxigênio em amostras de água é reduzido usando sulfato de manganês (II), que reage com iodeto de potássio para produzir iodo. O iodo é liberado em proporção ao oxigênio na amostra, assim, a concentração de oxigênio é determinada com uma titulação redox de iodo com tiossulfato usando um indicador de amido.
- Vitamina C: Também conhecido como ácido ascórbico, a vitamina C é um poderoso agente de redução. Sua concentração pode ser facilmente identificada quando titrated com o corante azul Dichlorophenolindophenol (DCPIP) que se torna incolor quando reduzido pela vitamina.
- Reagente de Benedict: A glicose excessiva na urina pode indicar diabetes em um paciente. O método de Benedict é o método convencional para quantificar a glicose na urina usando um reagente preparado. Durante este tipo de titulação, a glicose reduz íons cupricos a íons cuprosos que reagem com tiocianato de potássio para produzir um precipitado branco, indicando o ponto final.
- Número de Bromine: Uma medida de insaturação em um analito, expressa em miligramas de bromo absorvido por 100 gramas de amostra.
- Número de iodo: Uma medida de insaturação em um analito, expressa em gramas de iodo absorvidos por 100 gramas de amostra.
Diversos
- titulação Karl Fischer: Um método potenciométrico para analisar vestígios de água em uma substância. Uma amostra é dissolvida em metanol e titulada com o reagente Karl Fischer (consiste em iodo, dióxido de enxofre, base e solvente, como álcool, talvez EtOH). O reagente contém iodo, que reage proporcionalmente com água. Assim, o conteúdo da água pode ser determinado monitorando o potencial elétrico do excesso de iodo.
![{displaystyle {ce {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{displaystyle [{ce {H+}}][{ce {OH-}}]=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{displaystyle [{ce {H+}}]=K_{a}{ce {{frac {[HA]}{[A^{-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{displaystyle [{ce {HA}}]+[{ce {A-}}]={frac {(n_{{ce {A}}}+n_{{ce {B}}})}{V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{displaystyle [{ce {H+}}]+{frac {n_{{ce {B}}}}{V}}=[{ce {A-}}]+[{ce {OH-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{displaystyle V[{ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{displaystyle V[{ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)
