Selênio
Selênio é um elemento químico com o símbolo Se e número atômico 34. É um metalóide (mais raramente considerado um não metal) com propriedades intermediárias entre os elementos acima e abaixo na tabela periódica, enxofre e telúrio, e também tem semelhanças com o arsênico. Raramente ocorre em seu estado elementar ou como compostos de minério puro na crosta terrestre. Selênio (do grego antigo σελήνη (selḗnē) 'moon') foi descoberta em 1817 por Jöns Jacob Berzelius, que notou a semelhança do novo elemento com o telúrio previamente descoberto (nomeado em homenagem à Terra).
O selênio é encontrado em minérios de sulfeto metálico, onde substitui parcialmente o enxofre. Comercialmente, o selênio é produzido como subproduto do refino desses minérios, na maioria das vezes durante a produção. Minerais que são compostos puros de seleneto ou selenato são conhecidos, mas raros. Os principais usos comerciais do selênio hoje são a fabricação de vidro e pigmentos. O selênio é um semicondutor e é usado em fotocélulas. As aplicações em eletrônica, antes importantes, foram substituídas principalmente por dispositivos semicondutores de silício. O selênio ainda é usado em alguns tipos de protetores contra surtos de energia DC e em um tipo de ponto quântico fluorescente.
Embora vestígios de selênio sejam necessários para a função celular em muitos animais, incluindo humanos, tanto o selênio elementar quanto (especialmente) os sais de selênio são tóxicos mesmo em pequenas doses, causando selenose. O selênio é listado como ingrediente em muitos multivitamínicos e outros suplementos dietéticos, bem como em fórmulas infantis, e é um componente das enzimas antioxidantes glutationa peroxidase e tiorredoxina redutase (que reduzem indiretamente certas moléculas oxidadas em animais e algumas plantas), bem como em 3 enzimas deiodinase. As necessidades de selênio nas plantas variam de acordo com a espécie, com algumas plantas necessitando de quantidades relativamente grandes e outras aparentemente não.
Características
Propriedades físicas

O selênio forma vários alótropos que se interconvertem com as mudanças de temperatura, dependendo um pouco da taxa de mudança de temperatura. Quando preparado em reações químicas, o selênio é geralmente um pó vermelho-tijolo amorfo. Quando derretido rapidamente, forma a forma vítrea preta, geralmente vendida comercialmente como contas. A estrutura do selênio preto é irregular e complexa e consiste em anéis poliméricos com até 1.000 átomos por anel. Black Se é um sólido quebradiço e brilhante que é ligeiramente solúvel em CS2. Após aquecimento, ele amolece a 50°C e se converte em selênio cinza a 180°C; a temperatura de transformação é reduzida pela presença de halogênios e aminas.
As formas vermelhas α, β e γ são produzidas a partir de soluções de selênio preto variando a taxa de evaporação do solvente (geralmente CS2). Todos eles têm uma simetria cristalina monoclínica relativamente baixa (grupo espacial 14) e contêm anéis de ciclooctaselênio (Se8) enrugados quase idênticos com diferentes arranjos geométricos, como no enxofre. Os oito átomos de um anel não são equivalentes (ou seja, eles não são mapeados uns sobre os outros por nenhuma operação de simetria) e, de fato, na forma γ-monoclínica, metade dos anéis estão em uma configuração (e sua imagem espelhada) e a outra metade em outro. O empacotamento é mais denso na forma α. Nos anéis Se8, a distância Se-Se varia dependendo de onde o par de átomos está no anel, mas a média é 233,5 pm, e o ângulo Se-Se-Se é em média 105,7 °. Outros alótropos de selênio podem conter anéis Se6 ou Se7.
A forma mais estável e densa de selênio é cinza e possui uma rede cristalina hexagonal quiral (grupo espacial 152 ou 154 dependendo da quiralidade) consistindo de cadeias poliméricas helicoidais, onde a distância Se-Se é 237,3 pm e Se-Se -Se o ângulo é 103,1°. A distância mínima entre cadeias é 343,6 pm. O Se cinza é formado pelo aquecimento moderado de outros alótropos, pelo resfriamento lento do Se fundido ou pela condensação do vapor de Se logo abaixo do ponto de fusão. Enquanto outras formas de Se são isolantes, o Se cinza é um semicondutor que apresenta fotocondutividade apreciável. Ao contrário dos outros alótropos, é insolúvel em CS2. Resiste à oxidação pelo ar e não é atacado por ácidos não oxidantes. Com fortes agentes redutores, forma poliselenetos. O selênio não apresenta as mudanças na viscosidade que o enxofre sofre quando aquecido gradualmente.
Isótopos
O selênio possui sete isótopos naturais. Cinco destes, 74Se, 76Se, 77Se, 78Se, 80Se, são estáveis, sendo 80Se o mais abundante (49,6% de abundância natural). Também ocorre naturalmente o radionuclídeo primordial de longa vida 82Se, com meia-vida de 9,2×1019 anos. O radioisótopo não primordial 79Se também ocorre em quantidades mínimas em minérios de urânio como produto da fissão nuclear. O selênio também possui numerosos isótopos sintéticos instáveis, variando de 64Se a 95Se; os mais estáveis são 75Se com meia-vida de 119,78 dias e 72Se com meia-vida de 8,4 dias. Os isótopos mais leves que os isótopos estáveis sofrem principalmente decaimento beta mais em isótopos de arsênico, e os isótopos mais pesados que os isótopos estáveis sofrem decaimento beta menos em isótopos de bromo, com alguns ramos menores de emissão de nêutrons nos isótopos mais pesados conhecidos.
| Isotope | Natureza | Origem | Meio-vida |
|---|---|---|---|
| 74Se | Primordial | Estável | |
| 76Se | Primordial | Estável | |
| 77Se | Primordial | Produto de Fissão | Estável |
| 78Se | Primordial | Produto de Fissão | Estável |
| 79Se | Trace | Produto de Fissão | 327) Sim. |
| 80Se | Primordial | Produto de Fissão | Estável |
| 82Se | Primordial | Produto de fissão* | ~1020. Sim. |
Compostos químicos
Compostos de selênio comumente existem nos estados de oxidação −2, +2, +4 e +6.
Compostos de calcogênio

O selênio forma dois óxidos: dióxido de selênio (SeO2) e trióxido de selênio (SeO3). O dióxido de selênio é formado pela combustão do selênio elementar:
- Se +2 → SeO2
É um sólido polimérico que forma moléculas monoméricas de SeO2 na fase gasosa. Dissolve-se em água para formar ácido selenoso, H2SeO3. O ácido selenoso também pode ser produzido diretamente pela oxidação do selênio elementar com ácido nítrico:
- 3 Se + 4 HNO3 + H2O → 3 H2Seo3 + 4 NO
Ao contrário do enxofre, que forma um trióxido estável, o trióxido de selênio é termodinamicamente instável e se decompõe em dióxido acima de 185 °C:
- 23 → 2 SeO2 + O2 (ΔH = −54 kJ/mol)
O trióxido de selênio é produzido em laboratório pela reação do selenato de potássio anidro (K2SeO4) e trióxido de enxofre (SO3).
Os sais do ácido selenoso são chamados de selenitos. Estes incluem selenito de prata (Ag2SeO3) e selenito de sódio (Na2SeO3).
O sulfeto de hidrogênio reage com o ácido selenoso aquoso para produzir dissulfeto de selênio:
- H. H. H.2Seo3 + 2 H2S → SeS2 + 3 H2O
O dissulfeto de selênio consiste em anéis de 8 membros. Possui uma composição aproximada de SeS2, com anéis individuais variando em composição, como Se4S4 e Se2< /sub>S6. O dissulfeto de selênio tem sido usado em xampus como agente anticaspa, inibidor na química de polímeros, corante de vidro e agente redutor em fogos de artifício.
O trióxido de selênio pode ser sintetizado pela desidratação do ácido selênico, H2SeO4, que é produzido pela oxidação do dióxido de selênio com peróxido de hidrogênio:
- Seo2 + H2O2 → H2Seo4
O ácido selênico quente e concentrado reage com o ouro para formar selenato de ouro (III).
Compostos halogéneos
O selênio reage com o flúor para formar hexafluoreto de selênio:
Os únicos cloretos estáveis são o tetracloreto de selênio (SeCl4) e o monocloreto de selênio (Se2Cl2), que talvez sejam mais conhecidos como cloreto de selênio (I) e é estruturalmente análogo ao dicloreto de dissulfureto. Soluções metaestáveis de dicloreto de selênio podem ser preparadas a partir de cloreto de sulfurila e selênio (a reação dos elementos gera o tetracloreto) e constituem um reagente importante na preparação de compostos de selênio (por exemplo, Se7). Os brometos correspondentes são todos conhecidos e recapitulam a mesma estabilidade e estrutura dos cloretos.
Os iodetos de selênio não são bem conhecidos e por muito tempo acreditou-se que não existiam. Há evidências espectroscópicas limitadas de que os iodetos inferiores podem se formar em soluções bielementares com solventes apolares, como dissulfeto de carbono e tetracloreto de carbono; mas mesmo estes parecem decompor-se sob iluminação.
Alguns oxihaletos de selênio — fluoreto de seleninil (SeOF2) e oxicloreto de selênio (SeOCl2) — têm sido usados como solventes especiais.
Selenetos metálicos
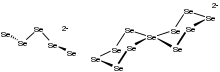
Análogo ao comportamento de outros calcogênios, o selênio forma seleneto de hidrogênio, H2Se. É um gás fortemente odorífero, tóxico e incolor. É mais ácido que H2S. Em solução, ele ioniza em HSe−. O seleneto dianion Se2− forma uma variedade de compostos, incluindo os minerais dos quais o selênio é obtido comercialmente. Selenetos ilustrativos incluem seleneto de mercúrio (HgSe), seleneto de chumbo (PbSe), seleneto de zinco (ZnSe) e disseleneto de cobre, índio e gálio (Cu(Ga,In)Se2). Esses materiais são semicondutores. Com metais altamente eletropositivos, como o alumínio, esses selenetos são propensos à hidrólise, que pode ser descrita por esta equação idealizada:
- Al.2Se3 + 6 H2O → 2 Al(OH)3 + 3 H2Se
Os selenetos de metais alcalinos reagem com o selênio para formar poliselenetos, Se2−
n, que existem como correntes e anéis.
Outros compostos
Tetranitreto de tetraselênio, Se4N4, é um composto explosivo laranja análogo ao tetranitreto de tetraenxofre (S4N4< /sub>). Pode ser sintetizado pela reação do tetracloreto de selênio (SeCl4) com [((CH3)3Si)2N]2Se.
O selênio reage com cianetos para produzir selenocianatos:
- 8 KCN + Se8 → 8 KSeCN
Compostos de organoselênio
O selênio, especialmente no estado de oxidação II, forma uma variedade de derivados orgânicos. Eles são estruturalmente análogos aos compostos organossulfurados correspondentes. Especialmente comuns são os selenetos (R2Se, análogos de tioéteres), disselenetos (R2Se2, análogos de dissulfetos) e selenóis (RSeH, análogos de tióis). Representantes de selenetos, disselenetos e selenóis incluem, respectivamente, selenometionina, difenildiseleneto e benzenoselenol. O sulfóxido na química do enxofre é representado na química do selênio pelos selenóxidos (fórmula RSe(O)R), que são intermediários na síntese orgânica, conforme ilustrado pela reação de eliminação do selenóxido. Consistente com as tendências indicadas pela regra da ligação dupla, as selencetonas, R(C=Se)R, e os selenaldeídos, R(C=Se)H, são raramente observados.
Histórico
O selênio (grego σελήνη selene que significa “Lua”) foi descoberto em 1817 por Jöns Jacob Berzelius e Johan Gottlieb Gahn. Ambos os químicos possuíam uma fábrica de produtos químicos perto de Gripsholm, na Suécia, que produzia ácido sulfúrico pelo processo de câmara de chumbo. Amostras de pirita da Mina Falun produziram um precipitado sólido vermelho nas câmaras de chumbo, que se presumia ser um composto de arsênico, de modo que o uso de pirita para produzir ácido foi interrompido. Berzelius e Gahn, que queriam usar a pirita, observaram que o precipitado vermelho exalava um odor semelhante ao de raiz-forte quando queimado. Esse cheiro não era típico de arsênico, mas um odor semelhante era conhecido em compostos de telúrio. Conseqüentemente, a primeira carta de Berzelius a Alexander Marcet afirmava que se tratava de um composto de telúrio. No entanto, a falta de compostos de telúrio nos minerais da Mina Falun levou Berzelius a reanalisar o precipitado vermelho e, em 1818, escreveu uma segunda carta a Marcet descrevendo um elemento recém-descoberto semelhante ao enxofre e ao telúrio. Devido à sua semelhança com o telúrio, batizado em homenagem à Terra, Berzelius deu ao novo elemento o nome da Lua.
Em 1873, Willoughby Smith descobriu que a condutividade elétrica do selênio cinza era afetada pela luz. Isso levou ao seu uso como célula para detecção de luz. Os primeiros produtos comerciais utilizando selênio foram desenvolvidos por Werner Siemens em meados da década de 1870. A célula de selênio foi utilizada no fotofone desenvolvido por Alexander Graham Bell em 1879. O selênio transmite uma corrente elétrica proporcional à quantidade de luz que incide em sua superfície. Este fenômeno foi utilizado no projeto de medidores de luz e dispositivos similares. As propriedades semicondutoras do selênio encontraram inúmeras outras aplicações na eletrônica. O desenvolvimento de retificadores de selênio começou no início da década de 1930, e estes substituíram os retificadores de óxido de cobre porque eram mais eficientes. Eles perduraram em aplicações comerciais até a década de 1970, quando foram substituídos por retificadores de silício mais baratos e ainda mais eficientes.
O selênio chegou ao conhecimento médico mais tarde devido à sua toxicidade para os trabalhadores industriais. O selênio também foi reconhecido como uma importante toxina veterinária, observada em animais que comeram plantas com alto teor de selênio. Em 1954, os primeiros indícios de funções biológicas específicas do selênio foram descobertos em microrganismos pela bioquímica Jane Pinsent. Foi descoberto que é essencial para a vida dos mamíferos em 1957. Na década de 1970, foi demonstrado que estava presente em dois conjuntos independentes de enzimas. Isto foi seguido pela descoberta da selenocisteína nas proteínas. Durante a década de 1980, foi demonstrado que a selenocisteína era codificada pelo códon UGA. O mecanismo de recodificação foi desenvolvido primeiro em bactérias e depois em mamíferos (ver elemento SECIS).
Ocorrência

O selênio nativo (ou seja, elementar) é um mineral raro, que geralmente não forma bons cristais, mas, quando o faz, são romboedros íngremes ou minúsculos cristais aciculares (semelhantes a cabelos). O isolamento do selênio é frequentemente complicado pela presença de outros compostos e elementos.
O selênio ocorre naturalmente em diversas formas inorgânicas, incluindo seleneto, selenato e selenito, mas esses minerais são raros. O mineral comum selenito não é um mineral de selênio e não contém íon selenito, mas é um tipo de gesso (sulfato de cálcio hidratado) denominado como selênio para a lua, muito antes da descoberta do selênio. O selênio é mais comumente encontrado como impureza, substituindo uma pequena parte do enxofre em minérios de sulfeto de muitos metais.
Nos sistemas vivos, o selênio é encontrado nos aminoácidos selenometionina, selenocisteína e metilselenocisteína. Nestes compostos, o selénio desempenha um papel análogo ao do enxofre. Outro composto organoselênio que ocorre naturalmente é o seleneto de dimetila.
Certos solos são ricos em selênio e o selênio pode ser bioconcentrado por algumas plantas. Nos solos, o selênio ocorre mais frequentemente em formas solúveis, como o selenato (análogo ao sulfato), que é facilmente lixiviado para os rios pelo escoamento. A água do oceano contém quantidades significativas de selênio.
As concentrações normais de selênio não excedem 1 ng/m3 na atmosfera; 1 mg/kg no solo e vegetação e 0,5 μg/L em água doce e água do mar.
As fontes antropogênicas de selênio incluem a queima de carvão e a mineração e fundição de minérios de sulfeto.
Produção
O selênio é mais comumente produzido a partir de seleneto em muitos minérios de sulfeto, como cobre, níquel ou chumbo. O refino eletrolítico de metal é particularmente produtivo com selênio como subproduto, obtido da lama anódica das refinarias de cobre. Outra fonte foi a lama das câmaras de chumbo das fábricas de ácido sulfúrico, processo que não é mais utilizado. O selênio pode ser refinado a partir dessas lamas por vários métodos. No entanto, a maior parte do selênio elementar vem como subproduto do refino do cobre ou da produção de ácido sulfúrico. Desde a sua invenção, a produção de cobre por extração por solvente e extração eletrolítica (SX/EW) produz uma parcela crescente do fornecimento mundial de cobre. Isto altera a disponibilidade de selênio porque apenas uma parte comparativamente pequena do selênio no minério é lixiviada com o cobre.
A produção industrial de selênio geralmente envolve a extração de dióxido de selênio de resíduos obtidos durante a purificação do cobre. A produção comum do resíduo começa então pela oxidação com carbonato de sódio para produzir dióxido de selênio, que é misturado com água e acidificado para formar ácido selenoso (etapa de oxidação). O ácido selenoso é borbulhado com dióxido de enxofre (etapa de redução) para dar selênio elementar.
Cerca de 2.000 toneladas de selênio foram produzidas em 2011 em todo o mundo, principalmente na Alemanha (650 t), Japão (630 t), Bélgica (200 t) e Rússia (140 t), e as reservas totais foram estimadas em 93.000 toneladas. Estes dados excluem dois grandes produtores: os Estados Unidos e a China. Um aumento acentuado anterior foi observado em 2004, de US$ 4–US$ 5 para US$ 27/lb. O preço permaneceu relativamente estável durante 2004-2010 em cerca de US$ 30 por libra (em lotes de 100 libras), mas aumentou para US$ 65/lb em 2011. O consumo em 2010 foi dividido da seguinte forma: metalurgia – 30%, fabricação de vidro – 30%, agricultura – 10%, produtos químicos e pigmentos – 10%, e eletrônicos – 10%. A China é o consumidor dominante de selênio, com 1.500 a 2.000 toneladas/ano.
Aplicativos
Eletrólise de manganês
Durante a eletroextração de manganês, a adição de dióxido de selênio diminui a potência necessária para operar as células de eletrólise. A China é o maior consumidor de dióxido de selênio para essa finalidade. Para cada tonelada de manganês, são utilizados em média 2 kg de óxido de selênio.
Produção de vidro
O maior uso comercial do Se, responsável por cerca de 50% do consumo, é para a produção de vidro. Os compostos de Se conferem uma cor vermelha ao vidro. Esta cor anula os tons verdes ou amarelos que surgem das impurezas de ferro típicas da maioria dos vidros. Para este efeito, são adicionados vários sais de selenito e selenato. Para outras aplicações pode ser desejada uma cor vermelha, produzida por misturas de CdSe e CdS.
Ligas
O selênio é usado com bismuto em latão para substituir o chumbo mais tóxico. A regulamentação do chumbo em aplicações de água potável, como nos EUA com a Lei da Água Potável Segura de 1974, tornou necessária uma redução do chumbo no latão. O novo latão é comercializado sob o nome EnviroBrass. Assim como o chumbo e o enxofre, o selênio melhora a usinabilidade do aço em concentrações em torno de 0,15%. O selênio produz a mesma melhoria de usinabilidade em ligas de cobre.
Baterias de lítio-selênio
A bateria de lítio-selênio (Li-Se) é um dos sistemas mais promissores para armazenamento de energia na família das baterias de lítio. A bateria Li-Se é uma alternativa à bateria lítio-enxofre, com a vantagem da alta condutividade elétrica.
Células solares
O selênio foi usado como camada fotoabsorvente na primeira célula solar de estado sólido, o que foi demonstrado pelo físico inglês William Grylls Adams e seu aluno Richard Evans Day em 1876. Com apenas alguns anos de camada, Charles Fritts fabricou a primeira camada fina. célula solar de filme, também usando selênio como fotoabsorvente. No entanto, com o surgimento das células solares de silício na década de 1950, a pesquisa sobre células solares de película fina de selênio diminuiu. Como resultado, a eficiência recorde de 5,0% demonstrada por Tokio Nakada e Akio Kunioka em 1985 permaneceu inalterada durante mais de 30 anos. Em 2017, pesquisadores da IBM alcançaram um novo recorde de eficiência de 6,5% ao redesenhar a estrutura do dispositivo. Após esta conquista, o selênio ganhou interesse renovado como um fotoabsorvedor de bandgap amplo com potencial de ser integrado em conjunto com fotoabsorvedores de bandgap inferior. No entanto, um grande défice na tensão de circuito aberto é actualmente o principal factor limitante para melhorar ainda mais a eficiência, o que exige a engenharia de defeitos dos filmes finos de selénio para aumentar a vida útil da portadora. Até o momento, a única estratégia de engenharia de defeitos investigada para células solares de película fina de selênio envolve a cristalização do selênio usando um laser.
Fotocondutores
Filmes finos de selênio amorfo (α-Se) encontraram aplicação como fotocondutores em detectores de raios X de tela plana. Esses detectores usam selênio amorfo para capturar e converter fótons de raios X incidentes diretamente em carga elétrica. O selênio foi escolhido para esta aplicação entre outros semicondutores devido a uma combinação de suas propriedades tecnológicas e físicas favoráveis:
- Selênio amorfo tem um baixo ponto de fusão, alta pressão de vapor e estrutura uniforme. Estas três propriedades permitem a deposição rápida e fácil de filmes uniformes de grande área com espessura até 1 mm a uma taxa de 1-5 μm/min. Sua uniformidade e falta de limites de grãos, que são intrínsecos a materiais policristalinos, melhorar a qualidade da imagem de raios X. Enquanto isso, a grande área é essencial para digitalizar o corpo humano ou itens de bagagem.
- O selênio é menos tóxico do que muitos semicondutores compostos que contêm metais arsênios ou pesados, como mercúrio ou chumbo.
- A mobilidade no campo elétrico aplicado é suficientemente alta para elétrons e furos, de modo que em um dispositivo típico de 0,2 mm de espessura, ca. 98% de elétrons e furos produzidos por raios-X são coletados nos eletrodos sem ser preso por vários defeitos. Consequentemente, a sensibilidade do dispositivo é alta, e seu comportamento é fácil de descrever por equações de transporte simples.
Retificadores
Os retificadores de selênio foram usados pela primeira vez em 1933. Eles foram substituídos principalmente por dispositivos baseados em silício. Uma exceção notável é a proteção contra surtos de energia CC, onde as capacidades superiores de energia dos supressores de selênio os tornam mais desejáveis do que os varistores de óxido metálico.
Outros usos
Pequenas quantidades de compostos organoselênio têm sido utilizadas para modificar os catalisadores utilizados na vulcanização para a produção de borracha.
A procura de selénio pela indústria electrónica está a diminuir. Suas propriedades fotovoltaicas e fotocondutoras ainda são úteis em fotocópias, fotocélulas, medidores de luz e células solares. Seu uso como fotocondutor em copiadoras de papel comum já foi uma aplicação líder, mas na década de 1980, a aplicação do fotocondutor declinou (embora ainda fosse um grande uso final) à medida que mais e mais copiadoras mudaram para fotocondutores orgânicos.
O seleneto de zinco foi o primeiro material para LEDs azuis, mas o nitreto de gálio domina esse mercado. O seleneto de cádmio era um componente importante nos pontos quânticos. Folhas de selênio amorfo convertem imagens de raios X em padrões de carga na xeroradiografia e em câmeras de raios X de tela plana de estado sólido. O selênio ionizado (Se+24) é um dos meios ativos utilizados em lasers de raios X.
O selênio catalisa algumas reações químicas, mas não é amplamente utilizado devido a problemas de toxicidade. Na cristalografia de raios X, a incorporação de um ou mais átomos de selênio no lugar do enxofre ajuda na dispersão anômala de múltiplos comprimentos de onda e no faseamento da dispersão anômala de comprimento de onda único.
O selênio é usado na tonificação de impressões fotográficas e é vendido como toner por vários fabricantes fotográficos. O selênio intensifica e amplia a gama tonal das imagens fotográficas em preto e branco e melhora a permanência das impressões.
75Se é usado como fonte gama em radiografia industrial.
O selênio é usado em alguns xampus anticaspa na forma de dissulfeto de selênio, como as marcas Selsun e Vichy Dereos.
Poluição
A poluição por selênio pode impactar alguns sistemas aquáticos e pode ser causada por fatores antropogênicos, como escoamento agrícola e processos industriais. As pessoas que comem mais peixe são geralmente mais saudáveis do que aquelas que comem menos, o que sugere que não há grandes preocupações para a saúde humana decorrentes da poluição por selénio, embora o selénio tenha um efeito potencial nos seres humanos.
Alterações fisiológicas substanciais podem ocorrer em peixes com altas concentrações de selênio nos tecidos. Os peixes afetados pelo selênio podem apresentar inchaço das lamelas branquiais, o que impede a difusão do oxigênio através das guelras e o fluxo sanguíneo dentro das guelras. A capacidade respiratória é ainda mais reduzida devido à ligação do selênio à hemoglobina. Outros problemas incluem degeneração do tecido hepático, inchaço ao redor do coração, folículos do óvulo danificados nos ovários, catarata e acúmulo de líquido na cavidade corporal e na cabeça. O selênio costuma causar malformação no feto do peixe, que pode ter problemas para se alimentar ou respirar; distorção das nadadeiras ou da coluna também é comum. Os peixes adultos podem parecer saudáveis apesar da sua incapacidade de produzir descendentes viáveis.
O selênio é bioacumulado em habitats aquáticos, o que resulta em concentrações mais elevadas nos organismos do que na água circundante. Os compostos organoselênio podem ser concentrados mais de 200.000 vezes pelo zooplâncton quando as concentrações de água estão na faixa de 0,5 a 0,8 μg Se/L. O selênio inorgânico bioacumula-se mais facilmente no fitoplâncton do que no zooplâncton. O fitoplâncton pode concentrar selênio inorgânico por um fator de 3.000. A concentração adicional através da bioacumulação ocorre ao longo da cadeia alimentar, à medida que os predadores consomem presas ricas em selênio. Recomenda-se que uma concentração de água de 2 μg Se/L seja considerada altamente perigosa para peixes e aves aquáticas sensíveis. O envenenamento por selênio pode ser transmitido dos pais para os filhos através do óvulo, e o envenenamento por selênio pode persistir por muitas gerações. A reprodução de patos-reais é prejudicada em concentrações dietéticas de 7 μg Se/L. Muitos invertebrados bentônicos podem tolerar concentrações de selênio de até 300 μg/L de Se em sua dieta.
A bioacumulação de selênio em ambientes aquáticos causa a morte de peixes dependendo das espécies na área afetada. Existem, no entanto, algumas espécies que sobreviveram a estes eventos e toleraram o aumento do selénio. Também foi sugerido que a estação do ano poderia ter um impacto nos efeitos nocivos do selênio nos peixes.
O envenenamento por selênio dos sistemas de água pode ocorrer sempre que novos escoamentos agrícolas fluem através de terras secas. Este processo lixivia compostos naturais de selênio solúveis (como selenatos) para a água, que pode então ser concentrada em áreas úmidas à medida que a água evapora. A poluição por selênio dos cursos de água também ocorre quando o selênio é lixiviado das cinzas de combustão de carvão, da mineração e da fundição de metais, do processamento de petróleo bruto e dos aterros sanitários. Descobriu-se que altos níveis de selênio nos cursos de água causam doenças congênitas em espécies ovíparas, incluindo aves e peixes de áreas úmidas. Níveis elevados de metilmercúrio na dieta podem amplificar os danos da toxicidade do selênio em espécies ovíparas.
Casos
No lago Belews, na Carolina do Norte, 19 espécies de peixes foram eliminadas do lago devido a 150–200 μg Se/L de águas residuais descarregadas de 1974 a 1986 por uma usina de energia a carvão da Duke Energy. No Refúgio Nacional de Vida Selvagem de Kesterson, na Califórnia, milhares de peixes e aves aquáticas foram envenenados por selênio na drenagem de irrigação agrícola.
Papel biológico
Embora seja tóxico em grandes doses, o selênio é um micronutriente essencial para os animais. Nas plantas, ocorre como um mineral espectador, às vezes em proporções tóxicas na forragem (algumas plantas podem acumular selênio como defesa contra serem comidas por animais, mas outras plantas, como a alfarroba, necessitam de selênio, e seu crescimento indica a presença de selênio no solo).
O selênio é um componente dos aminoácidos incomuns selenocisteína e selenometionina. Nos seres humanos, o selênio é um nutriente oligoelemento que funciona como cofator para a redução de enzimas antioxidantes, como as glutationa peroxidases e certas formas de tiorredoxina redutase encontradas em animais e algumas plantas (esta enzima ocorre em todos os organismos vivos, mas não em todas as suas formas). nas plantas necessitam de selênio).
A família de enzimas da glutationa peroxidase (GSH-Px) catalisa certas reações que removem espécies reativas de oxigênio, como peróxido de hidrogênio e hidroperóxidos orgânicos:
- 2 GSH + H2O2---- GSH-Px → GSSG + 2 H2O
A glândula tireoide e todas as células que utilizam o hormônio tireoidiano usam selênio, que é um cofator para três dos quatro tipos conhecidos de desiodases do hormônio tireoidiano, que ativam e desativam vários hormônios tireoidianos e seus metabólitos; as iodotironina desiodases são a subfamília de enzimas desiodinases que usam selênio como o raro aminoácido selenocisteína. (Apenas a deiodinase iodotirosina deiodinase, que atua nos últimos produtos de degradação do hormônio tireoidiano, não utiliza selênio.)
O selênio pode inibir a doença de Hashimoto, na qual as próprias células da tireoide do corpo são atacadas como estranhas. É relatada uma redução de 21% nos anticorpos TPO com a ingestão dietética de 0,2 mg de selênio.
O aumento do selênio na dieta reduz os efeitos da toxicidade do mercúrio, embora seja eficaz apenas em doses baixas a modestas de mercúrio. As evidências sugerem que os mecanismos moleculares da toxicidade do mercúrio incluem a inibição irreversível das selenoenzimas que são necessárias para prevenir e reverter o dano oxidativo no cérebro e nos tecidos endócrinos. O composto selenoneína contendo Se está presente no sangue do atum rabilho.
Evolução em biologia
Há cerca de três mil milhões de anos, as famílias de selenoproteínas procarióticas impulsionaram a evolução da selenocisteína, um aminoácido. O selênio é incorporado em várias famílias de selenoproteínas procarióticas em bactérias, arquéias e eucariotos como selenocisteína, onde as peroxirredoxinas selenoproteicas protegem as células bacterianas e eucarióticas contra danos oxidativos. As famílias de selenoproteínas de GSH-Px e as deiodinases de células eucarióticas parecem ter origem filogenética bacteriana. A forma contendo selenocisteína ocorre em espécies tão diversas como algas verdes, diatomáceas, ouriços-do-mar, peixes e galinhas. As enzimas de selênio estão envolvidas nas pequenas moléculas redutoras glutationa e tiorredoxina. Uma família de moléculas contendo selênio (as glutationa peroxidases) destrói o peróxido e repara as membranas celulares peroxidadas danificadas, usando glutationa. Outra enzima contendo selênio em algumas plantas e animais (tiorredoxina redutase) gera tiorredoxina reduzida, um ditiol que serve como fonte de elétrons para peroxidases e também a importante enzima redutora ribonucleotídeo redutase que produz precursores de DNA a partir de precursores de RNA.
Os oligoelementos envolvidos nas atividades das enzimas GSH-Px e superóxido dismutase, ou seja, selênio, vanádio, magnésio, cobre e zinco, podem estar faltando em algumas áreas terrestres com deficiência de minerais. Os organismos marinhos retiveram e por vezes expandiram os seus selenoproteomas, enquanto os selenoproteomas de alguns organismos terrestres foram reduzidos ou completamente perdidos. Estas descobertas sugerem que, com exceção dos vertebrados, a vida aquática apoia a utilização de selénio, enquanto os habitats terrestres levam à redução da utilização deste oligoelemento. Peixes marinhos e glândulas tireóide de vertebrados têm a maior concentração de selênio e iodo. Há cerca de 500 milhões de anos, as plantas terrestres e de água doce otimizaram lentamente a produção de "novas" antioxidantes endógenos, como ácido ascórbico (vitamina C), polifenóis (incluindo flavonóides), tocoferóis, etc. Alguns deles apareceram nos últimos 50-200 milhões de anos, em frutos e flores de plantas angiospermas. Na verdade, as angiospermas (o tipo de planta dominante hoje) e a maioria dos seus pigmentos antioxidantes evoluíram durante o final do período Jurássico.
As isoenzimas deiodinase constituem outra família de selenoenzimas eucarióticas. As desiodinases estão envolvidas na regulação do hormônio tireoidiano, participando na proteção dos tireócitos contra danos causados pelo H2O2 produzido para a biossíntese do hormônio tireoidiano. Cerca de 200 milhões de anos atrás, novas selenoproteínas foram desenvolvidas como enzimas GSH-Px de mamíferos.
Fontes nutricionais de selênio
O selênio dietético vem da carne, nozes, cereais e cogumelos. A castanha-do-pará é a fonte alimentar mais rica (embora dependa do solo, uma vez que a castanha-do-pará não requer altos níveis do elemento para suas próprias necessidades).
A Dose Dietética Recomendada (RDA) de selênio nos EUA para adolescentes e adultos é de 55 µg/dia. O selênio como suplemento dietético está disponível em muitas formas, incluindo suplementos multivitamínicos/minerais, que normalmente contêm 55 ou 70 µg/porção. Suplementos específicos de selênio normalmente contêm 100 ou 200 µg/porção.
Em junho de 2015, a Food and Drug Administration (FDA) dos EUA publicou sua regra final estabelecendo a exigência de níveis mínimos e máximos de selênio em fórmulas infantis.
Acredita-se que o conteúdo de selênio no corpo humano esteja na faixa de 13 a 20 mg.
Espécies de plantas indicadoras
Certas espécies de plantas são consideradas indicadores de alto teor de selênio no solo porque requerem altos níveis de selênio para prosperar. As principais plantas indicadoras de selênio são as espécies Astragalus (incluindo algumas locoweeds), pluma do príncipe (Stanleya sp.), ásteres lenhosos (Xylorhiza sp.) e falsa erva-dourada (Oonopsis sp.)
Detecção em fluidos biológicos
O selênio pode ser medido no sangue, plasma, soro ou urina para monitorar a exposição ambiental ou ocupacional excessiva, para confirmar um diagnóstico de envenenamento em vítimas hospitalizadas ou para investigar um caso suspeito de overdose fatal. Algumas técnicas analíticas são capazes de distinguir as formas orgânicas das inorgânicas do elemento. Ambas as formas orgânicas e inorgânicas de selênio são amplamente convertidas em conjugados de monossacarídeos (selenosaçúcares) no corpo antes da eliminação na urina. Pacientes com câncer que recebem doses orais diárias de selenotionina podem atingir concentrações muito elevadas de selênio no plasma e na urina.
Toxicidade
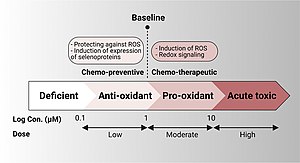
Embora o selênio seja um oligoelemento essencial, ele é tóxico se ingerido em excesso. Exceder o nível superior tolerável de ingestão de 400 microgramas por dia pode causar selenose. Este nível de ingestão superior tolerável de 400 µg é baseado principalmente em um estudo de 1986 com cinco pacientes chineses que exibiram sinais evidentes de selenose e em um estudo de acompanhamento nas mesmas cinco pessoas em 1992. O estudo de 1992 realmente descobriu a ingestão máxima segura de Se na dieta para ser de aproximadamente 800 microgramas por dia (15 microgramas por quilograma de peso corporal), mas sugeriu 400 microgramas por dia para evitar a criação de um desequilíbrio de nutrientes na dieta e para estar de acordo com dados de outros países. Na China, as pessoas que ingeriram milho cultivado em carvão pedregoso extremamente rico em selénio (xisto carbonáceo) sofreram de toxicidade por selénio. Foi demonstrado que este carvão possui um teor de selênio de até 9,1%, a maior concentração em carvão já registrada.
Os sinais e sintomas da selenose incluem odor de alho no hálito, distúrbios gastrointestinais, queda de cabelo, descamação das unhas, fadiga, irritabilidade e danos neurológicos. Casos extremos de selenose podem apresentar cirrose hepática, edema pulmonar ou morte. O selênio elementar e a maioria dos selenetos metálicos apresentam toxicidade relativamente baixa devido à baixa biodisponibilidade. Por outro lado, os selenatos e selenitos têm um modo de ação oxidante semelhante ao do trióxido de arsênico e são muito tóxicos. A dose tóxica crônica de selenito para humanos é de cerca de 2.400 a 3.000 microgramas de selênio por dia. O seleneto de hidrogênio é um gás extremamente tóxico e corrosivo. O selênio também ocorre em compostos orgânicos, como seleneto de dimetila, selenometionina, selenocisteína e metilselenocisteína, todos com alta biodisponibilidade e são tóxicos em grandes doses.
Em 19 de abril de 2009, 21 pôneis de pólo morreram pouco antes de uma partida no Aberto de Polo dos Estados Unidos. Três dias depois, uma farmácia divulgou um comunicado explicando que os cavalos haviam recebido uma dose incorreta de um dos ingredientes usados em um suplemento vitamínico/mineral que havia sido preparado incorretamente por uma farmácia de manipulação. A análise dos níveis sanguíneos de compostos inorgânicos no suplemento indicou que as concentrações de selênio eram 10 a 15 vezes maiores que o normal nas amostras de sangue e 15 a 20 vezes maiores que o normal nas amostras de fígado. O selênio foi posteriormente confirmado como o fator tóxico.

Em peixes e outros animais selvagens, o selênio é necessário à vida, mas é tóxico em altas doses. Para o salmão, a concentração ideal de selênio é de cerca de 1 micrograma de selênio por grama de peso corporal total. Muito abaixo desse nível, os salmões jovens morrem por deficiência; muito acima, morrem por excesso tóxico.
A Administração de Segurança e Saúde Ocupacional (OSHA) estabeleceu o limite legal (limite de exposição permitido) para o selênio no local de trabalho em 0,2 mg/m3 durante um dia de trabalho de 8 horas. O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH) estabeleceu um limite de exposição recomendado (REL) de 0,2 mg/m3 durante um dia de trabalho de 8 horas. Em níveis de 1 mg/m3, o selênio é imediatamente perigoso para a vida e a saúde.
Deficiência
A deficiência de selênio pode ocorrer em pacientes com função intestinal gravemente comprometida, naqueles submetidos à nutrição parenteral total e naqueles com idade avançada (acima de 90 anos). Além disso, as pessoas que dependem de alimentos cultivados em solos deficientes em selénio estão em risco. Embora o solo da Nova Zelândia tenha baixos níveis de selênio, não foram detectados efeitos adversos à saúde dos residentes.
A deficiência de selênio, definida por níveis baixos (<60% do normal) de atividade da selenoenzima no cérebro e nos tecidos endócrinos, ocorre apenas quando um nível baixo de selênio está associado a um estresse adicional, como altas exposições ao mercúrio ou aumento do estresse oxidativo por deficiência de vitamina E.
O selênio interage com outros nutrientes, como o iodo e a vitamina E. O efeito da deficiência de selênio na saúde permanece incerto, especialmente em relação à doença de Kashin-Beck. Além disso, o selênio interage com outros minerais, como zinco e cobre. Altas doses de suplementos de selênio em animais gestantes podem perturbar a proporção zinco:cobre e levar à redução do zinco; nesses casos de tratamento, os níveis de zinco devem ser monitorados. Mais estudos são necessários para confirmar essas interações.
Nas regiões (por exemplo, várias regiões da América do Norte) onde baixos níveis de selênio no solo levam a baixas concentrações nas plantas, algumas espécies animais podem ser deficientes, a menos que o selênio seja suplementado com dieta ou injeção. Os ruminantes são particularmente suscetíveis. Em geral, a absorção de selênio na dieta é menor em ruminantes do que em outros animais, e é menor em forragens do que em grãos. Ruminantes que pastam certas forragens, por exemplo, algumas variedades de trevo branco contendo glicosídeos cianogênicos, podem ter maiores necessidades de selênio, presumivelmente porque o cianeto é liberado da aglicona pela atividade da glucosidase no rúmen e as glutationa peroxidases são desativadas pelo cianeto que atua na porção glutationa. Ruminantes neonatos com risco de doença do músculo branco podem receber selênio e vitamina E por injeção; algumas das miopatias das ADM respondem apenas ao selênio, algumas apenas à vitamina E e outras a ambos.
Efeitos na saúde
Os efeitos da ingestão de selênio no câncer foram estudados em vários ensaios clínicos e estudos epidemiológicos em humanos. O selênio pode ter um papel quimiopreventivo no risco de câncer como antioxidante e pode desencadear a resposta imunológica. Em níveis baixos, é usado no corpo para criar selenoproteínas antioxidantes; em doses mais altas do que o normal, causa a morte celular.
O selênio (em estreita relação com o iodo) desempenha um papel importante na saúde da tireoide. O selênio é um cofator das três desiodinases do hormônio tireoidiano, ajudando a ativar e desativar vários hormônios tireoidianos e seus metabólitos. A deficiência isolada de selênio está sendo investigada por seu papel na indução de reações autoimunes na glândula tireoide na doença de Hashimoto. No entanto, num caso de deficiência combinada de iodo e selénio, a deficiência de selénio demonstrou desempenhar um papel protetor da tiróide.
Contenido relacionado
Célula eletroquímica
Cristal
Processo endotérmico
Isomeria cis-trans
Hélio
