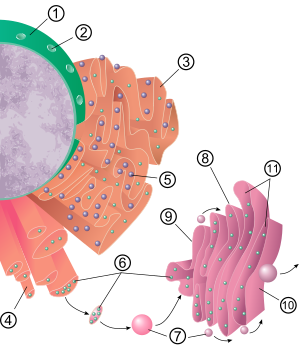
Retículo endoplasmático
O retículo endoplasmático (ER) é, em essência, o sistema de transporte da célula eucariótica e tem muitas outras funções importantes, como o enovelamento de proteínas. É um tipo de organela composta por duas subunidades – retículo endoplasmático rugoso (RER) e retículo endoplasmático liso (SER). O retículo endoplasmático é encontrado na maioria das células eucarióticas e forma uma rede interconectada de sacos achatados envoltos por membrana conhecidos como cisternas (no RER) e estruturas tubulares no SER. As membranas do RE são contínuas com a membrana nuclear externa. O retículo endoplasmático não é encontrado em glóbulos vermelhos ou espermatozóides.
Os dois tipos de ER compartilham muitas das mesmas proteínas e se envolvem em certas atividades comuns, como a síntese de certos lipídios e colesterol. Diferentes tipos de células contêm diferentes proporções dos dois tipos de RE, dependendo das atividades da célula. RER é encontrado principalmente em direção ao núcleo da célula e SER em direção à membrana celular ou membrana plasmática da célula.
A face externa (citosólica) do RER é repleta de ribossomos que são os locais de síntese de proteínas. O RER é especialmente proeminente em células como os hepatócitos. O SER carece de ribossomos e funciona na síntese de lipídios, mas não no metabolismo, na produção de hormônios esteróides e na desintoxicação. O SER é especialmente abundante no fígado de mamíferos e nas células gonadais.
O RE foi observado com microscópio de luz por Garnier em 1897, que cunhou o termo ergastoplasma. Com a microscopia eletrônica, as membranas rendadas do retículo endoplasmático foram vistas pela primeira vez em 1945 por Keith R. Porter, Albert Claude e Ernest F. Fullam. Mais tarde, a palavra reticulum, que significa "rede", foi aplicada por Porter em 1953 para descrever esse tecido de membranas.
Estrutura
A estrutura geral do retículo endoplasmático é uma rede de membranas chamadas cisternas. Essas estruturas semelhantes a sacos são mantidas juntas pelo citoesqueleto. A membrana fosfolipídica envolve o espaço cisternal (ou lúmen), que é contínuo com o espaço perinuclear, mas separado do citosol. As funções do retículo endoplasmático podem ser resumidas como a síntese e exportação de proteínas e lipídios de membrana, mas varia entre RE e tipo de célula e função celular. A quantidade de retículo endoplasmático rugoso e liso em uma célula pode alternar lentamente de um tipo para outro, dependendo das mudanças nas atividades metabólicas da célula. A transformação pode incluir a incorporação de novas proteínas na membrana, bem como mudanças estruturais. Alterações no conteúdo de proteína podem ocorrer sem alterações estruturais perceptíveis.
Retículo endoplasmático rugoso
A superfície do retículo endoplasmático rugoso (muitas vezes abreviado como RER ou ER rugoso; também chamado de retículo endoplasmático granular) é cravejado de proteínas fabricando ribossomos dando-lhe um aspecto "rugoso" aparência (daí seu nome). O sítio de ligação do ribossomo no retículo endoplasmático rugoso é o translocon. No entanto, os ribossomos não são uma parte estável da estrutura dessa organela, pois estão constantemente sendo ligados e liberados da membrana. Um ribossomo só se liga ao RER quando um complexo específico de proteína-ácido nucleico se forma no citosol. Esse complexo especial se forma quando um ribossomo livre começa a traduzir o mRNA de uma proteína destinada à via secretora. Os primeiros 5 a 30 aminoácidos polimerizados codificam um peptídeo sinal, uma mensagem molecular que é reconhecida e ligada por uma partícula de reconhecimento de sinal (SRP). A tradução é interrompida e o complexo ribossomal se liga ao translocon do RER, onde a tradução continua com a formação da proteína nascente (nova) no lúmen e/ou membrana do RER. A proteína é processada no lúmen do RE por uma enzima (uma peptidase sinalizadora), que remove o peptídeo sinalizador. Os ribossomos neste ponto podem ser liberados de volta ao citosol; no entanto, os ribossomos não traduzíveis também são conhecidos por permanecerem associados aos translocons.
A membrana do retículo endoplasmático rugoso forma grandes folhas de membrana dupla localizadas próximas e contínuas com a camada externa do envelope nuclear. As folhas de membrana dupla são empilhadas e conectadas através de várias rampas helicoidais direitas ou esquerdas, as "rampas Terasaki", dando origem a uma estrutura semelhante a um estacionamento. Embora não haja membrana contínua entre o retículo endoplasmático e o aparelho de Golgi, as vesículas de transporte ligadas à membrana transportam proteínas entre esses dois compartimentos. As vesículas são cercadas por proteínas de revestimento chamadas COPI e COPII. O COPII direciona as vesículas para o aparelho de Golgi e o COPI as marca para serem trazidas de volta ao retículo endoplasmático rugoso. O retículo endoplasmático rugoso trabalha em conjunto com o complexo de Golgi para direcionar novas proteínas para seus destinos apropriados. O segundo método de transporte para fora do retículo endoplasmático envolve áreas chamadas de locais de contato com a membrana, onde as membranas do retículo endoplasmático e outras organelas são mantidas juntas, permitindo a transferência de lipídios e outras moléculas pequenas.
O retículo endoplasmático rugoso é fundamental em múltiplas funções:
- Fabricação de enzimas lysosomal com um marcador mannose-6-fosfato adicionado no Cis- Rede Golgi.
- Fabricação de proteínas secretas, ou secretadas constitutivamente sem etiqueta ou secretadas de forma regulatória envolvendo clatrina e emparelhado aminoácidos básicos no peptídeo de sinal.
- Proteínas de membrana integral que permanecem embutidas na membrana como saída de vesículas e se ligam a novas membranas. As proteínas do coelho são a chave na segmentação da membrana; as proteínas SNAP e SNARE são a chave no evento de fusão.
- A glicosilação inicial como a montagem continua. Este é N-linked (O-linking ocorre no Golgi).
- Glicosilação ligada: Se a proteína for devidamente dobrada, a oligosacchariltransferase reconhece a sequência AA NXS ou NXT (com o resíduo S/T fosforilado) e adiciona uma espinha dorsal 14-sugar (2-N-acetylglucosamine, manga de 9 branching, e 3-glucose no final) ao nitrogênio de cadeia lateral de Asn.
Retículo endoplasmático liso
Na maioria das células, o retículo endoplasmático liso (abreviado SER) é escasso. Em vez disso, existem áreas onde o RE é parcialmente liso e parcialmente rugoso, essa área é chamada de RE de transição. O RE transicional recebe esse nome porque contém locais de saída do RE. Essas são áreas onde as vesículas de transporte que contêm lipídios e proteínas produzidas no RE se desprendem do RE e começam a se mover para o aparelho de Golgi. Células especializadas podem ter muito retículo endoplasmático liso e nessas células o RE liso tem muitas funções. Sintetiza lipídios, fosfolipídios e esteróides. As células que secretam esses produtos, como as dos testículos, ovários e glândulas sebáceas, possuem uma abundância de retículo endoplasmático liso. Também realiza o metabolismo de carboidratos, desintoxicação de produtos naturais do metabolismo e de álcool e drogas, fixação de receptores em proteínas da membrana celular e metabolismo de esteróides. Nas células musculares, regula a concentração de íons de cálcio. O retículo endoplasmático liso é encontrado em uma variedade de tipos de células (animais e vegetais) e desempenha diferentes funções em cada um. O retículo endoplasmático liso também contém a enzima glicose-6-fosfatase, que converte glicose-6-fosfato em glicose, uma etapa da gliconeogênese. Ele está conectado ao envelope nuclear e consiste em túbulos localizados próximos à periferia celular. Esses tubos às vezes se ramificam formando uma rede de aparência reticular. Em algumas células, existem áreas dilatadas como os sacos do retículo endoplasmático rugoso. A rede de retículo endoplasmático liso permite que uma área de superfície aumentada seja dedicada à ação ou armazenamento de enzimas-chave e produtos dessas enzimas.
Retículo sarcoplasmático
O retículo sarcoplasmático (RS), do grego σάρξ sarx ("carne"), é o RE liso encontrado nas células musculares. A única diferença estrutural entre essa organela e o retículo endoplasmático liso é a composição das proteínas que possuem, ambas ligadas às suas membranas e à deriva dentro dos limites de seus lúmens. Essa diferença fundamental é indicativa de suas funções: o retículo endoplasmático sintetiza moléculas, enquanto o retículo sarcoplasmático armazena íons de cálcio e os bombeia para o sarcoplasma quando a fibra muscular é estimulada. Após sua liberação do retículo sarcoplasmático, os íons cálcio interagem com proteínas contráteis que utilizam ATP para encurtar a fibra muscular. O retículo sarcoplasmático desempenha um papel importante no acoplamento excitação-contração.
Funções
O retículo endoplasmático desempenha muitas funções gerais, incluindo o dobramento de moléculas de proteína em sacos chamados cisternas e o transporte de proteínas sintetizadas em vesículas para o aparelho de Golgi. O retículo endoplasmático rugoso também está envolvido na síntese de proteínas. O dobramento correto de proteínas recém-fabricadas é possibilitado por várias proteínas chaperonas do retículo endoplasmático, incluindo proteína dissulfeto isomerase (PDI), ERp29, o membro da família Hsp70 BiP/Grp78, calnexina, calreticulina e a família peptidilprolil isomerase. Apenas proteínas dobradas adequadamente são transportadas do RE rugoso para o aparelho de Golgi – as proteínas desdobradas causam uma resposta de proteína desdobrada como uma resposta ao estresse no RE. Distúrbios na regulação redox, regulação de cálcio, privação de glicose e infecção viral ou a superexpressão de proteínas podem levar à resposta de estresse do retículo endoplasmático (estresse de RE), um estado no qual o dobramento de proteínas diminui, levando a um aumento de proteínas desdobradas. Esse estresse está emergindo como uma causa potencial de danos na hipóxia/isquemia, resistência à insulina e outros distúrbios.
Transporte de proteínas
Proteínas secretoras, principalmente glicoproteínas, são movidas através da membrana do retículo endoplasmático. As proteínas que são transportadas pelo retículo endoplasmático por toda a célula são marcadas com uma etiqueta de endereço chamada de sequência de sinal. O N-terminal (uma extremidade) de uma cadeia polipeptídica (ou seja, uma proteína) contém alguns aminoácidos que funcionam como uma etiqueta de endereço, que são removidos quando o polipeptídeo atinge seu destino. Os peptídeos nascentes chegam ao RE através do translocon, um complexo multiproteico incorporado à membrana. As proteínas destinadas a locais fora do retículo endoplasmático são acondicionadas em vesículas de transporte e movidas ao longo do citoesqueleto em direção ao seu destino. Nos fibroblastos humanos, o RE está sempre codistribuído com os microtúbulos e a despolimerização destes provoca a sua coagregação com as mitocôndrias, também associadas ao RE.
O retículo endoplasmático também faz parte de uma via de classificação de proteínas. É, em essência, o sistema de transporte da célula eucariótica. A maioria de suas proteínas residentes são retidas dentro dele por meio de um motivo de retenção. Este motivo é composto por quatro aminoácidos no final da sequência da proteína. As sequências de retenção mais comuns são KDEL para proteínas localizadas no lúmen e KKXX para proteínas transmembrana. No entanto, variações de KDEL e KKXX ocorrem, e outras sequências também podem dar origem à retenção do retículo endoplasmático. Não se sabe se tal variação pode levar a localizações sub-ER. Existem três receptores KDEL (1, 2 e 3) em células de mamíferos, e eles têm um grau muito alto de identidade de sequência. As diferenças funcionais entre esses receptores ainda precisam ser estabelecidas.
Regulação bioenergética do suprimento de ER ATP por um mecanismo CaATiER
O retículo endoplasmático não abriga uma maquinaria de regeneração de ATP e, portanto, requer a importação de ATP das mitocôndrias. O ATP importado é vital para o ER realizar suas funções celulares de manutenção da casa, como o dobramento e o tráfego de proteínas.
O transportador de ATP do ER, SLC35B1/AXER, foi recentemente clonado e caracterizado, e as mitocôndrias fornecem ATP ao ER através de um transporte Ca2+ para o ER (CaATiER). O mecanismo CaATiER mostra sensibilidade ao Ca2+ citosólico variando de alto nM a baixo intervalo de μM, com o elemento de detecção de Ca2+ ainda para ser identificado e validado.
Significado clínico
O estresse aumentado e suprafisiológico do RE nas células β pancreáticas interrompe a secreção normal de insulina, levando à hiperinsulinemia e, consequentemente, à resistência periférica à insulina associada à obesidade em humanos. Ensaios clínicos em humanos também sugeriram uma ligação causal entre o aumento induzido pela obesidade na secreção de insulina e a resistência periférica à insulina.
Anormalidades em XBP1 levam a uma resposta de estresse do retículo endoplasmático aumentada e, subsequentemente, causam uma maior suscetibilidade a processos inflamatórios que podem até contribuir para a doença de Alzheimer. No cólon, as anomalias XBP1 têm sido associadas a doenças inflamatórias intestinais, incluindo a doença de Crohn.
A resposta de proteína desdobrada (UPR) é uma resposta celular ao estresse relacionada ao retículo endoplasmático. A UPR é ativada em resposta a um acúmulo de proteínas desdobradas ou mal dobradas no lúmen do retículo endoplasmático. O UPR funciona para restaurar a função normal da célula, interrompendo a tradução de proteínas, degradando proteínas mal dobradas e ativando as vias de sinalização que levam ao aumento da produção de chaperonas moleculares envolvidas no dobramento de proteínas. A superativação sustentada da UPR tem sido implicada em doenças causadas por príons, bem como em várias outras doenças neurodegenerativas, e a inibição da UPR pode se tornar um tratamento para essas doenças.
Contenido relacionado
Chacal
Martim-pescador
Zebrafish