Resistência antimicrobiana

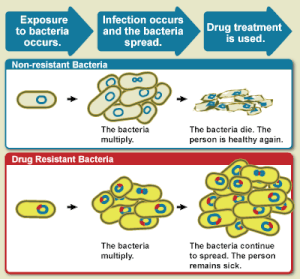
A resistência antimicrobiana (AMR) ocorre quando os micróbios desenvolvem mecanismos que os protegem dos efeitos dos antimicrobianos. Todas as classes de micróbios podem desenvolver resistência. Os fungos desenvolvem resistência antifúngica. Os vírus desenvolvem resistência antiviral. Os protozoários desenvolvem resistência antiprotozoária e as bactérias desenvolvem resistência a antibióticos. Bactérias consideradas extensivamente resistentes a medicamentos (XDR) ou totalmente resistentes a medicamentos (TDR) às vezes são chamadas de superbactérias. Embora a resistência antimicrobiana seja um processo natural, muitas vezes é o resultado do uso inadequado de medicamentos e do controle das infecções.
Resistência a antibióticos é um subconjunto importante de RAM, que se aplica especificamente a bactérias que se tornam resistentes a antibióticos. A resistência em bactérias pode surgir naturalmente por mutação genética ou por uma espécie adquirindo resistência de outra. A resistência pode aparecer espontaneamente por causa de mutações aleatórias. No entanto, o uso prolongado de antimicrobianos parece encorajar a seleção de mutações que podem tornar os antimicrobianos ineficazes.
As condições clínicas devido à RAM causam milhões de mortes a cada ano. As infecções causadas por micróbios resistentes são mais difíceis de tratar, exigindo doses mais altas de medicamentos antimicrobianos ou medicamentos alternativos que podem ser mais tóxicos. Essas abordagens também podem ser mais caras. Os micróbios resistentes a vários antimicrobianos são chamados de multirresistentes (MDR).
A prevenção do uso indevido de antibióticos, que pode levar à resistência aos antibióticos, inclui tomar antibióticos apenas quando prescritos. Os antibióticos de espectro estreito são preferidos aos antibióticos de amplo espectro quando possível, pois o direcionamento eficaz e preciso de organismos específicos é menos provável de causar resistência, bem como efeitos colaterais. Para as pessoas que tomam esses medicamentos em casa, a educação sobre o uso adequado é essencial. Os profissionais de saúde podem minimizar a disseminação de infecções resistentes por meio de saneamento e higiene adequados, incluindo lavagem das mãos e desinfecção entre pacientes, e devem incentivar o mesmo do paciente, visitantes e familiares.
O aumento da resistência aos medicamentos é causado principalmente pelo uso de antimicrobianos em humanos e outros animais e pela disseminação de cepas resistentes entre os dois. A crescente resistência também tem sido associada à liberação de efluentes tratados inadequadamente da indústria farmacêutica, especialmente em países onde são fabricados medicamentos a granel. Os antibióticos aumentam a pressão seletiva nas populações bacterianas, causando a morte de bactérias vulneráveis; isso aumenta a porcentagem de bactérias resistentes que continuam crescendo. Mesmo em níveis muito baixos de antibióticos, as bactérias resistentes podem ter uma vantagem de crescimento e crescer mais rápido do que as bactérias vulneráveis. À medida que a resistência aos antibióticos se torna mais comum, há maior necessidade de tratamentos alternativos. Chamadas para novas terapias com antibióticos foram emitidas, mas o desenvolvimento de novos medicamentos está se tornando mais raro.
A resistência antimicrobiana está aumentando globalmente devido ao aumento da prescrição e distribuição de medicamentos antibióticos nos países em desenvolvimento. As estimativas são de que 700.000 a vários milhões de mortes resultam por ano e continuam a representar uma grande ameaça à saúde pública em todo o mundo. Todos os anos nos Estados Unidos, pelo menos 2,8 milhões de pessoas são infectadas com bactérias resistentes a antibióticos e pelo menos 35.000 pessoas morrem e US$ 55 bilhões em aumento de custos com saúde e perda de produtividade. De acordo com estimativas da Organização Mundial da Saúde (OMS), 350 milhões de mortes podem ser causadas pela RAM até 2050. Até então, o número de mortes anuais será de 10 milhões, de acordo com um relatório das Nações Unidas.
Existem chamadas públicas para ação coletiva global para lidar com a ameaça que incluem propostas de tratados internacionais sobre resistência antimicrobiana. A resistência a antibióticos em todo o mundo não está completamente identificada, mas os países mais pobres com sistemas de saúde mais fracos são mais afetados. Durante a pandemia do COVID-19, a ação contra a resistência antimicrobiana diminuiu devido aos cientistas se concentrarem mais na pesquisa do SARS-CoV-2.
Definição
A OMS define resistência antimicrobiana como a resistência de um microrganismo a um medicamento antimicrobiano que já foi capaz de tratar uma infecção por esse microrganismo. Uma pessoa não pode se tornar resistente a antibióticos. A resistência é uma propriedade do micróbio, não de uma pessoa ou outro organismo infectado por um micróbio. Todos os tipos de micróbios podem desenvolver resistência a medicamentos. Assim, há resistência a antibióticos, antifúngicos, antivirais e antiparasitários.
A resistência aos antibióticos é um subconjunto da resistência aos antibióticos. Essa resistência mais específica está ligada a bactérias patogênicas e, portanto, dividida em dois subconjuntos adicionais, microbiológica e clínica. A resistência ligada microbiologicamente é a mais comum e ocorre a partir de genes, mutantes ou herdados, que permitem que a bactéria resista ao mecanismo associado a certos antibióticos. A resistência clínica manifesta-se através do insucesso de muitas técnicas terapêuticas em que as bactérias normalmente susceptíveis a um tratamento tornam-se resistentes após sobreviverem ao resultado do tratamento. Em ambos os casos de resistência adquirida, a bactéria pode passar o catalisador genético para resistência por meio de conjugação, transdução ou transformação. Isso permite que a resistência se espalhe pelo mesmo patógeno ou mesmo por patógenos bacterianos semelhantes.
Visão geral
O relatório da OMS divulgado em abril de 2014 afirmou: "essa grave ameaça não é mais uma previsão para o futuro, está acontecendo agora em todas as regiões do mundo e tem o potencial de afetar qualquer pessoa, de qualquer idade, em qualquer país. A resistência aos antibióticos – quando as bactérias mudam de forma que os antibióticos não funcionam mais em pessoas que precisam deles para tratar infecções – é agora uma grande ameaça à saúde pública."
As mortes globais atribuíveis à RAM totalizaram 1,27 milhão em 2019. Naquele ano, a RAM pode ter contribuído para 5 milhões de mortes e uma em cada cinco pessoas que morreram devido à RAM eram crianças com menos de cinco anos de idade.
Em 2018, a OMS considerou a resistência a antibióticos uma das maiores ameaças à saúde global, segurança alimentar e desenvolvimento. As mortes atribuíveis à RAM variam de acordo com a área:
| Lugar | Mortes por 100.000 atribuíveis a AMR |
|---|---|
| África do Norte e Oriente Médio | 1,2 |
| Sudeste e Leste da Ásia, e Oceania | 1,7 |
| América Latina e Caribe | 14.4 |
| Europa Central e Oriental e Ásia Central | 1,6 |
| Sul da Ásia | 21.5 |
| África Subsaariana | 23.7 |
O Centro Europeu de Prevenção e Controle de Doenças calculou que em 2015 houve 671.689 infecções na UE e no Espaço Econômico Europeu causadas por bactérias resistentes a antibióticos, resultando em 33.110 mortes. A maioria foi adquirida em ambientes de saúde.
Causas
A resistência antimicrobiana é causada principalmente pelo uso excessivo de antimicrobianos. Isso leva os micróbios a desenvolverem uma defesa contra os medicamentos usados para tratá-los, ou certas cepas de micróbios que têm uma resistência natural aos antimicrobianos se tornando muito mais prevalentes do que aquelas que são facilmente derrotadas com medicamentos. Embora a resistência antimicrobiana ocorra naturalmente ao longo do tempo, o uso de agentes antimicrobianos em uma variedade de ambientes, tanto no setor de saúde quanto fora dele, fez com que a resistência antimicrobiana se tornasse cada vez mais prevalente.
Ocorrência natural
A resistência antimicrobiana pode evoluir naturalmente devido à exposição contínua a antimicrobianos. A seleção natural significa que os organismos que são capazes de se adaptar ao seu ambiente, sobrevivem e continuam a produzir descendentes. Como resultado, os tipos de microorganismos que são capazes de sobreviver ao longo do tempo com o ataque contínuo de certos agentes antimicrobianos se tornarão naturalmente mais prevalentes no meio ambiente, e aqueles sem essa resistência se tornarão obsoletos.
Algumas resistências a antibióticos contemporâneas também evoluíram naturalmente antes do uso de antibióticos ou do uso clínico humano dos respectivos antimicrobianos. Por exemplo, a resistência à meticilina evoluiu em um patógeno de ouriços, possivelmente como uma adaptação coevolutiva do patógeno a ouriços infectados por um dermatófito que naturalmente produz antibióticos. Além disso, muitos fungos e bactérias do solo são competidores naturais e o antibiótico original Penicilina descoberto por Alexander Fleming perdeu rapidamente a eficácia clínica no tratamento de humanos e, além disso, nenhuma das outras penicilinas naturais (F, K, N, X, O, U1 ou U6) estão atualmente em uso clínico.
Com o tempo, a maioria das cepas de bactérias e infecções presentes serão do tipo resistente ao agente antimicrobiano usado para tratá-las, tornando esse agente agora ineficaz para derrotar a maioria dos micróbios. Com o aumento do uso de agentes antimicrobianos, há uma aceleração desse processo natural.
Automedicação
A automedicação pelos consumidores é definida como "tomar medicamentos por iniciativa própria ou por sugestão de outra pessoa, que não seja um profissional médico certificado", e é tem sido identificada como uma das principais razões para a evolução da resistência antimicrobiana. Em um esforço para controlar sua própria doença, os pacientes seguem o conselho de fontes, às vezes falsas da mídia, amigos e familiares, levando-os a tomar antimicrobianos desnecessariamente ou em excesso. Muitas pessoas recorrem a isso por necessidade, quando o acesso a um médico é racionado ou temporariamente indisponível devido a bloqueios ou fechamentos de cirurgias de GP, ou quando os pacientes têm uma quantidade limitada de tempo ou dinheiro para consultar um médico prescritor ou, especialmente em muitos países em desenvolvimento com populações crescentes, mas uma economia pouco desenvolvida que carece de acesso barato e conveniente a profissionais clínicos. Nessas situações, os governos naturalmente permitem a venda de antimicrobianos como medicamentos de venda livre. Esse maior acesso torna extremamente fácil obter antimicrobianos sem qualquer direcionamento (o que aumentaria a utilidade) ou restrição de tempo e custo e, como resultado, muitos antimicrobianos são tomados incorretamente, levando a cepas microbianas resistentes. Um grande exemplo de um lugar que enfrenta esses desafios é a Índia, onde, no estado de Punjab, 73% da população recorreu ao tratamento de seus pequenos problemas de saúde e doenças crônicas por meio da automedicação.
Dois problemas significativos com a automedicação são a falta de conhecimento do público, em primeiro lugar, os efeitos perigosos de certos antimicrobianos (por exemplo, Ciprofloxacina causando tendinite e ruptura do tendão) e, em segundo lugar, a ampla resistência microbiana. Para determinar o conhecimento do público e as noções preconcebidas sobre resistência a antibióticos, um dos principais tipos de resistência antimicrobiana, foi feita uma triagem de 3.537 artigos publicados na Europa, Ásia e América do Norte. Do total de 55.225 pessoas entrevistadas, 70% já ouviram falar de resistência a antibióticos anteriormente, mas 88% dessas pessoas pensaram que se referia a algum tipo de alteração física no corpo. Com tantas pessoas ao redor do mundo com a capacidade de se automedicar com antibióticos, e uma grande maioria sem saber o que é resistência antimicrobiana, isso torna o aumento da resistência antimicrobiana muito mais provável.
Mau uso clínico
O uso indevido por profissionais de saúde é outra causa que leva ao aumento da resistência antimicrobiana. Estudos feitos pelo CDC mostram que a indicação do tratamento com antibióticos, a escolha do agente utilizado e a duração da terapia foram incorretas em até 50% dos casos estudados. Em outro estudo feito em uma unidade de terapia intensiva de um grande hospital na França, foi demonstrado que 30% a 60% dos antibióticos prescritos eram desnecessários. Esses usos inapropriados de agentes antimicrobianos promovem a evolução da resistência antimicrobiana ao apoiar as bactérias no desenvolvimento de alterações genéticas que levam à resistência.
Em um estudo feito pelo American Journal of Infection Control, com o objetivo de avaliar a saúde dos médicos. atitudes e conhecimentos sobre resistência antimicrobiana em ambientes ambulatoriais, apenas 63% dos entrevistados relataram a resistência a antibióticos como um problema em suas práticas locais, enquanto 23% relataram a prescrição agressiva de antibióticos como necessária para evitar falhas na prestação de cuidados adequados. Isso demonstra como a maioria dos médicos subestima o impacto que seus próprios hábitos de prescrição têm sobre a resistência antimicrobiana como um todo. Também confirma que alguns médicos podem ser excessivamente cautelosos e prescrever antibióticos por razões médicas ou legais, mesmo quando as indicações clínicas para o uso desses medicamentos nem sempre são confirmadas. Isso pode levar ao uso desnecessário de antimicrobianos, um padrão que pode ter piorado durante a pandemia de COVID-19.
Estudos mostraram que equívocos comuns sobre a eficácia e a necessidade de antibióticos para tratar doenças leves comuns contribuem para seu uso excessivo.
Pandemias, desinfetantes e sistemas de saúde
O aumento do uso de antibióticos durante a pandemia de COVID-19 pode exacerbar esse desafio de saúde global. Além disso, as cargas pandêmicas em alguns sistemas de saúde podem contribuir para infecções resistentes a antibióticos. Por outro lado, um estudo sugere que "maior higiene das mãos, diminuição de viagens internacionais e diminuição de procedimentos hospitalares eletivos podem reduzir a seleção e disseminação de patógenos da RAM no curto prazo". Desinfetantes, como em várias formas de uso de desinfetantes para as mãos à base de álcool e lavagem antisséptica das mãos, também podem ter o potencial de aumentar a resistência antimicrobiana. De acordo com um estudo, "O uso extensivo de desinfetantes leva a mutações que induzem resistência antimicrobiana".
Poluição ambiental
Efluentes não tratados de indústrias farmacêuticas, hospitais e clínicas e descarte inadequado de medicamentos não utilizados ou vencidos podem expor micróbios no ambiente a antibióticos e desencadear a evolução da resistência.
Produção de alimentos
Pecuária
A crise de resistência antimicrobiana também se estende à indústria de alimentos, especificamente aos animais produtores de alimentos. Os antibióticos são administrados ao gado para atuar como suplementos de crescimento e uma medida preventiva para diminuir a probabilidade de infecções. Isso resulta na transferência de cepas bacterianas resistentes para os alimentos que os humanos comem, causando transferência potencialmente fatal de doenças. Embora essa prática resulte em melhores rendimentos e produtos cárneos, é um problema importante em termos de prevenção da resistência antimicrobiana. Embora as evidências que ligam o uso de antimicrobianos no gado à resistência antimicrobiana sejam limitadas, o Grupo Consultivo da Organização Mundial da Saúde sobre Vigilância Integrada da Resistência Antimicrobiana recomendou fortemente a redução do uso de antimicrobianos clinicamente importantes no gado. Além disso, o Grupo Consultivo afirmou que tais antimicrobianos devem ser expressamente proibidos tanto para a promoção do crescimento quanto para a prevenção de doenças.
Em um estudo publicado pela Academia Nacional de Ciências mapeando o consumo de antimicrobianos no gado globalmente, foi previsto que nos 228 países estudados haveria um aumento total de 67% no consumo de antibióticos pelo gado até 2030. Em alguns países como Brasil, Rússia, Índia, China e África do Sul, prevê-se um aumento de 99%. Vários países restringiram o uso de antibióticos na pecuária, incluindo Canadá, China, Japão e Estados Unidos. Essas restrições às vezes estão associadas a uma redução da prevalência de resistência antimicrobiana em humanos.
Pesticidas
A maioria dos pesticidas protege as culturas contra insetos e plantas, mas, em alguns casos, pesticidas antimicrobianos são usados para proteger contra vários microrganismos, como bactérias, vírus, fungos, algas e protozoários. O uso excessivo de muitos pesticidas em um esforço para obter um maior rendimento das culturas resultou em muitos desses micróbios desenvolvendo uma tolerância contra esses agentes antimicrobianos. Atualmente, existem mais de 4.000 pesticidas antimicrobianos registrados na EPA e vendidos no mercado, mostrando o uso generalizado desses agentes. Estima-se que para cada refeição que uma pessoa consome, 0,3 g de pesticidas é usado, já que 90% de todo o uso de pesticidas é usado na agricultura. A maioria desses produtos é usada para ajudar na defesa contra a propagação de doenças infecciosas e, com sorte, proteger a saúde pública. Mas, da grande quantidade de pesticidas utilizados, estima-se também que menos de 0,1% desses agentes antimicrobianos realmente atinjam seus alvos. Isso deixa mais de 99% de todos os pesticidas usados disponíveis para contaminar outros recursos. No solo, no ar e na água, esses agentes antimicrobianos são capazes de se espalhar, entrando em contato com mais microrganismos e fazendo com que esses micróbios desenvolvam mecanismos para tolerar e resistir ainda mais aos pesticidas.
Prevenção
Tem havido crescentes apelos públicos para uma ação coletiva global para enfrentar a ameaça, incluindo uma proposta de tratado internacional sobre resistência antimicrobiana. Mais detalhes e atenção ainda são necessários para reconhecer e medir as tendências de resistência em nível internacional; a ideia de um sistema de rastreamento global foi sugerida, mas a implementação ainda não ocorreu. Um sistema dessa natureza forneceria informações sobre áreas de alta resistência, bem como informações necessárias para avaliar programas e outras mudanças feitas para combater ou reverter a resistência a antibióticos.
Duração dos antibióticos
A duração do tratamento com antibióticos deve ser baseada na infecção e outros problemas de saúde que uma pessoa possa ter. Para muitas infecções, uma vez que a pessoa melhorou, há poucas evidências de que a interrupção do tratamento cause mais resistência. Alguns, portanto, acham que parar cedo pode ser razoável em alguns casos. Outras infecções, no entanto, requerem cursos longos, independentemente de a pessoa se sentir melhor.
Monitoramento e mapeamento
Existem vários programas de monitoramento nacionais e internacionais para ameaças resistentes a medicamentos, incluindo Staphylococcus aureus resistente à meticilina (MRSA), S. aureus resistente à vancomicina (VRSA), beta-lactamase de espectro estendido (ESBL), Enterococcus resistente à vancomicina (VRE) e Acinetobacter baumannii multirresistente (MRAB).
ResistanceOpen é um mapa global on-line de resistência antimicrobiana desenvolvido pela HealthMap que exibe dados agregados sobre resistência antimicrobiana a partir de dados publicamente disponíveis e dados enviados por usuários. O site pode exibir dados em um raio de 25 milhas (40 km) de um local. Os usuários podem enviar dados de antibiogramas para hospitais ou laboratórios individuais. Os dados europeus são da EARS-Net (Rede Europeia de Vigilância da Resistência Antimicrobiana), parte do ECDC.
ResistanceMap é um site do Center for Disease Dynamics, Economics & Política e fornece dados sobre resistência antimicrobiana em nível global.
Limitar o uso de antibióticos
Os programas de administração de antibióticos parecem ser úteis na redução das taxas de resistência a antibióticos. O programa de administração de antibióticos também fornecerá aos farmacêuticos o conhecimento para educar os pacientes de que os antibióticos não funcionarão para um vírus.
O uso excessivo de antibióticos tornou-se um dos principais contribuintes para a evolução da resistência aos antibióticos. Desde o início da era dos antibióticos, os antibióticos têm sido usados para tratar uma ampla gama de doenças. O uso excessivo de antibióticos tornou-se a principal causa do aumento dos níveis de resistência aos antibióticos. O principal problema é que os médicos estão dispostos a prescrever antibióticos para indivíduos mal informados que acreditam que os antibióticos podem curar quase todas as doenças, incluindo infecções virais como o resfriado comum. Em uma análise das prescrições de medicamentos, 36% dos indivíduos com resfriado ou infecção respiratória superior (ambas de origem viral) receberam prescrições de antibióticos. Essas prescrições não conseguiram nada além de aumentar o risco de evolução de bactérias resistentes a antibióticos. O uso de antibióticos sem prescrição é outra força motriz que leva ao uso excessivo de antibióticos para o autotratamento de doenças como resfriado comum, tosse, febre e disenteria, resultando em uma epidemia de resistência a antibióticos em países como Bangladesh, arriscando sua disseminação pelo mundo. A introdução de administração rigorosa de antibióticos no ambiente ambulatorial pode reduzir a resistência bacteriana emergente.
No nível hospitalar
As equipes de gerenciamento de antimicrobianos em hospitais estão incentivando o uso ideal de antimicrobianos. Os objetivos da administração antimicrobiana são ajudar os profissionais a escolher o medicamento certo, na dose certa e na duração certa da terapia, evitando o uso indevido e minimizando o desenvolvimento de resistência. A mordomia pode reduzir o tempo de permanência em uma média de pouco mais de 1 dia, sem aumentar o risco de morte.
No nível da agricultura
Está estabelecido que o uso de antibióticos na pecuária pode dar origem a resistências à RAM em bactérias encontradas em animais de produção aos antibióticos administrados (através de injeções ou rações medicamentosas). Por esta razão, apenas antimicrobianos considerados "não clinicamente relevantes" são usados nessas práticas.
Estudos recentes demonstraram que o uso profilático de medicamentos "não prioritários" ou "não clinicamente relevante" os antimicrobianos nas rações podem potencialmente, sob certas condições, levar à co-seleção de bactérias AMR ambientais com resistência a antibióticos medicamente importantes. A possibilidade de co-seleção de resistências AMR na cadeia alimentar pode ter implicações de longo alcance para a saúde humana.
A nível dos Cuidados de Saúde Primários
Dado o volume de cuidados prestados nos cuidados primários (Clínica Geral), as estratégias recentes centraram-se na redução da prescrição desnecessária de antibióticos neste cenário. Intervenções simples, como informações escritas explicando a futilidade dos antibióticos para infecções comuns, como infecções do trato respiratório superior, demonstraram reduzir a prescrição de antibióticos.
O prescritor deve respeitar rigorosamente os cinco direitos da administração de medicamentos: o paciente certo, o medicamento certo, a dose certa, a via certa e a hora certa.
As culturas devem ser realizadas antes do tratamento quando indicado e o tratamento potencialmente alterado com base no relatório de suscetibilidade.
Cerca de um terço das prescrições de antibióticos feitas em ambulatórios nos Estados Unidos não eram apropriadas em 2010 e 2011. Os médicos nos EUA escreveram 506 receitas anuais de antibióticos para cada 1.000 pessoas, sendo 353 medicamente necessárias.
Profissionais de saúde e farmacêuticos podem ajudar a combater a resistência ao: melhorar a prevenção e controle de infecções; prescrever e dispensar antibióticos apenas quando realmente necessário; prescrever e dispensar o(s) antibiótico(s) certo(s) para tratar a doença.
No nível individual
As pessoas podem ajudar a combater a resistência usando antibióticos somente quando prescritos por um médico; completar a prescrição completa, mesmo que se sinta melhor; nunca compartilhar antibióticos com outras pessoas ou usar sobras de prescrições.
Exemplos de países
- A Holanda tem a menor taxa de prescrição de antibióticos na OCDE, a uma taxa de 11,4 doses diárias definidas (DDD) por 1.000 pessoas por dia em 2011.
- A Alemanha e a Suécia também têm taxas de prescrição mais baixas, com a taxa da Suécia em declínio desde 2007.
- A Grécia, a França e a Bélgica têm taxas de prescrição superiores a 28 DDD.
Água, saneamento, higiene
O controle de doenças infecciosas por meio de infraestrutura melhorada de água, saneamento e higiene (WASH) precisa ser incluído na agenda de resistência antimicrobiana (AMR). O "Grupo de Coordenação Interinstitucional sobre Resistência Antimicrobiana" afirmou em 2018 que "a disseminação de patógenos por meio de água não segura resulta em uma alta carga de doenças gastrointestinais, aumentando ainda mais a necessidade de tratamento com antibióticos." Isso é particularmente um problema nos países em desenvolvimento, onde a disseminação de doenças infecciosas causadas por padrões inadequados de WASH é um dos principais impulsionadores da demanda por antibióticos. O uso crescente de antibióticos, juntamente com níveis persistentes de doenças infecciosas, levou a um ciclo perigoso no qual a dependência de antimicrobianos aumenta enquanto a eficácia dos medicamentos diminui. O uso adequado da infraestrutura de água, saneamento e higiene (WASH) pode resultar em uma redução de 47% a 72% dos casos de diarreia tratados com antibióticos, dependendo do tipo de intervenção e sua eficácia. Uma redução da carga de doenças diarréicas por meio de infraestrutura melhorada resultaria em grandes reduções no número de casos de diarreia tratados com antibióticos. Isso foi estimado variando de 5 milhões no Brasil a até 590 milhões na Índia até o ano de 2030. A forte ligação entre o aumento do consumo e a resistência indica que isso mitigará diretamente a propagação acelerada da RAM. Saneamento e água para todos até 2030 é a meta número 6 dos Objetivos de Desenvolvimento Sustentável.
Um aumento na adesão à lavagem das mãos pela equipe do hospital resulta em taxas reduzidas de organismos resistentes.
A infraestrutura de abastecimento de água e saneamento nas unidades de saúde oferece co-benefícios significativos para o combate à RAM, e o investimento deve ser aumentado. Há muito espaço para melhorias: a OMS e o UNICEF estimaram em 2015 que globalmente 38% das unidades de saúde não tinham fonte de água, quase 19% não tinham banheiros e 35% não tinham água e sabão ou álcool gel para lavar as mãos.
Tratamento de águas residuais industriais
Os fabricantes de antimicrobianos precisam melhorar o tratamento de suas águas residuais (usando processos de tratamento de águas residuais industriais) para reduzir a liberação de resíduos no meio ambiente.
Manejo no uso de animais
Europa
Em 1997, os ministros da saúde da União Européia votaram para proibir a avoparcina e quatro antibióticos adicionais usados para promover o crescimento animal em 1999. Em 2006, a proibição do uso de antibióticos em rações europeias, com exceção de dois antibióticos em rações de aves, tornou-se eficaz. Na Escandinávia, há evidências de que a proibição levou a uma menor prevalência de resistência a antibióticos em populações bacterianas animais (não perigosas). A partir de 2004, vários países europeus estabeleceram um declínio da resistência antimicrobiana em humanos, limitando o uso de antimicrobianos na agricultura e nas indústrias de alimentos sem comprometer a saúde animal ou o custo econômico.
Estados Unidos
O Departamento de Agricultura dos Estados Unidos (USDA) e a Food and Drug Administration (FDA) coletam dados sobre o uso de antibióticos em humanos e de forma mais limitada em animais. O FDA determinou pela primeira vez em 1977 que há evidências de surgimento de cepas bacterianas resistentes a antibióticos no gado. A prática há muito estabelecida de permitir a venda OTC de antibióticos (incluindo penicilina e outras drogas) para leigos proprietários de animais para administração a seus próprios animais, continuou em todos os estados. Em 2000, a FDA anunciou sua intenção de revogar a aprovação do uso de fluoroquinolonas na produção de aves devido a evidências substanciais ligando-o ao surgimento de infecções por Campylobacter resistentes a fluoroquinolonas em humanos. Desafios legais das indústrias de alimentos para animais e farmacêuticas atrasaram a decisão final de fazê-lo até 2006. Fluroquinolonas foram proibidas de uso extra-rótulo em alimentos para animais nos EUA desde 2007. No entanto, elas continuam sendo amplamente utilizadas em animais de companhia e exóticos.
Planos de ação globais e conscientização
A crescente interconexão do mundo e o fato de que novas classes de antibióticos não foram desenvolvidas e aprovadas por mais de 25 anos destacam até que ponto a resistência antimicrobiana é um desafio de saúde global. Um plano de ação global para enfrentar o problema crescente da resistência a antibióticos e outros medicamentos antimicrobianos foi endossado na 68ª Assembleia Mundial da Saúde em maio de 2015. Um dos principais objetivos do plano é melhorar a conscientização e a compreensão da resistência antimicrobiana por meio de comunicação, educação e formação. Este plano de ação global desenvolvido pela Organização Mundial da Saúde foi criado para combater a questão da resistência antimicrobiana e foi orientado pelos conselhos dos países e principais interessados. O plano de ação global da OMS é composto por cinco objetivos principais que podem ser atingidos por diferentes meios e representa países se unindo para resolver um grande problema que pode ter consequências futuras para a saúde. Esses objetivos são os seguintes:
- melhorar a conscientização e compreensão da resistência antimicrobiana através da comunicação eficaz, educação e treinamento.
- fortalecer a base de conhecimento e evidência através da vigilância e pesquisa.
- reduzir a incidência de infecção através de medidas eficazes de saneamento, higiene e prevenção de infecções.
- otimizar o uso de medicamentos antimicrobianos em saúde humana e animal.
- desenvolver o caso econômico para investimento sustentável que leva em conta as necessidades de todos os países e para aumentar o investimento em novos medicamentos, ferramentas de diagnóstico, vacinas e outras intervenções.
Passos para o progresso
- React baseado na Suécia produziu material informativo sobre AMR para o público em geral.
- Os vídeos estão sendo produzidos para o público em geral gerar interesse e consciência.
- O Departamento de Saúde Irlandês publicou um Plano de Ação Nacional sobre Resistência Antimicrobiana em outubro de 2017. A Estratégia para o Controle da Resistência Antimicrobiana na Irlanda (SARI), Iaunched em 2001 desenvolveu diretrizes para a Stewardship Antimicrobiana em hospitais na Irlanda em conjunto com o Centro de Vigilância em Proteção à Saúde, foram publicadas em 2009. Após sua publicação, foi lançada uma campanha de informação pública "Ação sobre Antibióticos" para destacar a necessidade de uma mudança na prescrição de antibióticos. Apesar disso, a prescrição de antibióticos permanece alta com variância na adesão às diretrizes.
Semana de conscientização sobre antibióticos
A Organização Mundial da Saúde promoveu a primeira Semana Mundial de Conscientização sobre Antibióticos, de 16 a 22 de novembro de 2015. O objetivo da semana é aumentar a conscientização global sobre a resistência aos antibióticos. Também deseja promover o uso correto de antibióticos em todos os campos, a fim de evitar novos casos de resistência a antibióticos.
A Semana Mundial de Conscientização sobre Antibióticos é realizada todo mês de novembro desde 2015. Para 2017, a Organização das Nações Unidas para Agricultura e Alimentação (FAO), a Organização Mundial da Saúde (OMS) e a Organização Mundial de Saúde Animal (OIE) estão juntas pedindo o uso responsável de antibióticos em humanos e animais para reduzir o surgimento de resistência a antibióticos.
Nações Unidas
Em 2016, o Secretário-Geral das Nações Unidas convocou o Grupo de Coordenação Interinstitucional (IACG) sobre Resistência Antimicrobiana. O IACG trabalhou com organizações internacionais e especialistas em saúde humana, animal e vegetal para criar um plano para combater a resistência antimicrobiana. Seu relatório divulgado em abril de 2019 destaca a gravidade da resistência antimicrobiana e a ameaça que ela representa para a saúde mundial. Ele sugere cinco recomendações a serem seguidas pelos Estados membros para enfrentar essa ameaça crescente. As recomendações do IACG são as seguintes:
- Acelerar o progresso nos países
- Inovar para garantir o futuro
- Colaborar para uma ação mais eficaz
- Investir para uma resposta sustentável
- Fortalecer a responsabilidade e a governança global
Mecanismos e organismos
Bactérias

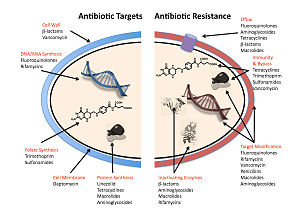
Os cinco principais mecanismos pelos quais as bactérias exibem resistência aos antibióticos são:
- Inativação ou modificação de medicamentos: por exemplo, desativação enzimática da penicilina G em algumas bactérias resistentes à penicilina através da produção de β-lactamases. As drogas também podem ser quimicamente modificadas através da adição de grupos funcionais por enzimas transferase; por exemplo, acetilação, fosforilação ou adenilação são mecanismos comuns de resistência a aminoglicosídeos. A acetilação é o mecanismo mais amplamente utilizado e pode afetar uma série de classes de drogas.
- Alteração do local de destino ou ligação: por exemplo, alteração do PBP - o local de destino de ligação de penicilinas - em MRSA e outras bactérias resistentes à penicilina. Outro mecanismo protetor encontrado entre as espécies bacterianas é as proteínas de proteção ribossômica. Estas proteínas protegem a célula bacteriana de antibióticos que visam os ribossomas da célula para inibir a síntese proteica. O mecanismo envolve a ligação das proteínas de proteção ribossômica aos ribossomas da célula bacteriana, que por sua vez muda sua forma conformacional. Isso permite que os ribossomas continuem a sintetizar proteínas essenciais para a célula, evitando que os antibióticos se liguem ao ribossoma para inibir a síntese proteica.
- Alteração da via metabólica: por exemplo, algumas bactérias resistentes ao sulfonamida não exigem ácido para-aminobenzoico (PABA), um importante precursor para a síntese de ácido fólico e ácidos nucleicos em bactérias inibidas por sulfonamidas, em vez disso, como células mamíferas, eles se voltam a usar ácido fólico pré-formado.
- Reduzido acúmulo de drogas: diminuindo a permeabilidade da droga ou aumentando o efflux ativo (retirando) das drogas em toda a superfície da célula Estas bombas dentro da membrana celular de certas espécies bacterianas são usadas para bombear antibióticos fora da célula antes de serem capazes de fazer qualquer dano. Eles são frequentemente ativados por um substrato específico associado a um antibiótico, como na resistência de fluoroquinolona.
- Dividência e reciclagem de Ribosome: por exemplo, o empate mediado por drogas do ribossoma por lincomicina e eritromicina não obsoleto por uma proteína de choque térmico encontrada em Listeria monocytogenes, que é um homólogo de HflX de outras bactérias. A libertação do ribossoma da droga permite uma maior tradução e consequente resistência à droga.
Existem vários tipos diferentes de germes que desenvolveram resistência ao longo do tempo.
Os seis patógenos que causam mais mortes associadas à resistência são Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii e Pseudomonas aeruginosa. Eles foram responsáveis por 929.000 mortes atribuíveis à resistência e 3,57 milhões de mortes associadas à resistência em 2019.
A Neisseria gonorrhoeae produtora de penicilinase desenvolveu resistência à penicilina em 1976. Outro exemplo é a Neisseria gonorrhoeae resistente à azitromicina, que desenvolveu resistência à azitromicina em 2011.
Nas bactérias gram-negativas, os genes de resistência mediados por plasmídeos produzem proteínas que podem se ligar à DNA girase, protegendo-a da ação das quinolonas. Finalmente, mutações em locais-chave na DNA girase ou topoisomerase IV podem diminuir sua afinidade de ligação às quinolonas, diminuindo a eficácia da droga.
Algumas bactérias são naturalmente resistentes a certos antibióticos; por exemplo, bactérias gram-negativas são resistentes à maioria dos antibióticos β-lactâmicos devido à presença de β-lactamase. A resistência aos antibióticos também pode ser adquirida como resultado de mutação genética ou transferência horizontal de genes. Embora as mutações sejam raras, com mutações espontâneas no genoma do patógeno ocorrendo a uma taxa de cerca de 1 em 105 a 1 em 108 por replicação cromossômica, o fato de as bactérias se reproduzirem em uma taxa alta permite que o efeito seja significativo. Dado que a expectativa de vida e a produção de novas gerações podem ocorrer em uma escala de tempo de apenas algumas horas, uma nova mutação (de novo) em uma célula-mãe pode rapidamente se tornar uma mutação hereditária de prevalência generalizada, resultando na microevolução de uma colônia totalmente resistente. No entanto, as mutações cromossômicas também conferem um custo de adequação. Por exemplo, uma mutação ribossômica pode proteger uma célula bacteriana alterando o local de ligação de um antibiótico, mas pode resultar em taxa de crescimento mais lenta. Além disso, algumas mutações adaptativas podem se propagar não apenas por herança, mas também por transferência horizontal de genes. O mecanismo mais comum de transferência horizontal de genes é a transferência de plasmídeos portadores de genes de resistência a antibióticos entre bactérias da mesma ou de diferentes espécies por meio de conjugação. No entanto, as bactérias também podem adquirir resistência por meio de transformação, como na captação de Streptococcus pneumoniae de fragmentos nus de DNA extracelular que contêm genes de resistência a antibióticos à estreptomicina, por meio de transdução, como na transferência mediada por bacteriófagos de genes de resistência à tetraciclina entre cepas de S. pyogenes, ou através de agentes de transferência de genes, que são partículas produzidas pela célula hospedeira que se assemelham a estruturas de bacteriófagos e são capazes de transferir DNA.
A resistência aos antibióticos pode ser introduzida artificialmente em um microrganismo por meio de protocolos de laboratório, às vezes usados como um marcador selecionável para examinar os mecanismos de transferência de genes ou para identificar indivíduos que absorveram um pedaço de DNA que incluía o gene de resistência e outro gene de interesse.
Descobertas recentes mostram que não há necessidade de grandes populações de bactérias para o aparecimento de resistência a antibióticos. Pequenas populações de Escherichia coli em um gradiente de antibióticos podem se tornar resistentes. Qualquer ambiente heterogêneo em relação aos gradientes de nutrientes e antibióticos pode facilitar a resistência a antibióticos em pequenas populações bacterianas. Os pesquisadores levantam a hipótese de que o mecanismo de evolução da resistência é baseado em quatro mutações SNP no genoma de E. coli produzido pelo gradiente de antibiótico.
Em um estudo, que tem implicações para a microbiologia espacial, uma cepa não patogênica E. coli MG1655 foi exposta a níveis de traços do antibiótico de amplo espectro cloranfenicol, sob microgravidade simulada (LSMMG, ou Low Shear Modeled Microgravity) ao longo de 1000 gerações. A cepa adaptada adquiriu resistência não apenas ao cloranfenicol, mas também resistência cruzada a outros antibióticos; isso contrastava com a observação da mesma cepa, que foi adaptada a mais de 1.000 gerações sob LSMMG, mas sem nenhuma exposição a antibióticos; a deformação neste caso não adquiriu tal resistência. Assim, independentemente de onde são usados, o uso de um antibiótico provavelmente resultaria em resistência persistente a esse antibiótico, bem como resistência cruzada a outros antimicrobianos.
Nos últimos anos, o surgimento e disseminação de β-lactamases chamadas carbapenemases tornou-se uma grande crise de saúde. Uma dessas carbapenemases é a New Delhi metalo-beta-lactamase 1 (NDM-1), uma enzima que torna as bactérias resistentes a uma ampla gama de antibióticos beta-lactâmicos. As bactérias mais comuns que produzem essa enzima são gram-negativas, como E. coli e Klebsiella pneumoniae, mas o gene para NDM-1 pode se espalhar de uma cepa de bactéria para outra por transferência horizontal de genes.
Vírus
Drogas antivirais específicas são usadas para tratar algumas infecções virais. Essas drogas impedem que os vírus se reproduzam inibindo estágios essenciais do ciclo de replicação do vírus nas células infectadas. Antivirais são usados para tratar HIV, hepatite B, hepatite C, influenza, vírus do herpes, incluindo vírus varicela zoster, citomegalovírus e vírus Epstein-Barr. Com cada vírus, algumas cepas se tornaram resistentes aos medicamentos administrados.
As drogas antivirais normalmente têm como alvo os principais componentes da reprodução viral; por exemplo, o oseltamivir tem como alvo a neuraminidase do influenza, enquanto os análogos da guanosina inibem a DNA polimerase viral. A resistência aos antivirais é, portanto, adquirida por meio de mutações nos genes que codificam as proteínas-alvo das drogas.
A resistência aos antivirais do HIV é problemática e até mesmo cepas multirresistentes evoluíram. Uma fonte de resistência é que muitos medicamentos atuais para o HIV, incluindo NRTIs e NNRTIs, têm como alvo a transcriptase reversa; no entanto, a transcriptase reversa do HIV-1 é altamente propensa a erros e, portanto, as mutações que conferem resistência surgem rapidamente. Cepas resistentes do vírus HIV surgem rapidamente se apenas um medicamento antiviral for usado. O uso de três ou mais medicamentos juntos, denominado terapia de combinação, ajudou a controlar esse problema, mas novos medicamentos são necessários devido ao surgimento contínuo de cepas de HIV resistentes a medicamentos.
Fungos
As infecções por fungos são causa de alta morbidade e mortalidade em pessoas imunocomprometidas, como HIV/AIDS, tuberculose ou quimioterapia. Os fungos Candida, Cryptococcus neoformans e Aspergillus fumigatus causam a maioria dessas infecções e a resistência antifúngica ocorre em todas elas. A resistência a múltiplas drogas em fungos está aumentando devido ao uso generalizado de drogas antifúngicas para tratar infecções em indivíduos imunocomprometidos.
É importante observar que as espécies Candida resistentes ao fluconazol foram destacadas como um problema crescente pelo CDC. Mais de 20 espécies de Candida podem causar infecção por candidíase, sendo a mais comum a Candida albicans. As leveduras Candida normalmente habitam a pele e as membranas mucosas sem causar infecção. No entanto, o crescimento excessivo de Candida pode levar à candidíase. Algumas cepas de Candida estão se tornando resistentes a agentes antifúngicos de primeira e segunda linha, como azóis e equinocandinas.
Parasitas
Os parasitas protozoários que causam as doenças malária, tripanossomíase, toxoplasmose, criptosporidiose e leishmaniose são importantes patógenos humanos.
Os parasitas da malária que são resistentes aos medicamentos atualmente disponíveis para infecções são comuns e isso levou a um aumento dos esforços para desenvolver novos medicamentos. Também foi relatada resistência a drogas recentemente desenvolvidas, como a artemisinina. O problema da resistência aos medicamentos na malária tem impulsionado esforços para desenvolver vacinas.
Os tripanossomas são protozoários parasitas que causam a tripanossomíase africana e a doença de Chagas (tripanossomíase americana). Não há vacinas para prevenir essas infecções, então drogas como pentamidina e suramina, benznidazol e nifurtimox são usadas para tratar infecções. Essas drogas são eficazes, mas infecções causadas por parasitas resistentes foram relatadas.
A leishmaniose é causada por protozoários e é um importante problema de saúde pública em todo o mundo, especialmente em países subtropicais e tropicais. A resistência aos medicamentos "tornou-se uma grande preocupação".
Dados globais e genômicos
Em 2022, epidemiologistas genômicos relataram resultados de uma pesquisa global de resistência antimicrobiana por meio de epidemiologia genômica baseada em águas residuais, encontrando grandes variações regionais, fornecendo mapas e sugerindo que genes de resistência também são transmitidos entre espécies microbianas que não estão intimamente relacionadas. A OMS fornece os relatórios do Sistema Global de Vigilância de Resistência e Uso de Antimicrobianos (GLASS) que resumem dados anuais (por exemplo, 2020) sobre RAM internacional, incluindo também um painel interativo.
História
As décadas de 1950 a 1970 representaram a idade de ouro da descoberta de antibióticos, onde inúmeras novas classes de antibióticos foram descobertas para tratar doenças anteriormente incuráveis, como tuberculose e sífilis. No entanto, desde então, a descoberta de novas classes de antibióticos tem sido quase inexistente, e representa uma situação especialmente problemática considerando a resiliência das bactérias demonstrada ao longo do tempo e o contínuo uso indevido e excessivo de antibióticos no tratamento.
O fenômeno da resistência antimicrobiana causada pelo uso excessivo de antibióticos foi previsto já em 1945 por Alexander Fleming, que disse "Chegará o momento em que a penicilina poderá ser comprada por qualquer pessoa nas lojas. Depois, há o perigo de que o homem ignorante possa facilmente tomar uma dose insuficiente e, ao expor seus micróbios a quantidades não letais da droga, torná-los resistentes." Sem a criação de antibióticos novos e mais fortes, uma era em que infecções comuns e ferimentos leves podem matar e procedimentos complexos, como cirurgia e quimioterapia, tornam-se muito arriscados, é uma possibilidade muito real. A resistência antimicrobiana pode levar a epidemias de enormes proporções se ações preventivas não forem tomadas. Nos dias de hoje, a resistência antimicrobiana atual leva a internações hospitalares mais longas, custos médicos mais altos e aumento da mortalidade.
Sociedade e cultura
Desde meados da década de 1980, as empresas farmacêuticas têm investido em medicamentos para câncer ou doenças crônicas que têm maior potencial de gerar receita e "desenfatizaram ou abandonaram o desenvolvimento de antibióticos". Em 20 de janeiro de 2016, no Fórum Econômico Mundial em Davos, na Suíça, mais de "80 empresas farmacêuticas e de diagnóstico" de todo o mundo clamaram por "modelos comerciais transformacionais" em nível global para estimular a pesquisa e o desenvolvimento de antibióticos e no "uso aprimorado de testes de diagnóstico que podem identificar rapidamente o organismo infectante".
Estruturas legais
Alguns estudiosos da saúde global argumentaram que uma estrutura legal global é necessária para prevenir e controlar a resistência antimicrobiana. Por exemplo, políticas globais obrigatórias poderiam ser usadas para criar padrões de uso de antimicrobianos, regular a comercialização de antibióticos e fortalecer os sistemas de vigilância global. Garantir a conformidade das partes envolvidas é um desafio. As políticas globais de resistência antimicrobiana podem aprender com o setor ambiental, adotando estratégias que tornaram os acordos ambientais internacionais bem-sucedidos no passado, como: sanções por não conformidade, assistência para implementação, regras de decisão por maioria de votos, um painel científico independente e compromissos específicos.
Estados Unidos
Para o orçamento dos Estados Unidos de 2016, o presidente dos EUA, Barack Obama, propôs quase dobrar o valor do financiamento federal para "combater e prevenir" resistência a antibióticos para mais de US$ 1,2 bilhão. Muitas agências internacionais de financiamento como USAID, DFID, SIDA e Bill & A Melinda Gates Foundation prometeu dinheiro para desenvolver estratégias para combater a resistência antimicrobiana.
Em 27 de março de 2015, a Casa Branca divulgou um plano abrangente para atender à crescente necessidade de agências para combater o aumento de bactérias resistentes a antibióticos. A Força-Tarefa para Combater Bactérias Resistentes a Antibióticos desenvolveu Plano de Ação Nacional para Combater Bactérias Resistentes a Antibióticos com a intenção de fornecer um roteiro para orientar os EUA no desafio da resistência a antibióticos e com a esperança de salvar muitas vidas. Este plano descreve as medidas tomadas pelo governo federal nos próximos cinco anos necessárias para prevenir e conter surtos de infecções resistentes a antibióticos; manter a eficácia dos antibióticos já existentes no mercado; e para ajudar a desenvolver futuros diagnósticos, antibióticos e vacinas.
O Plano de Ação foi desenvolvido em torno de cinco objetivos com foco no fortalecimento dos cuidados de saúde, medicina veterinária de saúde pública, agricultura, segurança alimentar e pesquisa e manufatura. Esses objetivos, listados pela Casa Branca, são os seguintes:
- Abranda a Emergência de Bacterias Resistentes e Impeda a propagação de Infecções Resistentes
- Fortalecer os esforços nacionais de vigilância de uma saúde para combater a resistência
- Desenvolvimento e uso de testes diagnósticos rápidos e inovadores para identificação e caracterização de bactérias resistentes
- Acelere Pesquisa e Desenvolvimento Básico e Aplicado para Novos Antibióticos, Outros Terapêuticos e Vacinas
- Melhorar a colaboração internacional e as capacidades para prevenção de resistência antibiótica, vigilância, controle e pesquisa e desenvolvimento antibiótico
A seguir estão as metas definidas para atingir até 2020:
- Estabelecimento de programas antimicrobianos em ambientes hospitalares de cuidados agudos
- Redução da prescrição antibiótica inapropriada e uso pelo menos 50% em ambientes ambulatoriais e 20% em ambientes ambulatoriais
- Estabelecimento de Programas de Prevenção de Resistência Antibiótica do Estado em todos os 50 estados
- Eliminação do uso de antibióticos medicamente importantes para a promoção do crescimento em animais produtores de alimentos.
Reino Unido
A Public Health England informou que o número total de infecções resistentes a antibióticos na Inglaterra aumentou 9%, de 55.812 em 2017 para 60.788 em 2018, mas o consumo de antibióticos caiu 9%, de 20,0 para 18,2 doses diárias definidas por 1.000 habitantes por dia entre 2014 e 2018.
Políticas
De acordo com a Organização Mundial da Saúde, os formuladores de políticas podem ajudar a combater a resistência fortalecendo o rastreamento da resistência e a capacidade laboratorial e regulamentando e promovendo o uso adequado de medicamentos. Os formuladores de políticas e a indústria podem ajudar a combater a resistência ao: promover a inovação, a pesquisa e o desenvolvimento de novas ferramentas; e promover a cooperação e compartilhamento de informações entre todas as partes interessadas.
Mais pesquisas
Teste viral rápido
A investigação clínica para descartar infecções bacterianas é frequentemente realizada em pacientes com infecções respiratórias agudas pediátricas. Atualmente não está claro se o teste viral rápido afeta o uso de antibióticos em crianças.
Vacinas
Os microrganismos geralmente não desenvolvem resistência às vacinas porque as vacinas reduzem a disseminação da infecção e atingem o patógeno de várias maneiras no mesmo hospedeiro e possivelmente de maneiras diferentes entre diferentes hospedeiros. Além disso, se o uso de vacinas aumentar, há evidências de que as cepas de patógenos resistentes a antibióticos diminuirão; a necessidade de antibióticos diminuirá naturalmente, pois as vacinas previnem a infecção antes que ela ocorra. No entanto, existem casos bem documentados de resistência a vacinas, embora geralmente sejam muito menos problemáticos do que a resistência antimicrobiana.
Embora teoricamente promissoras, as vacinas antiestafilocócicas mostraram eficácia limitada, devido à variação imunológica entre as espécies de Staphylococcus e à duração limitada da eficácia dos anticorpos produzidos. O desenvolvimento e o teste de vacinas mais eficazes estão em andamento.
Dois ensaios de registro avaliaram candidatos a vacinas em estratégias de imunização ativa contra S. aureus infecção. Em um ensaio de fase II, uma vacina bivalente de proteínas capsulares 5 & 8 foi testado em 1.804 pacientes em hemodiálise com fístula primária ou acesso vascular com enxerto sintético. Após 40 semanas após a vacinação, um efeito protetor foi observado contra S. aureus bacteremia, mas não 54 semanas após a vacinação. Com base nesses resultados, foi realizado um segundo ensaio que não demonstrou eficácia.
A Merck testou a V710, uma vacina direcionada ao IsdB, em um estudo randomizado cego em pacientes submetidos à esternotomia mediana. O estudo foi encerrado depois que uma taxa mais alta de mortes relacionadas à falência de múltiplos órgãos foi encontrada nos receptores V710. Receptores de vacinas que desenvolveram S. aureus foram cinco vezes mais propensos a morrer do que os receptores de controle que desenvolveram S. aureus infecção.
Vários investigadores sugeriram que uma vacina de múltiplos antígenos seria mais eficaz, mas a falta de biomarcadores que definam a imunidade protetora humana mantém essas propostas na arena lógica, mas estritamente hipotética.
Terapia alternativa
A terapia alternada é um método proposto no qual dois ou três antibióticos são tomados em uma rotação em vez de tomar apenas um antibiótico, de modo que as bactérias resistentes a um antibiótico sejam mortas quando o próximo antibiótico for tomado. Estudos descobriram que esse método reduz a taxa na qual bactérias resistentes a antibióticos surgem in vitro em relação a uma única droga durante toda a duração.
Estudos descobriram que bactérias que desenvolvem resistência a antibióticos para um grupo de antibióticos podem se tornar mais sensíveis a outros. Esse fenômeno pode ser usado para selecionar contra bactérias resistentes usando uma abordagem denominada ciclagem de sensibilidade colateral, que recentemente foi considerada relevante no desenvolvimento de estratégias de tratamento para infecções crônicas causadas por Pseudomonas aeruginosa. Apesar de sua promessa, estudos clínicos e experimentais em larga escala revelaram evidências limitadas de suscetibilidade à ciclagem de antibióticos em vários patógenos.
Desenvolvimento de novos medicamentos
Desde a descoberta dos antibióticos, os esforços de pesquisa e desenvolvimento (P&D) forneceram novos medicamentos a tempo de tratar bactérias que se tornaram resistentes a antibióticos mais antigos, mas nos anos 2000 houve a preocupação de que o desenvolvimento tenha diminuído o suficiente para que doenças graves as pessoas podem ficar sem opções de tratamento. Outra preocupação é que os médicos podem ficar relutantes em realizar cirurgias de rotina devido ao aumento do risco de infecção prejudicial. Tratamentos de apoio podem ter sérios efeitos colaterais; por exemplo, antibióticos como aminoglicosídeos (como amicacina, gentamicina, canamicina, estreptomicina, etc.) usados para o tratamento de tuberculose resistente a medicamentos e fibrose cística podem causar distúrbios respiratórios, surdez e insuficiência renal. A crise potencial em mãos é o resultado de uma queda acentuada na pesquisa e desenvolvimento da indústria. O fraco investimento financeiro na pesquisa de antibióticos exacerbou a situação. A indústria farmacêutica tem pouco incentivo para investir em antibióticos por causa do alto risco e porque os retornos financeiros potenciais são menos prováveis de cobrir o custo de desenvolvimento do que para outros produtos farmacêuticos. Em 2011, a Pfizer, uma das últimas grandes empresas farmacêuticas desenvolvendo novos antibióticos, encerrou seu principal esforço de pesquisa, citando retornos fracos para os acionistas em relação a medicamentos para doenças crônicas. No entanto, pequenas e médias empresas farmacêuticas ainda estão ativas na pesquisa de medicamentos antibióticos. Em particular, além das metodologias clássicas de química sintética, os pesquisadores desenvolveram uma plataforma de biologia sintética combinatória em nível de célula única em uma triagem de alto rendimento para diversificar novos lantipeptídeos.
Nos Estados Unidos, as empresas farmacêuticas e o governo do presidente Barack Obama propuseram mudanças nos padrões pelos quais o FDA aprova antibióticos direcionados a organismos resistentes.
Em 18 de setembro de 2014, Obama assinou uma ordem executiva para implementar as recomendações propostas em um relatório do Conselho de Assessores em Ciência e Tecnologia do Presidente (PCAST), que descreve estratégias para agilizar os ensaios clínicos e acelerar o P&D de novos antibióticos. Entre as propostas:
- Criar uma "rede de ensaios clínicos nacionais permanentes para testes antibióticos" que irá prontamente inscrever pacientes uma vez identificados para ter infecções bacterianas perigosas. A rede permitirá testar vários novos agentes de diferentes empresas simultaneamente para sua segurança e eficácia.
- Estabeleça uma via de uso médico especial (SMU) para a FDA aprovar novos agentes antimicrobianos para uso em populações de pacientes limitados, encurtar a linha de tempo de aprovação para novos medicamentos para que os pacientes com infecções graves possam se beneficiar o mais rápido possível.
- Fornecer incentivos econômicos, especialmente para o desenvolvimento de novas classes de antibióticos, para compensar os custos de R&D íngremes que afastam a indústria para desenvolver antibióticos.
Os cientistas começaram a usar abordagens computacionais avançadas com supercomputadores para o desenvolvimento de novos derivados de antibióticos para lidar com a resistência antimicrobiana.
Biomateriais
O uso de alternativas livres de antibióticos no tratamento de infecções ósseas pode ajudar a diminuir o uso de antibióticos e, portanto, a resistência antimicrobiana. O material de regeneração óssea vidro bioativo S53P4 demonstrou inibir efetivamente o crescimento bacteriano de até 50 bactérias clinicamente relevantes, incluindo MRSA e MRSE.
Nanomateriais
Durante as últimas décadas, os nanomateriais de cobre e prata demonstraram características atraentes para o desenvolvimento de uma nova família de agentes antimicrobianos.
Redescoberta de tratamentos antigos
Semelhante à situação na terapia da malária, onde foram encontrados tratamentos bem-sucedidos baseados em receitas antigas, já houve algum sucesso na descoberta e teste de medicamentos antigos e outros tratamentos eficazes contra bactérias AMR.
Diagnóstico rápido
Distinguir infecções que requerem antibióticos de infecções autolimitadas é clinicamente desafiador. A fim de orientar o uso adequado de antibióticos e prevenir a evolução e disseminação da resistência antimicrobiana, são necessários testes de diagnóstico que forneçam aos médicos resultados acionáveis em tempo hábil.
A doença febril aguda é uma razão comum para procurar atendimento médico em todo o mundo e uma das principais causas de morbidade e mortalidade. Em áreas com incidência decrescente de malária, muitos pacientes febris são tratados inadequadamente para malária e, na ausência de um teste diagnóstico simples para identificar causas alternativas de febre, os médicos presumem que uma doença febril não malárica é provavelmente uma infecção bacteriana, levando a uso inadequado de antibióticos. Vários estudos mostraram que o uso de testes de diagnóstico rápido da malária sem ferramentas confiáveis para distinguir outras causas de febre resultou no aumento do uso de antibióticos.
O teste de suscetibilidade antimicrobiana (AST) pode ajudar os médicos a evitar a prescrição de antibióticos desnecessários no estilo da medicina de precisão e ajudá-los a prescrever antibióticos eficazes, mas com a abordagem tradicional pode levar de 12 a 48 horas. O teste rápido, possível a partir de inovações em diagnóstico molecular, é definido como "sendo viável em um turno de trabalho de 8 horas". O progresso tem sido lento devido a uma série de razões, incluindo custo e regulamentação.
Técnicas ópticas, como microscopia de contraste de fase em combinação com análise de célula única, são outro método poderoso para monitorar o crescimento bacteriano. Em 2017, cientistas da Suécia publicaram um método que aplica princípios de microfluídica e rastreamento celular para monitorar a resposta bacteriana a antibióticos em menos de 30 minutos de tempo total de manipulação. Recentemente, essa plataforma foi avançada acoplando chip microfluídico com pinça óptica para isolar bactérias com fenótipo alterado diretamente da matriz analítica.
Fagoterapia
A terapia fágica é o uso terapêutico de bacteriófagos para tratar infecções bacterianas patogênicas. A terapia fágica tem muitas aplicações potenciais na medicina humana, bem como na odontologia, na ciência veterinária e na agricultura.
A terapia fágica se baseia no uso de bacteriófagos de ocorrência natural para infectar e lisar bactérias no local da infecção em um hospedeiro. Devido aos avanços atuais em genética e biotecnologia, esses bacteriófagos podem possivelmente ser fabricados para tratar infecções específicas. Os fagos podem ser modificados por bioengenharia para atingir infecções bacterianas multirresistentes, e seu uso envolve o benefício adicional de impedir a eliminação de bactérias benéficas no corpo humano. Os fagos destroem as paredes e membranas das células bacterianas através do uso de proteínas líticas que matam as bactérias fazendo muitos buracos de dentro para fora. Os bacteriófagos podem até possuir a capacidade de digerir o biofilme que muitas bactérias desenvolvem que as protegem dos antibióticos para efetivamente infectar e matar as bactérias. A bioengenharia pode desempenhar um papel na criação de bacteriófagos bem-sucedidos.
Entender as interações mútuas e evoluções das populações de bactérias e fagos no ambiente de um corpo humano ou animal é essencial para a terapia fágica racional.
Os bacteriófagos são usados contra bactérias resistentes a antibióticos na Geórgia (Instituto George Eliava) e em um instituto em Wrocław, Polônia. Coquetéis de bacteriófagos são medicamentos comuns vendidos sem receita em farmácias nos países orientais. Na Bélgica, quatro pacientes com infecções musculoesqueléticas graves receberam terapia bacteriófaga com antibióticos concomitantes. Após um único curso de terapia fágica, não ocorreu recorrência da infecção e nenhum efeito colateral grave relacionado à terapia foi detectado.
Contenido relacionado
Urso
Botânica
Encefalomielite disseminada aguda