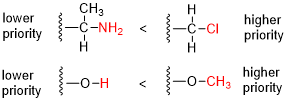Regras de prioridade Cahn–Ingold–Prelog
Na química orgânica, o Cahn -ingold - pré -bloco ( cip ) B>; nomeado R.S. Cahn, C.K. Ingold e Vladimir Prelog) são um processo padrão para nomear completamente e inequivocamente um estereoisômero de uma molécula. O objetivo do sistema CIP é atribuir um descritor R ou S a cada estereocentro e um descritor E ou Z a cada ligação dupla, para que a configuração de toda a molécula possa ser especificada exclusivamente, incluindo os descritores em seu nome sistemático. Uma molécula pode conter qualquer número de estereocentros e qualquer número de ligações duplas, e cada uma geralmente gera dois isômeros possíveis. Uma molécula com um número inteiro n descrevendo o número de estereocentros geralmente terá 2 n Estereoisomers, e 2 n −1 diatereômeros cada tendo um par de enantiômeros associados. As regras de sequência CIP contribuem para a nomeação precisa de todos os estereoisômeros de todas as moléculas orgânicas com todos os átomos de ligancina de menos de 4 (mas incluindo a ligância de 6, também esse termo referente ao número de átomos vizinhos " ligado a um centro).
O artigo -chave que estabelece as regras da sequência CIP foi publicado em 1966 e foi seguido por refinamentos adicionais, antes de ser incorporada às regras da União Internacional da Química Pura e Aplicada (IUPAC), o órgão oficial que define orgânico Nomenclatura, em 1974. As regras foram revisadas, mais recentemente em 2013, como parte da nomenclatura do livro da IUPAC de química orgânica. A apresentação da IUPAC das regras constitui o padrão oficial e formal para o seu uso, e observa que " o método foi desenvolvido para cobrir todos os compostos com ligancia até 4... e… [estendido ao caso de] Ligância 6… [assim como] para todas as configurações e conformações de tais compostos. " No entanto, embora a documentação da IUPAC apresente uma introdução completa, inclui a cautela de que " é essencial estudar os artigos originais, especialmente o artigo de 1966, antes de usar a regra de sequência para outros casos razoavelmente simples. "
Um artigo recente defende alterações em algumas das regras (regras de sequência 1b e 2) para abordar certas moléculas para as quais os descritores corretos não estavam claros. No entanto, permanece um problema diferente: em casos raros, dois estereoisômeros diferentes da mesma molécula podem ter os mesmos descritores de CIP; portanto, o sistema CIP pode não ser capaz de nomear inequivocamente um estereoisômero, e outros sistemas podem ser preferíveis.
Etapas para nomear
As etapas para nomear moléculas usando o sistema CIP são frequentemente apresentadas como:
- Identificação de estereocentros e ligações duplas;
- Atribuição de prioridades para os grupos ligados a cada átomo estereocentro ou duplo-aderente; e
- Atribuição de R/S e E/Z. descritores.
Atribuição de prioridades
Os descritores R/S e E/Z são atribuídos usando um sistema de classificação de prioridade dos grupos ligados a cada estereocentro. Este procedimento, geralmente conhecido como regras de sequência, é o coração do sistema CIP. A visão geral nesta seção omite algumas regras que são necessárias apenas em casos raros.
- Comparar o número atômico (Z.) dos átomos diretamente ligados ao estereocentro; o grupo com o átomo de maior número atômico Z recebe maior prioridade (isto é, número 1).
- Se houver um empate, os átomos à distância 2 do estereocentro devem ser considerados: uma lista é feita para cada grupo de átomos adicionais ligados ao que diretamente ligado ao estereocentro. Cada lista é organizada para diminuir o número atômico Z. Em seguida, as listas são comparadas por átomo; na primeira diferença, o grupo contendo o átomo de maior número atômico Z recebe maior prioridade.
- Se ainda houver um empate, cada átomo em cada uma das duas listas é substituído por uma sublista dos outros átomos ligados a ele (à distância 3 do estereocentro), as sublistas são dispostas em ordem decrescente do número atômico Z, e toda a estrutura é novamente comparada átomo por átomo. Este processo é repetido recursivamente, cada vez com átomos uma ligação mais distante do estereocentro, até que a gravata é quebrada.
isótopos
Se dois grupos diferem apenas nos isótopos, a maior massa atômica é usada para definir a prioridade.
ligações duplas e triplas
Se um átomo, a, for duplo para outro átomo, o átomo A deve ser tratado como se estivesse conectado ao mesmo átomo duas vezes " Um átomo que é duplo tem uma prioridade mais alta do que um átomo que é unido. Ao lidar com grupos prioritários de dupla ligação, você pode visitar o mesmo átomo duas vezes em que cria um arco.
Quando B é substituído por uma lista de átomos anexados, um próprio, mas não o seu " Phantom ", é excluído de acordo com o princípio geral de não dobrar de volta ao longo de um vínculo que acabou de ser seguido. Uma ligação tripla é tratada da mesma maneira, exceto que A e B estão conectados a dois átomos fantasmas do outro.
Isômeros geométricos
Se dois substituintes em um átomo são isômeros geométricos um do outro, o z -isomer tem maior prioridade que o e -isomer. Um estereoisômer que contém dois grupos prioritários mais altos na mesma face da ligação dupla ( cis) é classificada como " Z. " O estereoisômer com dois grupos prioritários mais altos em lados opostos de uma ligação dupla carbono carbono ( trans ) é classificada como " e. "
Moléculas cíclicas
Para manusear uma molécula contendo um ou mais ciclos, é preciso primeiro expandi -la para uma árvore (chamada de digerph hierárquica ) atravessando as ligações em todos os caminhos possíveis que começam no estereocentro. Quando a travessia encontra um átomo através do qual o caminho atual já passou, um átomo fantasma é gerado para manter a árvore finita. Um único átomo da molécula original pode aparecer em muitos lugares (alguns como fantasmas, outros não) na árvore.
Atribuindo descritores
Estereocentros: r/s
Um isômero hibridizado sp3 quiral contém quatro substituintes diferentes. Todos os quatro substituintes são atribuídos prorites com base em seus números atômicos. Depois que os substituintes de um estereocentro tiverem suas prioridades atribuídas, a molécula é orientada no espaço de modo que o grupo com a menor prioridade seja apontado para longe do observador. Se os substituintes forem numerados de 1 (maior prioridade) a 4 (menor prioridade), então o sentido de rotação de uma curva passando por 1, 2 e 3 distingue os estereoisômeros. Em um isômero configuracional, o grupo de prioridade mais baixa (na maioria das vezes hidrogênio) está posicionado atrás do plano ou da ligação hachurada que se afasta de você. O grupo de maior prioridade terá um arco traçado conectando-se aos demais grupos, terminando no grupo de terceira prioridade. Um arco desenhado no sentido horário tem a atribuição de reto (R). Um arco desenhado no sentido anti-horário tem a designação sinistra (S). Ao nomear um isômero orgânico, a abreviação de rectus ou sinister é colocada na frente do nome entre parênteses. Por exemplo, 3-metil-1-penteno com uma atribuição rectus é formatado como (R) 3-metil-1-penteno. Os nomes são derivados do latim para 'direito' e 'esquerda', respectivamente.
Um método prático de determinar se um enantiômero é r ou s é usando a regra da direita: um envolve a molécula com os dedos na direção 1 → 2 → 3 . Se o polegar apontar na direção do quarto substituinte, o enantiômero é r ; Caso contrário, é s .
É possível em casos raros que dois substituintes em um átomo diferem apenas em sua configuração absoluta ( r ou s ). Se as prioridades relativas desses substituintes precisarem ser estabelecidas, r terá prioridade sobre s . Quando isso acontece, o descritor do estereocentro é uma letra minúscula ( r ou s ) em vez da letra da maçaneta normalmente usada.
Bonds duplos: E/Z
Para moléculas unidas duplas, as regras de prioridade de Cahn -Ingold -PRELOG (Regras CIP) são seguidas para determinar a prioridade dos substituintes da ligação dupla. Se os dois grupos de alta prioridade estiverem do mesmo lado da ligação dupla (configuração cis), o estereoisômer recebe a configuração z ( zusammen, palavra alemã Significado & #34; juntos "). Se os grupos de alta prioridade estiverem em lados opostos da ligação dupla (configuração trans), o estereoisômer recebe a configuração e ( entgegen , palavra alemã Significado " oposição ")
Compostos de coordenação
Em alguns casos em que os centros estereogênicos são formados, a configuração deve ser especificada. Sem a presença de uma interação não covalente, um composto é achiral. Alguns profissionais propuseram uma nova regra para explicar isso. Esta regra afirma que as interações não covalentes têm um número fictício entre 0 e 1 " Ao atribuir prioridade. Os compostos nos quais isso ocorre são chamados de compostos de coordenação.
spiro compostos
As estruturas de Spiro contêm moléculas quirais sem o centro assimétrico. Os anéis de uma estrutura spiro estão em ângulos retos um com o outro. É importante notar que as imagens espelhadas das estruturas spiro não são superimpostas e são enantiômeros.isomerismo óptico
Isômeros ópticos são compostos com quatro substituintes diferentes ligados a um carbono central. Os isômeros ópticos desempenham um papel significativo na atividade biológica. Os isômeros ópticos têm a capacidade de girar o plano polarizado no sentido horário (R) ou no sentido anti-horário (s). Quando os isômeros ópticos criam dois enantiômeros, um gira no sentido horário enquanto o outro gira no sentido anti -horário. Uma mistura dos dois isômeros, no entanto, não girará a luz polarizada plana. Esses dois isômeros podem ser idênticos quimicamente, mas são indistinguíveis.
Exemplos
Os seguintes são exemplos de aplicação da nomenclatura.
R/S atribuições para vários compostos A molécula hipotética bromoclorofluoroiodometano mostrada em seu (R)-configuração seria um composto chiral muito simples. As prioridades são atribuídas com base no número atômico (Z.: iodo (Z. = 53) > bromo (Z. = 35) > cloro (Z. = 17) > flúor (Z. = 9). Permitindo flúor (prioridade ocidental, número 4) para apontar para longe do espectador a rotação é no sentido horário, daí o R Atribuição. Na atribuição de L-serina maior prioridade (ou seja, número 1) é dada ao átomo de nitrogênio (Z. = 7) no grupo aminado (NH)2). Tanto o grupo hidroximetil (CH2OH) e o grupo de ácido carboxílico (COOH) têm átomos de carbono (Z. = 6) mas a prioridade é dada ao último porque o átomo de carbono no grupo COOH está ligado a um segundo oxigênio (Z. = 8) Considerando que no CH2O carbono do grupo OH está ligado a um átomo de hidrogênio (Z. = 1). A menor prioridade (ou seja, o número 4) é dada ao átomo de hidrogênio e, como este átomo aponta para longe do espectador, a diminuição no sentido contrário da prioridade sobre os três substituintes restantes completa a atribuição como S. O estereocentro em (S)-carvona está ligado a um átomo de hidrogênio (não mostrado, prioridade 4) e três átomos de carbono. O grupo isopropenil tem prioridade 1 (apenas átomos de carbono), e para os dois átomos de carbono remanescentes, a prioridade é decidida com os átomos de carbono duas ligações removidas do estereocentro, uma parte do grupo keto (O, O, C, número de prioridade 2) e uma parte de um alceno (C, C, H, número de prioridade 3). A rotação contra-horário resultante resulta em S.
Descrevendo vários centros
Se um composto tem mais de um estereocentro quiral, cada centro é denotado por R ou S. Por exemplo, a efedrina existe em estereoisômeros (1R,2S) e (1S,2R), que são formas de imagem espelhada distintas umas das outras, tornando-as enantiômeros. Este composto também existe como os dois enantiômeros escritos (1R,2R) e (1S,2S), que são denominados pseudoefedrina em vez de efedrina. Todos esses quatro isômeros são denominados 2-metilamino-1-fenil-1-propanol na nomenclatura sistemática. No entanto, a efedrina e a pseudoefedrina são diastereômeros, ou estereoisômeros que não são enantiômeros porque não estão relacionados como cópias de imagens espelhadas. A pseudoefedrina e a efedrina recebem nomes diferentes porque, como diastereômeros, possuem propriedades químicas diferentes, mesmo para misturas racêmicas de cada uma.
De forma mais geral, para qualquer par de enantiômeros, todos os descritores são opostos: (R,R) e (S,S) são enantiômeros, assim como (R,S) e (S,R). Diastereoisômeros têm pelo menos um descritor em comum; por exemplo (R,S) e (R,R) são diastereômeros, assim como ( S,R) e (S,S). Isso vale também para compostos com mais de dois estereocentros: se dois estereoisômeros tiverem pelo menos um descritor em comum, eles são diastereoisômeros. Se todos os descritores forem opostos, eles são enantiômeros.
Um composto meso é uma molécula aquiral, apesar de ter dois ou mais centros estereogênicos. Um composto meso é "superponível" em sua imagem espelhada, portanto reduz o número de estereoisômeros previstos pela regra 2n. Isso ocorre porque a molécula obtém um plano de simetria que faz com que a molécula gire em torno da ligação carbono-carbono central. Um exemplo é o ácido meso-tartárico, em que (R,S) é o mesmo que (S,R) forma. Em compostos meso, os estereocentros R e S ocorrem em pares posicionados simetricamente.
Configuração relativa
A configuração relativa de dois estereoisômeros pode ser indicada pelos descritores R e S com um asterisco (*). (R*,R*) significa dois centros com configurações idênticas, (R,R) ou (S,S); (R*,S*) significa dois centros com configurações opostas, (R,S) ou (S,R). Para começar, o centro estereogênico de menor número (de acordo com a numeração sistemática da IUPAC) recebe o descritor R*.
Para designar dois anômeros, são usados os estereodescritores relativos alfa (α) e beta (β). No anômero α, o átomo de carbono anomérico e o átomo de referência têm configurações opostas (R,S) ou (S,R), enquanto no anômero β eles são os mesmos (R,R) ou (S,S).
Rostos
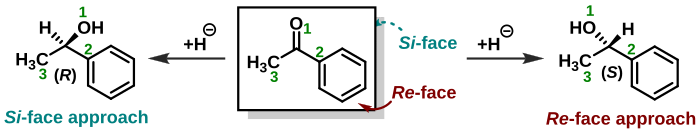
A estereoquímica também desempenha um papel atribuindo faces a moléculas trigonais, como cetonas. Um nucleófilo em uma adição nucleofílica pode se aproximar do grupo carbonila de dois lados ou faces opostas. Quando um nucleófilo aquiral ataca a acetona, ambas as faces são idênticas e há apenas um produto de reação. Quando o nucleófilo ataca a butanona, as faces não são idênticas (enantiotópicas) e resulta um produto racêmico. Quando o nucleófilo é uma molécula quiral, são formados diastereoisômeros. Quando uma face de uma molécula é protegida por substituintes ou restrições geométricas em comparação com a outra face, as faces são chamadas diastereotópicas. As mesmas regras que determinam a estereoquímica de um estereocentro (R ou S) também se aplicam ao atribuir a face de um grupo molecular. As faces são então chamadas de Re-face e Si-face. No exemplo exibido à direita, o composto acetofenona é visto da face Re. A adição de hidreto como em um processo de redução deste lado formará o (S)-enantiômero e o ataque da face oposta Si dará o (R)-enantiômero. No entanto, deve-se notar que a adição de um grupo químico ao centro proquiral da face Re nem sempre levará a um (S)-estereocentro, como a prioridade do grupo químico deve ser levado em consideração. Ou seja, a estereoquímica absoluta do produto é determinada por conta própria e não considerando de qual face foi atacado. No exemplo acima mencionado, se cloreto (Z = 17) fosse adicionado ao centro proquiral da face Re, isso resultaria em um (R )-enantiômero.
Contenido relacionado
Colesterol
Clatrato hidratado
Químico