Química do ácido ascórbico
Ácido ascórbico é um composto orgânico com fórmula C
6H
8O
6, origem finalmente chamado de ácido hexurônico. É um sólido branco, mas amostras impuras podem parecer amareladas. Dissolve-se bem em água para dar soluções levemente ácidas. É um agente redutor suave.
O ácido ascórbico existe como dois enantiômeros (isômeros de imagem espelhada), comumente denominados "l" (para "levo") e "d" (para "dextro"). O isômero l é o mais encontrado: ocorre naturalmente em muitos alimentos e é uma forma ("vitamer") da vitamina C, um nutriente essencial para humanos e muitos animais. A deficiência de vitamina C causa o escorbuto, antigamente uma das principais doenças dos marinheiros em longas viagens marítimas. É usado como aditivo alimentar e suplemento dietético por suas propriedades antioxidantes. O "d" forma pode ser feita através de síntese química, mas não tem nenhum papel biológico significativo.
História
As propriedades antiescorbúticas de certos alimentos foram demonstradas no século XVIII por James Lind. Em 1907, Axel Holst e Theodor Frølich descobriram que o fator antiescorbútico era uma substância química solúvel em água, distinta daquela que prevenia o beribéri. Entre 1928 e 1932, Albert Szent-Györgyi isolou um candidato a essa substância, que chamou de "ácido hexurônico", primeiro de plantas e depois de glândulas adrenais de animais. Em 1932, Charles Glen King confirmou que era de fato o fator antiescorbútico.
Em 1933, o químico do açúcar Walter Norman Haworth, trabalhando com amostras de "ácido hexurônico" que Szent-Györgyi havia isolado da páprica e enviado a ele no ano anterior, deduziu a estrutura correta e a natureza óptico-isomérica do composto e, em 1934, relatou sua primeira síntese. Em referência às propriedades antiescorbúticas do composto, Haworth e Szent-Györgyi propuseram renomeá-lo como "ácido escórbico" para o composto, e mais tarde especificamente ácido l-ascórbico. Por causa de seu trabalho, em 1937, os prêmios Nobel de química e medicina foram concedidos a Haworth e Szent-Györgyi, respectivamente.
Propriedades químicas
Acidez
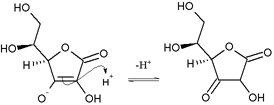
O ácido ascórbico é uma lactona à base de furano e forma o ânion ascorbato quando desprotonado em uma das hidroxilas. Esta propriedade é característica das reductonas: enedióis com um grupo carbonilo adjacente ao grupo enediol, nomeadamente com o grupo −C(OH)=C(OH)−C(=O)−. O ânion ascorbato é estabilizado pela deslocalização eletrônica que resulta da ressonância entre duas formas:
Por esta razão, o ácido ascórbico é muito mais ácido do que seria esperado se o composto contivesse apenas grupos hidroxila isolados.
Sais
O ânion ascorbato forma sais, como ascorbato de sódio, ascorbato de cálcio e ascorbato de potássio.
Ésteres
O ácido ascórbico também pode reagir com ácidos orgânicos como ésteres formadores de álcool, como palmitato de ascorbilo e estearato de ascorbilo.
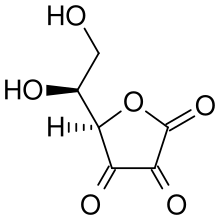
Ataque nucleofílico
O ataque nucleofílico do ácido ascórbico a um próton resulta em uma 1,3-dicetona:
Oxidação
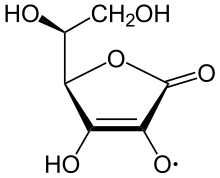
O íon ascorbato é a espécie predominante em valores biológicos típicos de pH. É um agente redutor suave e antioxidante. É oxidado com perda de um elétron para formar um cátion radical e então com perda de um segundo elétron para formar ácido dehidroascórbico. Ele normalmente reage com oxidantes das espécies reativas de oxigênio, como o radical hidroxila.
O ácido ascórbico é especial porque pode transferir um único elétron, devido à natureza estabilizada por ressonância de seu próprio íon radical, chamado semideidroascorbato. A reação líquida é:
- RO• + C
6H. H. H.
7O- Sim.
6 → RO- Sim. + C6H. H. H.7O•
6 → ROH + C6H. H. H.6O6
Na exposição ao oxigênio, o ácido ascórbico sofrerá decomposição oxidativa adicional em vários produtos, incluindo ácido dicetogulônico, ácido xilônico, ácido treônico e ácido oxálico.
Espécies reativas de oxigênio são prejudiciais para animais e plantas no nível molecular devido à sua possível interação com ácidos nucléicos, proteínas e lipídios. Às vezes, esses radicais iniciam reações em cadeia. O ascorbato pode terminar essas reações radicais em cadeia por transferência de elétrons. As formas oxidadas de ascorbato são relativamente não reativas e não causam dano celular.
No entanto, sendo um bom doador de elétrons, o excesso de ascorbato na presença de íons metálicos livres pode não apenas promover, mas também iniciar reações de radicais livres, tornando-o um composto pró-oxidativo potencialmente perigoso em certos contextos metabólicos.
O ácido ascórbico e seus sais de sódio, potássio e cálcio são comumente usados como aditivos alimentares antioxidantes. Esses compostos são solúveis em água e, portanto, não podem proteger as gorduras da oxidação: Para esse fim, os ésteres lipossolúveis do ácido ascórbico com ácidos graxos de cadeia longa (palmitato de ascorbil ou estearato de ascorbil) podem ser usados como antioxidantes alimentares.
Outras reações
Cria compostos voláteis quando misturado com glicose e aminoácidos a 90°C.
É um cofator na oxidação da tirosina.
Usos
Aditivo alimentar
O principal uso do ácido l-ascórbico e seus sais é como aditivos alimentares, principalmente para combater a oxidação. É aprovado para esta finalidade na UE com o número E E300, EUA, Austrália e Nova Zelândia.
Suplemento dietético
Outro uso importante do ácido l-ascórbico é como suplemento dietético.
Usos de nicho, não alimentícios
- O ácido ascórbico é facilmente oxidado e assim é usado como um redutante em soluções de desenvolvedor fotográfico (entre outros) e como um conservante.
- Em microscopia de fluorescência e técnicas relacionadas à base de fluorescência, o ácido ascórbico pode ser usado como antioxidante para aumentar o sinal fluorescente e o fotobleaching de corante quimicamente retardado.
- Também é comumente usado para remover manchas metálicas dissolvidas, como ferro, de superfícies de piscina de fibra de vidro.
- Na fabricação de plástico, o ácido ascórbico pode ser usado para montar cadeias moleculares mais rapidamente e com menos desperdício do que os métodos de síntese tradicionais.
- Os usuários de heroína são conhecidos por usar ácido ascórbico como um meio para converter a base de heroína em um sal solúvel em água para que ele possa ser injetado.
- Como justificada por sua reação com iodo, é usado para negar os efeitos de comprimidos de iodo na purificação da água. Reage com a água esterilizada, removendo o gosto, a cor e o cheiro do iodo. É por isso que muitas vezes é vendido como um segundo conjunto de comprimidos na maioria das lojas de bens esportivos como Potable Aqua-Neutralizing Tablets, juntamente com os comprimidos de iodeto de potássio.
- O ascorbato de alta dose intravenosa está sendo usado como um agente de modificação de resposta química e biológica. Atualmente ainda está em ensaios clínicos.
- Às vezes é usado como um acidificador urinário para melhorar o efeito anti-séptico da metenamina.
Síntese
A biossíntese natural da vitamina C ocorre em muitas plantas e animais por uma variedade de processos.
Preparação industrial
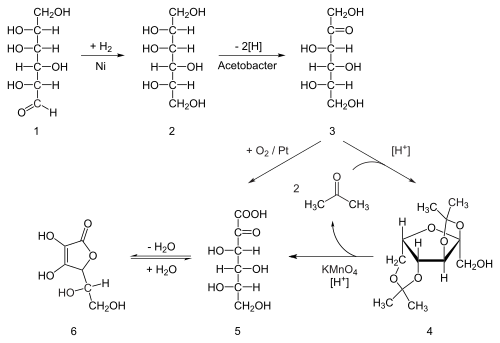
Oitenta por cento do suprimento mundial de ácido ascórbico é produzido na China. O ácido ascórbico é preparado na indústria a partir da glicose em um método baseado no processo histórico de Reichstein. No primeiro de um processo de cinco etapas, a glicose é hidrogenada cataliticamente a sorbitol, que é então oxidado pelo microrganismo Acetobacter suboxydans a sorbose. Apenas um dos seis grupos hidroxila é oxidado por esta reação enzimática. A partir deste ponto, duas rotas estão disponíveis. O tratamento do produto com acetona na presença de um catalisador ácido converte quatro dos grupos hidroxila restantes em acetais. O grupo hidroxila desprotegido é oxidado ao ácido carboxílico por reação com o oxidante catalítico TEMPO (regenerado por hipoclorito de sódio - solução de branqueamento). Historicamente, a preparação industrial através do processo Reichstein usava permanganato de potássio como solução de branqueamento. A hidrólise catalisada por ácido deste produto executa a dupla função de remover os dois grupos acetal e lactonização de fechamento de anel. Esta etapa produz ácido ascórbico. Cada uma das cinco etapas tem um rendimento superior a 90%.
Um processo mais biotecnológico, desenvolvido pela primeira vez na China na década de 1960, mas desenvolvido na década de 1990, ignora o uso de grupos protetores de acetona. Uma segunda espécie de micróbio geneticamente modificado, como o mutante Erwinia, entre outros, oxida a sorbose em ácido 2-cetoglucônico (2-KGA), que pode então sofrer lactonização de fechamento do anel por desidratação. Este método é usado no processo predominante usado pela indústria de ácido ascórbico na China, que fornece 80% do ácido ascórbico do mundo. Pesquisadores americanos e chineses estão competindo para projetar um mutante que possa realizar uma fermentação em um pote diretamente da glicose para o 2-KGA, ignorando a necessidade de uma segunda fermentação e a necessidade de reduzir a glicose a sorbitol.
Existe um ácido d-ascórbico, que não ocorre na natureza, mas pode ser sintetizado artificialmente. Para ser específico, l-ascorbato é conhecido por participar de muitas reações enzimáticas específicas que requerem o enantiômero correto (l-ascorbato e não d-ascorbate). l-O ácido ascórbico tem uma rotação específica de [α]20
D = +23°.
Determinação
A forma tradicional de analisar o teor de ácido ascórbico é o processo de titulação com um agente oxidante, e vários procedimentos foram desenvolvidos.
A abordagem popular de iodometria usa iodo na presença de um indicador de amido. O iodo é reduzido pelo ácido ascórbico e, quando todo o ácido ascórbico tiver reagido, o iodo está então em excesso, formando um complexo preto-azulado com o indicador de amido. Isso indica o ponto final da titulação.
Como alternativa, o ácido ascórbico pode ser tratado com iodo em excesso, seguido de retrotitulação com tiossulfato de sódio usando amido como indicador.
Este método iodométrico foi revisado para explorar a reação do ácido ascórbico com iodato e iodeto em solução ácida. A eletrólise da solução de iodeto de potássio produz iodo, que reage com o ácido ascórbico. O final do processo é determinado por titulação potenciométrica de maneira semelhante à titulação de Karl Fischer. A quantidade de ácido ascórbico pode ser calculada pela lei de Faraday.
Outra alternativa usa N-bromosuccinimida (NBS) como agente oxidante, na presença de iodeto de potássio e amido. O NBS primeiro oxida o ácido ascórbico; quando este se esgota, o NBS libera o iodo do iodeto de potássio, que então forma o complexo preto-azulado com o amido.
Notas e referências
- ^ Dados de segurança (MSDS) para ácido ascórbico. Universidade de Oxford
- ^ História da descoberta química da vitamina C. Profiles.nlm.nih.gov. Retrieved em 2012-12-04.
- ^ Davies MB, Austin J, Partridge DA (1991). Vitamina C: Sua Química e Bioquímica. The Royal Society of Chemistry. p. 48. ISBN 0-85186-333-7.
- ^ Svirbelf JL, Szent-Györgyi A (25 de abril de 1932), "A Natureza Química da Vitamina C" (PDF), Ciência, 75 (1944): 357–8, Bibcode:1932Sci....75.357K, doi:10.1126/science.75.1944.357-a, PMID 17750032, S2CID 33277683. Parte da coleção Biblioteca Nacional de Medicina. Acesso em Janeiro de 2007
- ^ Caspi R (Aug 19, 2009), "MetaCyc Compound: monodehydroascorbate radical", MetaCyc, recuperado 2014-12-08
- ^ Gaonkar AG, McPherson A (2016-04-19). Interações de ingredientes: Efeitos na qualidade alimentar, segunda edição. ISBN 9781420028133.
- ^ Seck, S.; Crouzet, J. (1981). «Formation of Volatile Compounds in Sugar-Phenylalanine and Ascorbic Acid-Phenylalanine Model Systems» (em inglês). Journal of Food Science. 46. (3): 790–793. doi:10.111111/j.1365-2621.1981.tb15349.x.
- ^ Sealock RR, Goodland RL, Sumerwell WN, Brierly JM (maio de 1952). "O papel do ácido ascórbico na oxidação de L-Tirosina por extratos de fígado de cobaia" (PDF). O Jornal de Química Biológica. 196 (2): 761–7.10.1016/S0021-9258(19)52407-3. PMID 12981016.
- ^ Normas alimentares britânicas Agência: "Current EU aprovou aditivos e seus números E". Retrieved 2011-10-27.
- ^ Administração de Alimentos e Medicamentos dos EUA: «Listing of Food Additives Status Part I» (em inglês). Administração de Alimentos e Medicamentos. Arquivado do original em 2012-01-17. Retrieved 2011-10-27.
- ^ Austrália Nova Zelândia Food Standards Código"Standard 1.2.4 – Rotulagem de ingredientes". Retrieved 2011-10-27.
- ^ Widengren J, Chmyrov A, Eggeling C, Löfdahl PA, Seidel CA (janeiro de 2007). «Strategies to better photostabilities in ultrasensitive fluorescence spectroscopy» (em inglês). O Jornal de Química Física A. 111 (3): 429–40. Bibcode:2007JPCA..111..429W. doi:10.1021/jp0646325. PMID 17228891.
- ^ Vitamina C, água tem benefícios para a fabricação de plástico, Fiável Plant Magazine, 2007, arquivado do original em 2007-09-27, recuperado 2007-06-25
- ^ Beynon CM, McVeigh J, Chandler M, Wareing M, Bellis MA (dezembro de 2007). «The impact of citrate introduction at UK syringe exchange programs: a retrospective cohort study in Cheshire and Merseyside, UK» (em inglês). Jornal de Redução de Colheita. 4 (1): 21. doi:10.1186/1477-7517-4-21. PMC224592. PMID 18072971.
- ^ "O Protocolo do Riordan IVC para Cuidados Adjuntivos do Câncer: Ascorbato Intravenoso como Agente Modificador de Resposta Chemotherapeutic e Biological" (PDF). Riordan Clinic Research Institut. Fevereiro de 2013. Arquivado (PDF) do original em 2022-10-09. Retrieved 2 de Fevereiro 2014.
{{cite journal}}: A revista Cite requer|journal=(ajuda) - ^ «High-Dose Vitamin C (PDQ®): Human/Clinical Studies» (em inglês). Instituto Nacional do Câncer. 2013-02-08. Retrieved 2 de Fevereiro 2014.
- ^ Strom, J. Grady; Jun, H. Won (1993). «Efeito de pH de urina e ácido ascórbico na taxa de conversão de metenamina para formaldeído». Biofarmacêutica e Disposição de Drogas. 14 (1): 61–69. doi:10.1002/bdd.2510140106. PMID 8427945. S2CID 11151179.
- ^ Nahata, M. C.; Cummins, B. A.; McLeod, D. C.; Schondelmeyer, S. W.; Butler, R. (1982). «Efeito de acidificadores urinários na concentração de formaldeído e eficácia com terapia de metenamina». Revista Europeia de Farmacologia Clínica. 22 (3): 281–284. doi:10.1007/bf00545228. PMID 7106162. S2CID 31796137.
- ^ Weiss R (20 de maio de 2007), "Tainted Chinese Imports Common", Washington Post, recuperado 2010-04-25
- ^ Eggersdorfer, M.; et al. "Vitamins". Enciclopédia de Química Industrial de Ullmann. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_443.
- ^ A aderência da China no aditivo alimentar chave. O Monitor de Ciência Cristã. 2007-07-20. Retrieved em 2012-12-04.
- ^ Descrição da BASF de vitamina C — desenvolvimentos em métodos de produção. Arquivado em 30 de janeiro de 2012, no Wayback Machine. concorrência-commission.org.uk.
- ^ Rosa, Júlio César Câmara; Colombo, Lívia Tavares; Alvim, Mariana Caroline Tocantins; Avonce, Nelson; Van Dijck, Patrick; Passos, Flávia Maria Lopes (2013-06-22). «Metabolic engineering of Kluyveromyces lactis for L-ascorbic acid (vitamin C) biosynthesis» (em inglês). Fatores de células microbianas. 12: 59. doi:10.1186/1475-2859-12-59. ISSN 1475-2859. PMC369991. PMID 23799937.
- ^ Davies MB, Austin, John A., Partridge, David A. (1991). Vitamina C: sua química e bioquímica. Cambridge [Cambridgeshire]: Royal Society of Chemistry (em inglês). ISBN 9780851863337.
- ^ "Um teste simples para vitamina C" (PDF). Revisão de Ciência da Escola. 83 (305): 131. 2002. Arquivado do original (PDF) em 4 de julho de 2016.
Contenido relacionado
Boro
Orbital atômico
Fulereno