Piridina
Piridina é um composto orgânico heterocíclico básico com a fórmula química C5H5N. Está estruturalmente relacionado ao benzeno, com um grupo metino (=CH−) substituído por um átomo de nitrogênio. É um líquido altamente inflamável, fracamente alcalino, miscível em água, com um cheiro distinto e desagradável de peixe. A piridina é incolor, mas amostras mais antigas ou impuras podem aparecer amarelas, devido à formação de cadeias poliméricas insaturadas estendidas, que apresentam condutividade elétrica significativa. O anel de piridina ocorre em muitos compostos importantes, incluindo agroquímicos, produtos farmacêuticos e vitaminas. Historicamente, a piridina era produzida a partir do alcatrão de hulha. A partir de 2016, é sintetizado na escala de cerca de 20.000 toneladas por ano em todo o mundo.
Propriedades
Propriedades físicas
A piridina é diamagnética. Seus parâmetros críticos são: pressão 5,63 MPa, temperatura 619 K e volume 248 cm3·mol−1. Na faixa de temperatura de 340–426 °C, sua pressão de vapor p pode ser descrita com a equação de Antoine
- log10. p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =A- Sim. - Sim. BC+T{displaystyle log _{10}p=A-{frac (B){C+T}}}
onde T é a temperatura, A = 4,16272, B = 1371,358 K e C = −58,496 K.
Estrutura
O anel de piridina forma um C5N hexágono. Observam-se pequenas variações das distâncias C−C e C−N, bem como dos ângulos de ligação.
Cristalografia
A piridina cristaliza em um sistema cristalino ortorrômbico com grupo espacial Pna21 e parâmetros de rede a = 1752 pm, b = 897 pm, c = 1135 pm e 16 unidades de fórmula por célula unitária (medidas a 153 K). Para comparação, o benzeno cristalino também é ortorrômbico, com grupo espacial Pbca, a = 729,2 pm, b = 947,1 pm, c = 674,2 pm (a 78 K), mas o número de moléculas por célula é apenas 4. Essa diferença está parcialmente relacionada à menor simetria da molécula de piridina individual (C2v vs D6h para benzeno). Um tri-hidrato (piridina·3H2O) é conhecido; também cristaliza em um sistema ortorrômbico no grupo espacial Pbca, parâmetros de rede a = 1244 pm, b = 1783 pm, c = 679 pm e oito unidades de fórmula por célula unitária (medidas a 223 K).
Espectroscopia
O espectro de absorção óptica de piridina em hexano consiste em bandas nos comprimentos de onda de 195, 251 e 270 nm. Com respectivos coeficientes de extinção (ε) de 7500, 2000 e 450 L·mol−1·cm−1, essas bandas são atribuídas a Transições π → π*, π → π* e n → π*.
O espectro de ressonância magnética nuclear (RMN) 1H mostra sinais para prótons α-(δ 8,5), γ-(δ7,5) e β (δ7). Em contraste, o sinal do próton para o benzeno é encontrado em δ7,27. Os maiores deslocamentos químicos dos prótons α e γ em comparação com o benzeno resultam da menor densidade eletrônica nas posições α e γ, que podem ser derivadas das estruturas de ressonância. A situação é bastante semelhante para os espectros de 13C NMR de piridina e benzeno: a piridina mostra um tripleto em δ(α-C) = 150 ppm, δ(β-C) = 124 ppm e δ(γ -C) = 136 ppm, enquanto o benzeno tem uma única linha em 129 ppm. Todos os turnos são cotados para as substâncias sem solvente. A piridina é convencionalmente detectada pelos métodos de cromatografia gasosa e espectrometria de massa.
Vínculo
A piridina tem um sistema conjugado de seis elétrons π que estão deslocalizados sobre o anel. A molécula é planar e, portanto, segue os critérios de Hückel para sistemas aromáticos. Em contraste com o benzeno, a densidade de elétrons não é distribuída uniformemente ao longo do anel, refletindo o efeito indutivo negativo do átomo de nitrogênio. Por esta razão, a piridina tem um momento dipolar e uma estabilização ressonante mais fraca do que o benzeno (energia de ressonância 117 kJ·mol−1 em piridina vs. 150 kJ·mol−1 em benzeno).
Os átomos do anel na molécula de piridina são hibridizados sp2. O nitrogênio está envolvido no sistema aromático de ligação π usando seu orbital p não hibridizado. O par solitário está em um orbital sp2, projetando-se para fora do anel no mesmo plano que as ligações σ. Como resultado, o par solitário não contribui para o sistema aromático, mas influencia de forma importante as propriedades químicas da piridina, pois suporta facilmente a formação de ligações por meio de um ataque eletrofílico. No entanto, devido à separação do par solitário do sistema de anéis aromáticos, o átomo de nitrogênio não pode exibir um efeito mesomérico positivo.
Muitos análogos de piridina são conhecidos onde N é substituído por outros heteroátomos (veja a figura abaixo). A substituição de um C–H na piridina por um segundo N dá origem aos heterociclos de diazina (C4H4N2), com o nomes piridazina, pirimidina e pirazina.
História
A piridina impura foi, sem dúvida, preparada pelos primeiros alquimistas aquecendo ossos de animais e outras matérias orgânicas, mas a referência documentada mais antiga é atribuída ao cientista escocês Thomas Anderson. Em 1849, Anderson examinou o conteúdo do óleo obtido por aquecimento de ossos de animais em alta temperatura. Entre outras substâncias, separou do óleo um líquido incolor e de odor desagradável, do qual isolou piridina pura dois anos depois. Ele o descreveu como altamente solúvel em água, facilmente solúvel em ácidos e sais concentrados após aquecimento e apenas ligeiramente solúvel em óleos.
Devido à sua inflamabilidade, Anderson batizou a nova substância de piridina, em homenagem ao grego: πῦρ (pyr) que significa fogo. O sufixo idina foi adicionado de acordo com a nomenclatura química, como em toluidina, para indicar um composto cíclico contendo um átomo de nitrogênio.
A estrutura química da piridina foi determinada décadas após sua descoberta. Wilhelm Körner (1869) e James Dewar (1871) sugeriram que, em analogia entre a quinolina e o naftaleno, a estrutura da piridina é derivada do benzeno pela substituição de uma unidade C-H por um átomo de nitrogênio. A sugestão de Körner e Dewar foi posteriormente confirmada em um experimento em que a piridina foi reduzida a piperidina com sódio em etanol. Em 1876, William Ramsay combinou acetileno e cianeto de hidrogênio em piridina em um forno de tubo de ferro em brasa. Esta foi a primeira síntese de um composto heteroaromático.
A primeira grande síntese de derivados de piridina foi descrita em 1881 por Arthur Rudolf Hantzsch. A síntese de piridina de Hantzsch normalmente usa uma mistura 2:1:1 de um β-cetoácido (geralmente acetoacetato), um aldeído (geralmente formaldeído) e amônia ou seu sal como doador de nitrogênio. Primeiro, obtém-se uma piridina duplamente hidrogenada, que é então oxidada ao correspondente derivado de piridina. Emil Knoevenagel mostrou que derivados de piridina substituídos assimetricamente podem ser produzidos com este processo.
Os métodos contemporâneos de produção de piridina tinham baixo rendimento, e a crescente demanda pelo novo composto instigou a busca por rotas mais eficientes. Um grande avanço ocorreu em 1924, quando o químico russo Aleksei Chichibabin inventou uma reação de síntese de piridina, baseada em reagentes baratos. Este método ainda é usado para a produção industrial de piridina.
Ocorrência
A piridina não é abundante na natureza, exceto nas folhas e raízes da beladona (Atropa belladonna) e no marshmallow (Althaea officinalis). Derivados de piridina, no entanto, muitas vezes fazem parte de biomoléculas, como alcalóides.
Na vida diária, vestígios de piridina são componentes dos compostos orgânicos voláteis que são produzidos em processos de torrefação e enlatamento, por ex. em frango frito, sukiyaki, café torrado, batata frita e bacon frito. Traços de piridina podem ser encontrados no queijo Beaufort, secreções vaginais, chá preto, saliva de quem sofre de gengivite e mel de girassol.
Produção
Historicamente, a piridina era extraída do alcatrão de hulha ou obtida como subproduto da gaseificação do carvão. O processo é trabalhoso e ineficiente: o alcatrão de hulha contém apenas cerca de 0,1% de piridina e, portanto, foi necessária uma purificação em vários estágios, o que reduziu ainda mais a produção. Hoje em dia, a maioria das piridinas é sintetizada a partir de amônia, aldeídos e nitrilas, algumas combinações das quais são adequadas para a própria piridina. Várias reações de nomes também são conhecidas, mas não são praticadas em escala.
Em 1989, 26.000 toneladas de piridina foram produzidas em todo o mundo. Outros derivados principais são 2-, 3-, 4-metilpiridinas e 5-etil-2-metilpiridina. A escala combinada dessas alquilpiridinas corresponde à da própria piridina. Entre os 25 maiores locais de produção de piridina, onze estão localizados na Europa (desde 1999). Os principais produtores de piridina incluem Evonik Industries, Rütgers Chemicals, Jubilant Life Sciences, Imperial Chemical Industries e Koei Chemical. A produção de piridina aumentou significativamente no início dos anos 2000, com uma capacidade de produção anual de 30.000 toneladas somente na China continental. A joint venture EUA-China Vertellus é atualmente a líder mundial na produção de piridina.
Síntese de chichibabina
A síntese de piridina Chichibabin foi relatada em 1924 e a abordagem básica sustenta várias rotas industriais. Em sua forma geral, a reação envolve a reação de condensação de aldeídos, cetonas, compostos carbonílicos α,β-insaturados ou qualquer combinação dos anteriores, em amônia ou derivados de amônia. A aplicação da síntese de piridina Chichibabin apresenta baixos rendimentos, geralmente cerca de 30%, no entanto, os precursores são baratos. Em particular, a piridina não substituída é produzida a partir de formaldeído e acetaldeído. Primeiro, a acroleína é formada em uma condensação de Knoevenagel a partir do acetaldeído e do formaldeído. A acroleína então condensa com acetaldeído e amônia para dar diidropiridina, que é oxidada a piridina. Este processo é realizado em fase gasosa a 400–450 °C. Catalisadores típicos são formas modificadas de alumina e sílica. A reação foi adaptada para produzir várias metilpiridinas.
Desalquilação e descarboxilação de piridinas substituídas
A piridina pode ser preparada por desalquilação de piridinas alquiladas, que são obtidas como subprodutos na síntese de outras piridinas. A desalquilação oxidativa é realizada usando ar sobre catalisador de óxido de vanádio (V), por desalquilação a vapor em catalisador à base de níquel ou hidrodesalquilação com um catalisador à base de prata ou platina. Rendimentos de piridina de até 93% podem ser alcançados com o catalisador à base de níquel. A piridina também pode ser produzida pela descarboxilação do ácido nicotínico com cromita de cobre.
Ciclização de Bönnemann
A trimerização de uma parte de uma molécula de nitrilo e duas partes de acetileno em piridina é chamada de ciclização de Bönnemann. Esta modificação da síntese de Reppe pode ser ativada pelo calor ou pela luz. Enquanto a ativação térmica requer altas pressões e temperaturas, a cicloadição fotoinduzida ocorre em condições ambientais com CoCp2(cod) (Cp = ciclopentadienil, cod = 1,5-ciclooctadieno) como catalisador e pode ser executado mesmo na água. Uma série de derivados de piridina pode ser produzida dessa maneira. Ao usar acetonitrila como nitrila, obtém-se 2-metilpiridina, que pode ser desalquilada em piridina.
Outros métodos
A síntese de piridina de Kröhnke fornece um método bastante geral para gerar piridinas substituídas usando a própria piridina como um reagente que não se incorpora ao produto final. A reação da piridina com bromometilcetonas fornece o sal de piridínio relacionado, em que o grupo metileno é altamente ácido. Esta espécie sofre uma adição do tipo Michael a carbonilas α,β-insaturadas na presença de acetato de amônio para sofrer fechamento do anel e formação da piridina substituída alvo, bem como brometo de piridínio.
O rearranjo Ciamician-Dennstedt envolve a expansão do anel de pirrol com diclorocarbeno para 3-cloropiridina.
Na síntese de Gattermann-Skita, um sal de éster de malonato reage com diclorometilamina.
Outros métodos incluem a síntese de piridina de Boger e a reação de Diels-Alder de um alceno e um oxazol.
Biossíntese
Vários derivados de piridina desempenham papéis importantes em sistemas biológicos. Embora sua biossíntese não seja totalmente compreendida, o ácido nicotínico (vitamina B3) ocorre em algumas bactérias, fungos e mamíferos. Os mamíferos sintetizam o ácido nicotínico através da oxidação do aminoácido triptofano, onde um produto intermediário, o derivado da anilina quinurenina, cria um derivado da piridina, quinolinato e depois o ácido nicotínico. Pelo contrário, as bactérias Mycobacterium tuberculosis e Escherichia coli produzem ácido nicotínico por condensação de gliceraldeído 3-fosfato e ácido aspártico.
Reações
Por causa do nitrogênio eletronegativo no anel de piridina, a piridina entra menos prontamente nas reações de substituição aromática eletrofílica do que os derivados de benzeno. Em vez disso, em termos de reatividade, a piridina se assemelha ao nitrobenzeno.
Correspondentemente, a piridina é mais propensa à substituição nucleofílica, conforme evidenciado pela facilidade de metalação por bases organometálicas fortes. A reatividade da piridina pode ser distinguida por três grupos químicos. Com eletrófilos, a substituição eletrofílica ocorre onde a piridina expressa propriedades aromáticas. Com nucleófilos, a piridina reage nas posições 2 e 4 e, portanto, se comporta de maneira semelhante às iminas e carbonilas. A reação com muitos ácidos de Lewis resulta na adição de piridina ao átomo de nitrogênio, que é semelhante à reatividade das aminas terciárias. A capacidade de oxidação da piridina e seus derivados, formando óxidos de amina (N-óxidos), também é uma característica das aminas terciárias.
O centro de nitrogênio da piridina apresenta um par básico de elétrons solitários. Este par solitário não se sobrepõe ao anel aromático do sistema π, conseqüentemente a piridina é básica, possuindo propriedades químicas semelhantes às das aminas terciárias. A protonação dá piridínio, C5H5NH+. O pKa do ácido conjugado (o cátion piridínio) é 5,25. As estruturas da piridina e do piridínio são quase idênticas. O cátion piridínio é isoeletrônico com o benzeno. p-toluenossulfonato de piridínio (PPTS) é um sal de piridínio ilustrativo; é produzido pelo tratamento da piridina com ácido p-toluenossulfônico. Além da protonação, a piridina sofre alquilação centrada em N, acilação e N-oxidação. A piridina e a poli(4-vinil)piridina demonstraram formar fios moleculares condutores com notável estrutura de polienimina na irradiação UV, um processo que responde por pelo menos parte da absorção de luz visível por amostras envelhecidas de piridina. Esses fios foram teoricamente previstos como doadores e aceitadores de elétrons altamente eficientes e, ainda assim, são resistentes à oxidação do ar.
Substituições eletrofílicas
Devido à diminuição da densidade eletrônica no sistema aromático, as substituições eletrofílicas são suprimidas na piridina e seus derivados. A alquilação ou acilação de Friedel-Crafts geralmente falha para a piridina porque leva apenas à adição no átomo de nitrogênio. As substituições geralmente ocorrem na posição 3, que é o átomo de carbono mais rico em elétrons do anel e é, portanto, mais suscetível a uma adição eletrofílica.
A nitração direta da piridina é lenta. Derivados de piridina em que o átomo de nitrogênio é rastreado estericamente e/ou eletronicamente podem ser obtidos por nitração com tetrafluoroborato de nitrônio (NO2BF4). Desta forma, a 3-nitropiridina pode ser obtida através da síntese de 2,6-dibromopiridina seguida de nitração e desbromação.
A sulfonação da piridina é ainda mais difícil do que a nitração. No entanto, o ácido piridina-3-sulfônico pode ser obtido. A reação com o grupo SO3 também facilita a adição de enxofre ao átomo de nitrogênio, especialmente na presença de um catalisador de sulfato de mercúrio(II).
Em contraste com as lentas nitrações e sulfonações, a bromação e a cloração da piridina ocorrem bem.
N-óxido de piridina
A oxidação da piridina ocorre no nitrogênio para dar piridina N-óxido. A oxidação pode ser conseguida com perácidos:
- C5H. H. H.5N + RCO3H → C5H. H. H.5NO + RCO2H. H. H.
Substituições nucleofílicas
Em contraste com o anel de benzeno, a piridina suporta eficientemente várias substituições nucleofílicas. A razão para isso é a densidade eletrônica relativamente menor dos átomos de carbono do anel. Essas reações incluem substituições com eliminação de um íon hidreto e adições de eliminação com formação de uma configuração arina intermediária e geralmente ocorrem na posição 2 ou 4.
Muitas substituições nucleofílicas ocorrem mais facilmente não com piridina pura, mas com piridina modificada com bromo, cloro, flúor ou fragmentos de ácido sulfônico que então se tornam um grupo abandonador. Portanto, o flúor é o melhor grupo de saída para substituição por compostos organolítios. Os compostos de ataque nucleofílico podem ser alcóxidos, tiolatos, aminas e amônia (a pressões elevadas).
Em geral, o íon hidreto é um grupo de saída pobre e ocorre apenas em algumas reações heterocíclicas. Eles incluem a reação de Chichibabin, que produz derivados de piridina aminados na posição 2. Aqui, a amida de sódio é usada como o nucleófilo produzindo 2-aminopiridina. O íon hidreto liberado nessa reação se combina com um próton de um grupo amino disponível, formando uma molécula de hidrogênio.
Análogo ao benzeno, as substituições nucleofílicas da piridina podem resultar na formação de intermediários piridínicos como heteroarinos. Para este fim, os derivados de piridina podem ser eliminados com bons grupos de saída usando bases fortes, como terc-butóxido de sódio e potássio. A adição subsequente de um nucleófilo à ligação tripla tem baixa seletividade e o resultado é uma mistura dos dois possíveis adutos.
Reações radicais
A piridina suporta uma série de reações radicais, que são utilizadas na sua dimerização a bipiridinas. A dimerização radical de piridina com sódio elementar ou níquel de Raney produz seletivamente 4,4'-bipiridina ou 2,2'-bipiridina, que são reagentes precursores importantes na indústria química. Uma das reações conhecidas envolvendo radicais livres é a reação de Minisci. Pode produzir 2-terc-butilpiridina ao reagir piridina com ácido piválico, nitrato de prata e amônio em ácido sulfúrico com um rendimento de 97%.
Reações no átomo de nitrogênio
Os ácidos de Lewis adicionam-se facilmente ao átomo de nitrogênio da piridina, formando sais de piridínio. A reação com haletos de alquila leva à alquilação do átomo de nitrogênio. Isso cria uma carga positiva no anel que aumenta a reatividade da piridina tanto à oxidação quanto à redução. A reação de Zincke é utilizada para a introdução seletiva de radicais em compostos de piridínio (não tem relação com o elemento químico zinco).
Hidrogenação e redução
A piperidina é produzida pela hidrogenação da piridina com um catalisador à base de níquel, cobalto ou rutênio em temperaturas elevadas. A hidrogenação da piridina para piperidina libera 193,8 kJ·mol−1, que é ligeiramente menor que a energia da hidrogenação do benzeno (205,3 kJ·mol−1).
Os derivados parcialmente hidrogenados são obtidos em condições mais amenas. Por exemplo, a redução com hidreto de alumínio e lítio produz uma mistura de 1,4-di-hidropiridina, 1,2-di-hidropiridina e 2,5-di-hidropiridina. A síntese seletiva de 1,4-diidropiridina é obtida na presença de complexos organometálicos de magnésio e zinco, e a (Δ3,4)-tetraidropiridina é obtida por redução eletroquímica da piridina. A redução de bétula converte piridina em diidropiridinas.
Compostos de basicidade e coordenação de Lewis
A piridina é uma base de Lewis, doando seu par de elétrons para um ácido de Lewis. Suas propriedades de base de Lewis são discutidas no modelo ECW. Sua força doadora relativa para uma série de ácidos, versus outras bases de Lewis, pode ser ilustrada por gráficos C-B. Um exemplo é o complexo de trióxido de enxofre e piridina (ponto de fusão 175 °C), que é um agente de sulfatação usado para converter álcoois em ésteres de sulfato. Piridina-borano (C5H5NBH 3, ponto de fusão 10–11 °C) é um agente redutor suave.
Os complexos de piridina de metal de transição são numerosos. Complexos octaédricos típicos têm a estequiometria MCl2(py)4 e MCl3(py) 3. Complexos homolépticos octaédricos do tipo M(py)+6 são raros ou tendem a dissociar a piridina. Numerosos complexos planares quadrados são conhecidos, como o catalisador de Crabtree. O ligante piridina substituído durante a reação é restaurado após sua conclusão.
O modo de coordenação η6, como ocorre nos complexos de benzeno η6, é observado apenas em derivados sobrecarregados que bloqueiam o centro de nitrogênio.
Aplicativos
Pesticidas e produtos farmacêuticos
O principal uso da piridina é como precursor dos herbicidas paraquat e diquat. A primeira etapa da síntese do inseticida clorpirifós consiste na cloração da piridina. A piridina também é o composto de partida para a preparação de fungicidas à base de piritiona. O cetilpiridínio e o laurilpiridínio, que podem ser produzidos a partir da piridina com uma reação de Zincke, são usados como antissépticos em produtos de higiene bucal e odontológica. A piridina é facilmente atacada por agentes alquilantes para dar sais de N-alquilpiridínio. Um exemplo é o cloreto de cetilpiridínio.
Também é usado na indústria têxtil para melhorar a capacidade da rede de algodão.
Uso de laboratório
A piridina é usada como um solvente polar, básico e pouco reativo, por exemplo, em condensações de Knoevenagel. É especialmente adequado para a desalogenação, onde atua como base para a reação de eliminação. Nas esterificações e acilações, a piridina ativa os cloretos e anidridos dos ácidos carboxílicos. Ainda mais ativos nessas reações são os derivados 4-dimetilaminopiridina (DMAP) e 4-(1-pirrolidinil)piridina. A piridina também é usada como base em algumas reações de condensação.
Reagentes
Como base, a piridina pode ser usada como reagente de Karl Fischer, mas geralmente é substituída por alternativas com um odor mais agradável, como o imidazol.
Clorocromato de piridínio, dicromato de piridínio e o reagente de Collins (o complexo de óxido de cromo (VI)) são usados para a oxidação de álcoois.
Perigos
A piridina é um líquido tóxico e inflamável com um forte e desagradável odor de peixe. Seu limite de odor de 0,04 a 20 ppm está próximo de seu limite de 5 ppm para efeitos adversos, portanto, a maioria (mas não todos) os adultos serão capazes de dizer quando ele está presente em níveis nocivos. A piridina dissolve-se facilmente na água e prejudica animais e plantas em sistemas aquáticos.
Fogo
A piridina tem um ponto de inflamação de 20 °C e, portanto, é altamente inflamável. A combustão produz vapores tóxicos que podem incluir bipiridinas, óxidos de nitrogênio e monóxido de carbono.
Exposição de curto prazo
A piridina pode causar queimaduras químicas em contato com a pele e seus vapores podem ser irritantes para os olhos ou por inalação. A piridina deprime o sistema nervoso, dando sintomas semelhantes à intoxicação com concentrações de vapor acima de 3600 ppm, representando um maior risco à saúde. Os efeitos podem ter um início tardio de várias horas e incluem tontura, dor de cabeça, falta de coordenação, náusea, salivação e perda de apetite. Eles podem progredir para dor abdominal, congestão pulmonar e inconsciência. A menor dose letal conhecida (LDLo) para a ingestão de piridina em humanos é de 500 mg·kg−1.
Exposição de longo prazo
A exposição prolongada à piridina pode resultar em danos ao fígado, coração e rins. As avaliações como um possível agente carcinogênico mostraram que não há evidências adequadas em humanos para a carcinogenicidade da piridina, embora haja evidências suficientes em animais experimentais. Portanto, a IARC considera a piridina como possivelmente cancerígena para humanos (Grupo 2B).
Ocorrência
Vestígios de até 16 µg·m−3 foram detectados na fumaça do tabaco. Pequenas quantidades de piridina são liberadas no meio ambiente a partir de alguns processos industriais, como fabricação de aço, processamento de xisto betuminoso, gaseificação de carvão, coquerias e incineradores. A atmosfera nas plantas de processamento de xisto betuminoso pode conter concentrações de piridina de até 13 µg·m−3, e níveis de 53 µg·m−3 foram medidos nas águas subterrâneas no nas proximidades de uma usina de gaseificação de carvão. De acordo com um estudo do Instituto Nacional de Saúde e Segurança Ocupacional dos EUA, cerca de 43.000 americanos trabalham em contato com piridina.
Em alimentos
A piridina tem sido historicamente adicionada aos alimentos para dar-lhes um sabor amargo, embora esta prática seja agora proibida nos EUA. Ela ainda pode ser adicionada ao etanol para torná-lo impróprio para beber.
Metabolismo
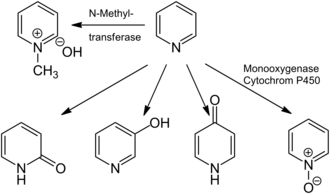
A exposição à piridina normalmente levaria à sua inalação e absorção nos pulmões e trato gastrointestinal, onde permanece inalterada ou é metabolizada. Os principais produtos do metabolismo da piridina são o hidróxido de N-metilpiridínio, que são formados por N-metiltransferases (por exemplo, piridina N-metiltransferase), bem como o N-óxido de piridina e 2-, 3- e 4-hidroxipiridina, que são gerados pela ação da monooxigenase. Em humanos, a piridina é metabolizada apenas em hidróxido de N-metilpiridínio.
Destino ambiental
A piridina é prontamente degradada por bactérias em amônia e dióxido de carbono. O anel de piridina não substituído degrada-se mais rapidamente do que picolina, lutidina, cloropiridina ou aminopiridinas, e vários degradadores de piridina demonstraram superproduzir riboflavina na presença de piridina. Compostos N-heterocíclicos ionizáveis, incluindo piridina, interagem com superfícies ambientais (como solos e sedimentos) por meio de múltiplos mecanismos dependentes do pH, incluindo partição em matéria orgânica do solo, troca catiônica e complexação da superfície. Essa adsorção a superfícies reduz a biodisponibilidade de piridinas para degradadores microbianos e outros organismos, diminuindo assim as taxas de degradação e reduzindo a ecotoxicidade.
Nomenclatura
O nome sistemático da piridina, dentro da nomenclatura Hantzsch-Widman recomendada pela IUPAC, é azinina. No entanto, nomes sistemáticos para compostos simples são usados muito raramente; em vez disso, a nomenclatura heterocíclica segue nomes comuns historicamente estabelecidos. A IUPAC desencoraja o uso de azinina/azina em favor de piridina. A numeração dos átomos do anel na piridina começa no nitrogênio (ver infobox). Uma alocação de posições por letra do alfabeto grego (α-γ) e a nomenclatura do padrão de substituição comum para sistemas homoaromáticos (ortho, meta, para) são usados às vezes. Aqui α (orto), β (meta) e γ (para) referem-se às posições 2, 3 e 4, respectivamente. O nome sistemático para os derivados de piridina é piridinil, em que a posição do átomo substituído é precedida por um número. No entanto, o nome histórico piridil é incentivado pela IUPAC e usado em vez do nome sistemático. O derivado catiônico formado pela adição de um eletrófilo ao átomo de nitrogênio é chamado de piridínio.
Contenido relacionado
Metal alcalino
Nitrito de amila
Antoine Lavoisier
Allenes
Querosene