Ozônio
Ozônio () (ou trioxigênio) é uma molécula inorgânica com a fórmula química O
3. É um gás azul claro com um cheiro distintamente pungente. É um alótropo de oxigênio muito menos estável que o alótropo diatômico O
2, quebrando na baixa atmosfera para O
2 (dioxigênio). O ozônio é formado a partir do dioxigênio pela ação da luz ultravioleta (UV) e descargas elétricas na atmosfera da Terra. Está presente em concentrações muito baixas em todo o último, com sua maior concentração na camada de ozônio da estratosfera, que absorve a maior parte da radiação ultravioleta (UV) do Sol.
O odor do ozônio lembra o cloro e pode ser detectado por muitas pessoas em concentrações tão baixas quanto 0,1 ppm no ar. A estrutura O3 do ozônio foi determinada em 1865. Mais tarde, provou-se que a molécula tinha uma estrutura curvada e era fracamente diamagnética. Em condições padrão, o ozônio é um gás azul claro que se condensa em temperaturas criogênicas em um líquido azul escuro e, finalmente, em um sólido preto violeta. A instabilidade do ozônio em relação ao dioxigênio mais comum é tal que tanto o gás concentrado quanto o ozônio líquido podem se decompor explosivamente em temperaturas elevadas, choque físico ou aquecimento rápido até o ponto de ebulição. Portanto, é usado comercialmente apenas em baixas concentrações.
O ozônio é um poderoso oxidante (muito mais do que o dioxigênio) e tem muitas aplicações industriais e de consumo relacionadas à oxidação. Este mesmo alto potencial oxidante, no entanto, faz com que o ozônio danifique tecidos mucosos e respiratórios em animais, e também tecidos em plantas, acima das concentrações de cerca de 0,1 ppm. Embora isso torne o ozônio um potente perigo respiratório e poluente próximo ao nível do solo, uma concentração mais alta na camada de ozônio (de dois a oito ppm) é benéfica, evitando que a luz ultravioleta prejudicial atinja a superfície da Terra.
Nomenclatura
O nome trivial ozônio é o nome IUPAC mais comumente usado e preferido. Os nomes sistemáticos 2λ4-trioxidieno e catena-trioxigênio, nomes IUPAC válidos, são construídos de acordo com as nomenclaturas substitutiva e aditiva, respectivamente. O nome ozônio deriva de ozein (ὄζειν), o particípio presente neutro grego para cheiro, referindo-se ao cheiro característico do ozônio.
Em contextos apropriados, o ozônio pode ser visto como trioxidano com dois átomos de hidrogênio removidos e, como tal, trioxidanilideno pode ser usado como um nome sistemático, de acordo com a nomenclatura substitutiva. Por padrão, esses nomes não levam em consideração a radicalidade da molécula de ozônio. Em um contexto ainda mais específico, isso também pode nomear o estado fundamental singleto não radical, enquanto o estado dirradical é denominado trioxidanediil.
Trioxidanediil (ou ozonídeo) é usado, não sistematicamente, para se referir ao grupo substituinte (-OOO-). Deve-se tomar cuidado para evitar confundir o nome do grupo com o nome específico do contexto para o ozônio dado acima.
História
Em 1785, o químico holandês Martinus van Marum estava realizando experimentos envolvendo faíscas elétricas acima da água quando notou um cheiro incomum, que atribuiu às reações elétricas, não percebendo que de fato havia criado o ozônio.
Meio século depois, Christian Friedrich Schönbein notou o mesmo odor pungente e reconheceu-o como o cheiro frequentemente seguido de um raio. Em 1839, ele conseguiu isolar o gás químico e denominou-o "ozônio", da palavra grega ozein (ὄζειν) significa "cheirar". Por esta razão, Schönbein é geralmente creditado com a descoberta do ozônio. Ele também observou a semelhança do cheiro do ozônio com o cheiro do fósforo e, em 1844, provou que o produto da reação do fósforo branco com o ar é idêntico. Um esforço subsequente para chamar o ozônio de "oxigênio eletrificado" ele ridicularizou ao propor chamar o ozônio do fósforo branco de "oxigênio fosforizado". A fórmula do ozônio, O3, não foi determinada até 1865 por Jacques-Louis Soret e confirmada por Schönbein em 1867.
Durante grande parte da segunda metade do século 19 e boa parte do século 20, o ozônio foi considerado um componente saudável do meio ambiente por naturalistas e defensores da saúde. Beaumont, Califórnia, tinha como slogan oficial "Beaumont: Zona de Ozônio", conforme evidenciado em cartões postais e papel timbrado da Câmara de Comércio. Os naturalistas que trabalham ao ar livre geralmente consideram as elevações mais altas benéficas por causa de seu conteúdo de ozônio. "Há uma atmosfera bastante diferente [em altitudes mais elevadas] com ozônio suficiente para sustentar a energia necessária [para o trabalho]", escreveu o naturalista Henry Henshaw, trabalhando no Havaí. O ar à beira-mar era considerado saudável por causa de seu teor de ozônio. O cheiro que dá origem a essa crença é de fato o de metabólitos de algas marinhas halogenadas e sulfeto de dimetila.
Grande parte do apelo do ozônio parece ter resultado de seu efeito "fresco" cheiro, que evocava associações com propriedades purificadoras. Os cientistas observaram seus efeitos nocivos. Em 1873, James Dewar e John Gray McKendrick documentaram que as rãs ficavam lentas, os pássaros ofegavam para respirar e a respiração dos coelhos. o sangue apresentou diminuição dos níveis de oxigênio após a exposição ao "ar ozonizado", que "exerceu uma ação destrutiva". O próprio Schönbein relatou que dores no peito, irritação das membranas mucosas e dificuldade para respirar ocorreram como resultado da inalação de ozônio, e pequenos mamíferos morreram. Em 1911, Leonard Hill e Martin Flack declararam no Proceedings of the Royal Society B que os efeitos saudáveis do ozônio "tornaram-se, por mera iteração, parte integrante da crença comum; e, no entanto, evidências fisiológicas exatas em favor de seus bons efeitos têm sido até agora quase totalmente inexistentes... O único conhecimento completamente bem apurado sobre o efeito fisiológico do ozônio, até agora obtido, é que ele causa irritação e edema dos pulmões e morte se inalado em concentração relativamente forte por qualquer momento."
Durante a Primeira Guerra Mundial, o ozônio foi testado no Queen Alexandra Military Hospital em Londres como um possível desinfetante para feridas. O gás foi aplicado diretamente nas feridas por até 15 minutos. Isso resultou em danos às células bacterianas e ao tecido humano. Outras técnicas de higienização, como irrigação com antissépticos, foram consideradas preferíveis.
Até a década de 1920, não havia certeza se pequenas quantidades de oxozônio, O
4, também estavam presentes em amostras de ozônio devido à dificuldade de aplicar técnicas de química analítica ao explosivo químico concentrado. Em 1923, Georg-Maria Schwab (trabalhando para sua tese de doutorado com Ernst Hermann Riesenfeld) foi o primeiro a solidificar com sucesso o ozônio e realizar análises precisas que refutaram conclusivamente a hipótese do oxozônio. Outras propriedades físicas até então não medidas do ozônio concentrado puro foram determinadas pelo grupo Riesenfeld na década de 1920.
Propriedades físicas
O ozônio é um gás incolor ou azul claro, ligeiramente solúvel em água e muito mais solúvel em solventes apolares inertes, como tetracloreto de carbono ou fluorocarbonetos, nos quais forma uma solução azul. A 161 K (−112 °C; −170 °F), ele se condensa para formar um líquido azul escuro. É perigoso permitir que este líquido aqueça até seu ponto de ebulição, porque tanto o ozônio gasoso concentrado quanto o ozônio líquido podem detonar. Em temperaturas abaixo de 80 K (−193,2 °C; −315,7 °F), forma um sólido preto violeta.
A maioria das pessoas pode detectar cerca de 0,01 μmol/mol de ozônio no ar, onde há um odor forte muito específico que lembra um pouco o alvejante à base de cloro. A exposição de 0,1 a 1 μmol/mol produz dores de cabeça, ardor nos olhos e irritação das vias respiratórias. Mesmo baixas concentrações de ozônio no ar são muito destrutivas para materiais orgânicos, como látex, plásticos e tecidos pulmonares de animais.
O ozônio é fracamente diamagnético.
Estrutura
De acordo com evidências experimentais de espectroscopia de micro-ondas, o ozônio é uma molécula dobrada, com simetria C2v (semelhante à molécula de água). As distâncias O–O são 127,2 pm (1,272 Å). O ângulo O–O–O é de 116,78°. O átomo central é sp² hibridizado com um par solitário. O ozônio é uma molécula polar com um momento dipolar de 0,53 D. A molécula pode ser representada como um híbrido de ressonância com duas estruturas contribuintes, cada uma com uma ligação simples de um lado e uma ligação dupla do outro. O arranjo possui uma ordem de ligação geral de 1,5 para ambos os lados. É isoeletrônico com o ânion nitrito. O ozônio de ocorrência natural pode ser composto de isótopos substituídos (16O, 17O, 18O). Uma forma cíclica foi prevista, mas não observada.
Reações
O ozônio está entre os agentes oxidantes mais poderosos conhecidos, muito mais forte que o O2. Também é instável em altas concentrações, decaindo em oxigênio diatômico comum. Sua meia-vida varia com as condições atmosféricas, como temperatura, umidade e movimento do ar. Em condições de laboratório, o tempo de meia-vida (HLT) terá uma média de aproximadamente 1.500 minutos (25 horas) em ar parado à temperatura ambiente (24 °C), umidade zero com zero renovações de ar por hora (ACH).
- 3 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2O3⟶ ⟶ ⟶ ⟶ 3O2(2 O3 -> 3 O2}}}
3 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/0f3268e8184ee9b5158d4546a8d6f1ae691649b8" style="vertical-align: -1.005ex; width:13.92ex; height:2.843ex;"/>
Esta reação prossegue mais rapidamente com o aumento da temperatura. A deflagração do ozônio pode ser desencadeada por uma faísca e pode ocorrer em concentrações de ozônio de 10% em peso ou superiores.
O ozônio também pode ser produzido a partir do oxigênio no ânodo de uma célula eletroquímica. Esta reação pode criar quantidades menores de ozônio para fins de pesquisa.
- <math alttext="{displaystyle {ce {O3_{(g)}{}+ 2H+{}+ 2e- O2_{(g)}{}+ H2O}}quad (E^{circ }={text{2.075 V}})}" xmlns="http://www.w3.org/1998/Math/MathML">O3(g)+2H. H. H.++2e- Sim. - Sim. ↽ ↽ - Sim. - Sim. - Sim. - Sim. ⇀ ⇀ O2(g)+H. H. H.2O(E∘ ∘ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =2.075 V){displaystyle {ce {O3_{(g)}{}+ 2H+ 2e- O2_{(g)}{}+ H2O}}quad (E^{circ }={text{2.075 V}})}<img alt="{displaystyle {ce {O3_{(g)}{}+ 2H+{}+ 2e- O2_{(g)}{}+ H2O}}quad (E^{circ }={text{2.075 V}})}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6f5c0501a2d72a0244bd6348b6a393907df0f46b" style="vertical-align: -1.505ex; width:54.297ex; height:3.843ex;"/>
Isso pode ser observado como uma reação indesejada em um aparelho de gás Hoffman durante a eletrólise da água quando a tensão é ajustada acima da tensão necessária.
Com metais
O ozônio oxidará a maioria dos metais (exceto ouro, platina e irídio) a óxidos dos metais em seu estado de oxidação mais alto. Por exemplo:
- CuO + O2}}\&{ce {Ag + O3 -> AgO + O2}}end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">Cu+O3⟶ ⟶ ⟶ ⟶ Cuo+O2Agrupamento+O3⟶ ⟶ ⟶ ⟶ AgO+O2{displaystyle {begin{aligned}&{ce {Cu + O3 -> CuO + O2}}&{ce {Ag + O3 -> AgO + O2}}end{aligned}}}
CuO + O2}}\&{ce {Ag + O3 -> AgO + O2}}end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/4b43430b3309a0a872b279b33567646f488dc20f" style="vertical-align: -2.671ex; width:25.002ex; height:6.509ex;"/>
Com compostos de nitrogênio e carbono
O ozônio também oxida o óxido nítrico em dióxido de nitrogênio:
- NO2 + O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">Não.+O3⟶ ⟶ ⟶ ⟶ Não.2+O2(NO + O3 -> NO2 + O2}}}
NO2 + O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/0544e0d0f68112d969a60168581b41199aa642b7" style="vertical-align: -1.005ex; width:24.658ex; height:2.843ex;"/>
Esta reação é acompanhada por quimioluminescência. O NO2 pode ser ainda mais oxidado a radical nitrato:
- NO3 + O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">Não.2+O3⟶ ⟶ ⟶ ⟶ Não.3+O2(NO2 + O3 -> NO3 + O2}}}
NO3 + O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/c8ace9b0494bf2f7f56d44fb9522b666d90f3f79" style="vertical-align: -1.005ex; width:25.712ex; height:2.843ex;"/>
O NO3 formado pode reagir com NO2 para formar pentóxido de dinitrogênio (N2O5).
Perclorato de nitrônio sólido pode ser feito de NO2, ClO2 e O3 gases:
- NO2ClO4 + 2 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">Não.2+ClO2+2O3⟶ ⟶ ⟶ ⟶ Não.2ClO4+2O2(NO2 + ClO2 + 2 O3 -> NO2ClO4 + 2 O2}}}
NO2ClO4 + 2 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/a05aab2690eac42df5fcffca9ab054e605d1dac9" style="vertical-align: -1.005ex; width:42.026ex; height:2.843ex;"/>
O ozônio não reage com os sais de amônio, mas oxida a amônia a nitrato de amônio:
- NH4NO3 + 4 O2 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">2NH3+4O3⟶ ⟶ ⟶ ⟶ NH4Não.3+4O2+H. H. H.2O(2 NH3 + 4 O3 -> NH4NO3 + 4 O2 + H2O}}}
NH4NO3 + 4 O2 + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/7a8f8dfe104ea9dfad94fed01835377b99c434f4" style="vertical-align: -1.005ex; width:42.282ex; height:2.843ex;"/>
O ozônio reage com o carbono para formar dióxido de carbono, mesmo em temperatura ambiente:
- CO2 + 2 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">C+2O3⟶ ⟶ ⟶ ⟶ CO2+2O2{displaystyle {ce {C + 2 O3 -> CO2 + 2 O2}}}
CO2 + 2 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/59c138053beeaf46269c61bee92d41b978d1bb3c" style="vertical-align: -1.005ex; width:25.819ex; height:2.843ex;"/>
Com compostos de enxofre
O ozônio oxida sulfetos a sulfatos. Por exemplo, sulfeto de chumbo(II) é oxidado a sulfato de chumbo(II):
- PbSO4 + 4 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">PbS+4O3⟶ ⟶ ⟶ ⟶ PbSO4+4O2(PbS + 4 O3 -> PbSO4 + 4 O2}}}
PbSO4 + 4 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/7616816f0ee82e468bd6c95b9ed8469ae5e85f1a" style="vertical-align: -1.005ex; width:30.799ex; height:2.843ex;"/>
O ácido sulfúrico pode ser produzido a partir de ozônio, água e enxofre elementar ou dióxido de enxofre:
- H2SO4}}\&{ce {3 SO2 + 3 H2O + O3 -> 3 H2SO4}}end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">S+H. H. H.2O+O3⟶ ⟶ ⟶ ⟶ H. H. H.2Então...43Então...2+3H. H. H.2O+O3⟶ ⟶ ⟶ ⟶ 3H. H. H.2Então...4(S + H2O + O3 -> H2SO4}}&{ce {3 SO2 + 3 H2O + O3 -> 3 H2SO4}}end{aligned}}}
H2SO4}}\&{ce {3 SO2 + 3 H2O + O3 -> 3 H2SO4}}end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6d5573c5f68f51d2ed4ad236617ec7d56d4969e9" style="vertical-align: -2.671ex; width:34.752ex; height:6.509ex;"/>
Na fase gasosa, o ozônio reage com sulfeto de hidrogênio para formar dióxido de enxofre:
- SO2 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">H. H. H.2S+O3⟶ ⟶ ⟶ ⟶ Então...2+H. H. H.2O(H2S + O3 -> SO2 + H2O}}}
SO2 + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e93f665f549b14bd893ea5d6e8f3c2553230488f" style="vertical-align: -1.005ex; width:26.489ex; height:2.843ex;"/>
Em uma solução aquosa, no entanto, duas reações simultâneas concorrentes ocorrem, uma para produzir enxofre elementar e outra para produzir ácido sulfúrico:
- S + O2 + H2O}}\&{ce {3 H2S + 4 O3 -> 3 H2SO4}}end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">H. H. H.2S+O3⟶ ⟶ ⟶ ⟶ S+O2+H. H. H.2O3H. H. H.2S+4O3⟶ ⟶ ⟶ ⟶ 3H. H. H.2Então...4{displaystyle {begin{aligned}&{ce {H2S + O3 -> S + O2 + H2O}}&{ce {3 H2S + 4 O3 -> 3 H2SO4}}end{aligned}}}
S + O2 + H2O}}\&{ce {3 H2S + 4 O3 -> 3 H2SO4}}end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/c26b2e4a04e421c0992b4c5fbf539caf6cafc8c3" style="vertical-align: -2.671ex; width:30.081ex; height:6.509ex;"/>
Com alcenos e alcinos
Os alcenos podem ser clivados oxidativamente pelo ozônio, em um processo chamado ozonólise, resultando em álcoois, aldeídos, cetonas e ácidos carboxílicos, dependendo da segunda etapa do processamento.
O ozônio também pode clivar alcinos para formar um produto de anidrido ácido ou dicetona. Se a reação for realizada na presença de água, o anidrido hidrolisa para dar dois ácidos carboxílicos.
Normalmente, a ozonólise é realizada em uma solução de diclorometano, a uma temperatura de -78°C. Após uma sequência de clivagem e rearranjo, forma-se um ozonídeo orgânico. Com processamento redutivo (por exemplo, zinco em ácido acético ou sulfeto de dimetila), cetonas e aldeídos serão formados, com processamento oxidativo (por exemplo, peróxido de hidrogênio aquoso ou alcoólico), ácidos carboxílicos serão formados.
Outros substratos
Todos os três átomos de ozônio também podem reagir, como na reação do cloreto de estanho(II) com ácido clorídrico e ozônio:
- 3 SnCl4 + 3 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">3SnCl2+6HCl+O3⟶ ⟶ ⟶ ⟶ 3SnCl4+3H. H. H.2O(3 SnCl2 + 6 HCl + O3 -> 3 SnCl4 + 3 H2O}}}
3 SnCl4 + 3 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/aeef117bb5c992319552513f1522c7adf630f764" style="vertical-align: -1.005ex; width:43.28ex; height:2.843ex;"/>
O perclorato de iodo pode ser feito tratando o iodo dissolvido em ácido perclórico anidro frio com ozônio:
- 2 I(ClO4)3 + 3 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">Eu...2+6HClO4+O3⟶ ⟶ ⟶ ⟶ 2Eu...(ClO4)3+3H. H. H.2O(I2 + 6 HClO4 + O3 -> 2 I(ClO4)3 + 3 H2O}}}
2 I(ClO4)3 + 3 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/100f61f0745fb7de735a5a4ba25a27f12d09e258" style="vertical-align: -1.005ex; width:43.448ex; height:3.009ex;"/>
O ozônio também pode reagir com iodeto de potássio para fornecer oxigênio e gás iodo que pode ser titulado para determinação quantitativa:
- 2KOH + O2 + I2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2KI+O3+H. H. H.2O⟶ ⟶ ⟶ ⟶ 2KOH+O2+Eu...2(2KI + O3 + H2O -> 2KOH + O2 + I2}}}
2KOH + O2 + I2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f1a4e3af55f95eeaeb899c352c3a5022b7eadb0c" style="vertical-align: -1.005ex; width:39.788ex; height:2.843ex;"/>
Combustão
O ozônio pode ser usado para reações de combustão e gases combustíveis; o ozônio fornece temperaturas mais altas do que a queima em dioxigênio (O2). O seguinte é uma reação para a combustão de subnitreto de carbono que também pode causar temperaturas mais altas:
- 12 CO + 3 N2}}}" xmlns="http://www.w3.org/1998/Math/MathML">3C4N2+4O3⟶ ⟶ ⟶ ⟶ 12CO+3N2(3 C4N2 + 4 O3 -> 12 CO + 3 N2}}}
12 CO + 3 N2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/a3375ddd7c369c19e2988dc348b43f0e6ecf68ba" style="vertical-align: -1.005ex; width:32.813ex; height:2.843ex;"/>
O ozônio pode reagir a temperaturas criogênicas. A 77 K (−196.2 °C; −321.1 °F), hidrogênio atômico reage com ozônio líquido para formar um radical superóxido de hidrogênio, que dimeriza:
- HO2 + O}}\&{ce {2 HO2 -> H2O4}}end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">H. H. H.+O3⟶ ⟶ ⟶ ⟶ Como?2+O2Como?2⟶ ⟶ ⟶ ⟶ H. H. H.2O4{displaystyle {begin{aligned}&{ce {H + O3 -> HO2 + O}}&{ce {2 HO2 -> H2O4}}end{aligned}}}
HO2 + O}}\&{ce {2 HO2 -> H2O4}}end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f4f244346d90613f745f65885be487cd2ce38d68" style="vertical-align: -2.671ex; width:22.547ex; height:6.509ex;"/>
Descomposição de ozono
Tipos de decomposição de ozônio
O ozônio é uma substância tóxica, comumente encontrada ou gerada em ambientes humanos (cabinas de aeronaves, escritórios com fotocopiadoras, impressoras a laser, esterilizadores...) e sua decomposição catalítica é muito importante para reduzir a poluição. Este tipo de decomposição é o mais amplamente utilizado, especialmente com catalisadores sólidos, e tem muitas vantagens, como uma conversão mais elevada com uma temperatura mais baixa. Além disso, o produto e o catalisador podem ser instantaneamente separados, e desta forma o catalisador pode ser facilmente recuperado sem utilizar qualquer operação de separação. Além disso, os materiais mais utilizados na decomposição catalítica do ozônio na fase de gás são metais nobres como Pt, Rh ou Pd e metais de transição como Mn, Co, Cu, Fe, Ni ou Ag.
Existem outras duas possibilidades para a decomposição de ozônio na fase gasosa:
O primeiro é uma decomposição térmica onde o ozônio pode ser decomposto usando apenas a ação do calor. O problema é que este tipo de decomposição é muito lento com temperaturas abaixo de 250 °C. No entanto, a taxa de decomposição pode ser aumentada trabalhando com temperaturas mais altas, mas isso envolveria um alto custo de energia.
A segunda é uma decomposição fotoquímica, que consiste em irradiar ozônio com radiação ultravioleta (UV) e dá origem a oxigênio e peróxido radical.
Cinética de decomposição de ozônio em oxigênio molecular
O processo de decomposição de ozônio é uma reação complexa envolvendo duas reações elementares que finalmente levam ao oxigênio molecular, e isso significa que a ordem da reação e a lei da taxa não podem ser determinadas pela esteichiometria da equação ajustada.
Reação geral: 3 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2O3⟶ ⟶ ⟶ ⟶ 3O2(2 O3 -> 3 O2}}} 3 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/0f3268e8184ee9b5158d4546a8d6f1ae691649b8" style="vertical-align: -1.005ex; width:13.92ex; height:2.843ex;"/>
Taxa de lei (observado): V= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK)) Não.O3]2Não.O2]Não. V. {Kcdot [{ce {O3}}]^{2}}{[{ce {O2}}}}}}}}
Foi determinado que a decomposição de ozônio segue uma cinética de primeira ordem, e da lei de taxa acima pode ser determinado que a ordem parcial respeito ao oxigênio molecular é -1 e respeito ao ozônio é 2, portanto, a ordem de reação global é 1.
A decomposição do ozônio consiste em duas etapas elementares: O primeiro corresponde a uma reação unimolecular porque uma única molécula de ozônio se decompõe em dois produtos (o oxigênio molecular e oxigênio). Então, o oxigênio do primeiro passo é um intermediário porque participa como um reagente no segundo passo, que é uma reação bimolecular porque há dois reagentes diferentes (ozono e oxigênio) que dão origem a um produto, que corresponde ao oxigênio molecular na fase de gás.
Passo 1: Reação unimolecular O2 + O}}}" xmlns="http://www.w3.org/1998/Math/MathML">O3⟶ ⟶ ⟶ ⟶ O2+O(O3 -> O2 + O}}} O2 + O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e3d2106eac5b81c2ea5aff7940c3213f61bb7945" style="vertical-align: -1.005ex; width:15.469ex; height:2.843ex;"/>
Passo 2: Reação Bimolecular 2 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">O3+O⟶ ⟶ ⟶ ⟶ 2O2(O3 + O -> 2 O2}}} 2 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/37d1aad75b2d9dd6f113ec751ba3f54e75146a2b" style="vertical-align: -1.005ex; width:17.019ex; height:2.843ex;"/>
Estes dois passos têm diferentes taxas de reação, o primeiro é reversível e mais rápido do que a segunda reação, que é mais lenta, então isso significa que o passo determinante é a segunda reação e isso é usado para determinar a taxa de reação observada. As leis de taxa de reação para cada etapa são as que seguem:
- V1= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK1)) Não.O3]V2= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK2)) Não.O])) Não.O3]Não. V_{1}=K_{1}cdot [{ce {O3}}]qquad V_{2}=K_{2}cdot [{ce {O}}]cdot [{ce {O3}}]}
O seguinte mecanismo permite explicar a lei de taxa da decomposição de ozônio observada experimentalmente, e também permite determinar as ordens de reação em relação ao ozônio e oxigênio, com que a ordem de reação global será determinada. O passo mais lento, a reação bimolecular, é o que determina a taxa de formação do produto, e considerando que este passo dá origem a duas moléculas de oxigênio a lei da taxa tem esta forma:
- V= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =2KK2)) Não.O])) Não.O3]Não. V=2K_{2}cdot [{ce {O}}]cdot [{ce {O3}}]}
No entanto, essa equação depende da concentração de oxigênio (intermediário), que pode ser determinada considerando o primeiro passo. Uma vez que o primeiro passo é mais rápido e reversível e o segundo passo é mais lento, os reagentes e produtos da primeira etapa estão em equilíbrio, de modo que a concentração do intermediário pode ser determinada da seguinte forma:
- KK1= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK1KK- Sim. - Sim. 1= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.O2])) Não.O]Não.O3]Não. K_{1}={frac {K_{1}}{K_{-1}}}={frac [[{ce {O2}}]cdot [{ce {O}}]}{[{ce {O3}}}}}}}}
- Não.O]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK1)) Não.O3]KK- Sim. - Sim. 1)) Não.O2]Não. [E] frac {K_{1}cdot [{ce {O3}}] }{K_{-1}cdot [#2}}]
Em seguida, usando essas equações, a taxa de formação de oxigênio molecular é como mostrado abaixo:
- V= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =2KK2)) KK1)) Não.O3]2KK- Sim. - Sim. 1)) Não.O2]Não. V={2K_{2}cdot K_{1}cdot [{ce {O_3}}]^{2} over K_{-1}cdot [#2}}]
Finalmente, o mecanismo apresentado permite estabelecer a taxa observada experimentalmente, com uma taxa constante (KKobs) e correspondente a uma cinética de primeira ordem, como segue:
- V= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KKobs)) Não.O3]2Não.O2]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KKobs)) Não.O3]2)) Não.O2]- Sim. - Sim. 1Não. V={K_{text{obs}}cdot [{ce {O_3}}}^{2} over [{ce {O_2}}}=K_{text{obs}}cdot [{ce {O_3}}]^{2}cdot [{ce {O_2}}]^{-1}}]
Onde? KKobs= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =2KK2)) KK1KK- Sim. - Sim. 1Não. K_{text{obs}}={2K_{2}cdot K_{1} over K_{-1}}}
Redução de ozonides
A redução do ozono dá o ozonide anion, O- Sim.3. Os derivados deste anion são explosivos e devem ser armazenados em temperaturas criogênicas. Ozonides para todos os metais alcalinos são conhecidos. KO3, RbO3e COSSO3 pode ser preparado a partir de seus respectivos superóxidos:
- KO3 + O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">KO2+O3⟶ ⟶ ⟶ ⟶ KO3+O2(KO2 + O3 -> KO3 + O2}}}
KO3 + O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/4290621d41c5c85e4ba2f7329f537e077fb00d1a" style="vertical-align: -1.005ex; width:25.842ex; height:2.843ex;"/>
Embora KO3 possa ser formado como acima, também pode ser formado a partir de hidróxido de potássio e ozônio:
- 2 KO3 + 5 O2 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">2KOH+5O3⟶ ⟶ ⟶ ⟶ 2KO3+5O2+H. H. H.2O(2 KOH + 5 O3 -> 2 KO3 + 5 O2 + H2O}}}
2 KO3 + 5 O2 + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/ad8fa1337fac9b9216a2d088154c33f01b2e0b1b" style="vertical-align: -1.005ex; width:40.175ex; height:2.843ex;"/>
Nao3 e Lio.3 deve ser preparado por ação de COSSO3 em líquido NH3 em resina de troca de íons contendo Nao+ ou Li+ íons:
- Cs+ + NaO3}}}" xmlns="http://www.w3.org/1998/Math/MathML">COSSO3+Nao+⟶ ⟶ ⟶ ⟶ C++Nao3Não. {CsO3 + Na+ -> Cs+ + NaO3}}}
Cs+ + NaO3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/5a800166579e1147be033561064bc555e48b5b8c" style="vertical-align: -1.005ex; width:30.523ex; height:3.176ex;"/>
Uma solução de cálcio em amônia reage com ozono para dar ozonide de amônio e não ozonide de cálcio:
- }}&{ce {Ca*6NH3 + Ca(OH)2 + Ca(NO3)2}}\&+{ce {2 NH4O3 + 2 O2 + H2}}end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">3Ca.+10.NH3+6O3⟶ ⟶ ⟶ ⟶ Ca.)) 6NH3+Ca.(Oh!)2+Ca.(Não.3)2+2NH4O3+2O2+H. H. H.2{displaystyle {begin{aligned}{ce {3 Ca + 10 NH3 + 6 O3 -> }}&{ce {Ca*6NH3 + Ca(OH)2 + Ca(NO3)2}}&+{ce {2 NH4O3 + 2 O2 + H2}}end{aligned}}}
}}&{ce {Ca*6NH3 + Ca(OH)2 + Ca(NO3)2}}\&+{ce {2 NH4O3 + 2 O2 + H2}}end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/3a5dbe80fd9607f5a65421362d2ac6a6c725650c" style="vertical-align: -2.671ex; width:64.019ex; height:6.509ex;"/>
Aplicações
Ozônio pode ser usado para remover ferro e manganês da água, formando um precipitado que pode ser filtrado:
- 2 Fe(OH)3_{(s)}{}+ O2{}+ 4 H+}}\&{ce {2 Mn^2+{}+ 2 O3 + 4 H2O -> 2 MnO(OH)2_{(s)}{}+ 2 O2{}+ 4 H+}}end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">2Fe2++O3+5H. H. H.2O⟶ ⟶ ⟶ ⟶ 2Fe(Oh!)3(S)+O2+4H. H. H.+2Mn.2++2O3+4H. H. H.2O⟶ ⟶ ⟶ ⟶ 2Mn.(Oh!)2(S)+2O2+4H. H. H.+{displaystyle {begin{aligned}&{ce {2 Fe^2+{}+ O3 + 5 H2O -> 2 Fe(OH)3_{(s)}{}+ O2 4 H+}}&{ce {2 Mn^2+{}+ 2 O3 + 4 H2O -> 2 MnO(OH)2_{(s)}{}+ 2 O2{}+ 4 H+}}end{aligned}}}
2 Fe(OH)3_{(s)}{}+ O2{}+ 4 H+}}\&{ce {2 Mn^2+{}+ 2 O3 + 4 H2O -> 2 MnO(OH)2_{(s)}{}+ 2 O2{}+ 4 H+}}end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/5f34b0246999ba3d6a5784cf8a0df81cf40619ed" style="vertical-align: -3.338ex; width:59.42ex; height:7.843ex;"/>
O ozônio também oxidará o sulfeto de hidrogênio dissolvido em água ao ácido sulfuroso:
- H2SO3 + 3 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">3O3+H. H. H.2S⟶ ⟶ ⟶ ⟶ H. H. H.2Então...3+3O2(3 O3 + H2S -> H2SO3 + 3 O2}}}
H2SO3 + 3 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/88fbafe7db5425b88d792aaa0eb3076d140ead83" style="vertical-align: -1.005ex; width:30.643ex; height:2.843ex;"/>
Estas três reações são centrais no uso de tratamento de água de poço com base em ozônio.
O ozônio também desintoxicará cianides convertendo-os em cianatos.
- CNO- + O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">N.°- Sim. - Sim. +O3⟶ ⟶ ⟶ ⟶ CNO- Sim. - Sim. +O2(CN- + O3 -> CNO- + O2}}}
CNO- + O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/3b501e1f917376acc46b69677183497c10ed9c20" style="vertical-align: -1.005ex; width:28.174ex; height:3.176ex;"/>
O ozônio também irá decompor completamente a ureia:
- N2 + CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">(NH2)2CO+O3⟶ ⟶ ⟶ ⟶ N2+CO2+2H. H. H.2O(NH2)2CO + O3 -> N2 + CO2 + 2 H2O}}}
N2 + CO2 + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/011375bb817b5edb30136089908ae30a4531f5f7" style="vertical-align: -1.005ex; width:40.862ex; height:3.009ex;"/>
Propriedades espectroscópicas
Ozônio é uma molécula triatômica dobrada com três modos vibracionais: o estiramento simétrico (1103.157 cm- Sim.), dobra (701.42 cm- Sim.) e estiramento antissimétrico (1042.096 cm)- Sim.). O estiramento simétrico e a curva são absorvedores fracos, mas o estiramento antissimétrico é forte e responsável pelo ozônio ser um importante gás de efeito estufa menor. Esta banda IR também é usada para detectar ozônio ambiente e atmosférico, embora as medições baseadas em UV sejam mais comuns.
O espectro eletromagnético do ozônio é bastante complexo. Uma visão geral pode ser vista no MPI Mainz UV/VIS Spectral Atlas de moléculas ósseas de interesse atmosférico.
Todas as bandas são dissociativas, o que significa que a molécula cai O + O2 depois de absorver um fóton. A absorção mais importante é a banda Hartley, estendendo-se de ligeiramente acima de 300 nm para baixo para ligeiramente acima de 200 nm. É esta banda que é responsável por absorver UV C na estratosfera.
No lado alto do comprimento de onda, a banda Hartley transiciona para a chamada banda Huggins, que cai rapidamente até desaparecer por ~360 nm. Acima de 400 nm, estendendo-se bem para o NIR, são as bandas de Chappius e Wulf. Lá, bandas de absorção não estruturadas são úteis para detectar altas concentrações ambientais de ozônio, mas são tão fracas que não têm muito efeito prático.
Há bandas de absorção adicionais no UV distante, que aumentam lentamente de 200 nm para baixo para alcançar um máximo em ~ 120 nm.
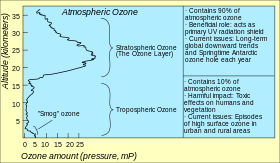
Ozônio na atmosfera da Terra
A maneira padrão de expressar níveis de ozônio total (a quantidade de ozônio em uma determinada coluna vertical) na atmosfera é usando unidades Dobson. As medições de pontos são relatadas como frações de toupeira em nmol/mol (partes por bilhão, ppb) ou como concentrações em μg/m3. O estudo da concentração de ozônio na atmosfera começou na década de 1920.
Camada de ozono
Localização e produção
Os níveis mais altos de ozônio na atmosfera estão na estratosfera, em uma região também conhecida como camada de ozônio entre cerca de 10 e 50 km acima da superfície (ou entre cerca de 6 e 31 milhas). No entanto, mesmo nesta "camada", as concentrações de ozônio são apenas duas a oito partes por milhão, então a maioria do oxigênio há dioxigênio, O2, em cerca de 210.000 partes por milhão por volume.
O ozônio na estratosfera é produzido principalmente a partir de raios ultravioletas de ondas curtas entre 240 e 160 nm. O oxigênio começa a absorver fracamente em 240 nm nas bandas de Herzberg, mas a maioria do oxigênio é associado pela absorção nas fortes bandas Schumann-Runge entre 200 e 160 nm, onde o ozônio não absorve. Enquanto a luz de comprimento de onda mais curta, estendendo-se até o limite X-Ray, é energética o suficiente para dissociar o oxigênio molecular, há relativamente pouco dele, e, a forte emissão solar em Lyman-alpha, 121 nm, cai em um ponto onde a absorção de oxigênio molecular é um mínimo.
O processo de criação e destruição de ozônio é chamado de ciclo de Chapman e começa com a fotólise de oxigênio molecular
- [{ce {photon}}][({ce {radiation}} lambda O2→(radiaçãoλ λ <240Não.)foton2O{displaystyle {ce {O2->[{ce {photon}}][({ce {radiation}}\lambda < 240 {ce {nm}}]2O}}}
[{ce {photon}}][({ce {radiation}} lambda
seguido pela reação do átomo de oxigênio com outra molécula de oxigênio para formar o ozônio.
- O3 + M}}}" xmlns="http://www.w3.org/1998/Math/MathML">O+O2+M⟶ ⟶ ⟶ ⟶ O3+M(O + O2 + M -> O3 + M}}}
O3 + M}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/910c33566e7e39fa63167948913e408d2aca0abd" style="vertical-align: -1.005ex; width:25.412ex; height:2.843ex;"/>
onde "M" denota o terceiro corpo que executa o excesso de energia da reação. A molécula de ozônio pode então absorver um fóton UV-C e dissociar
- O + O2}}+{text{kinetic energy}}}" xmlns="http://www.w3.org/1998/Math/MathML">O3⟶ ⟶ ⟶ ⟶ O+O2+energia cinética(O3 -> O + O2}} + energia cinética}}}
O + O2}}+{text{kinetic energy}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/501d60c6a35d165d571e6f1e47db722e06afcfab" style="vertical-align: -1.005ex; width:32.332ex; height:2.843ex;"/>
O excesso de energia cinética aquece a estratosfera quando os átomos O e o oxigênio molecular voam separados e colidem com outras moléculas. Esta conversão de luz UV em energia cinética aquece a estratosfera. Os átomos de oxigênio produzidos na fotólise do ozônio, em seguida, reagem com outra molécula de oxigênio como no passo anterior para formar mais ozônio. Na atmosfera clara, com apenas nitrogênio e oxigênio, o ozônio pode reagir com o oxigênio atômico para formar duas moléculas de O2:
- 2 O2}}}" xmlns="http://www.w3.org/1998/Math/MathML">O3+O⟶ ⟶ ⟶ ⟶ 2O2(O3 + O -> 2 O2}}}
2 O2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/37d1aad75b2d9dd6f113ec751ba3f54e75146a2b" style="vertical-align: -1.005ex; width:17.019ex; height:2.843ex;"/>
Uma estimativa da taxa desta etapa de terminação para o ciclismo de oxigênio atômico de volta ao ozônio pode ser encontrada simplesmente tomando as razões da concentração de O2 para O3. A reação de terminação é catalisada pela presença de certos radicais livres, dos quais os mais importantes são hidroxila (OH), óxido nítrico (NO) e cloro atômico (Cl) e bromo (Br). Na segunda metade do século XX, descobriu-se que a quantidade de ozônio na estratosfera estava em declínio, principalmente devido ao aumento das concentrações de clorofluorocarbonos (CFC) e moléculas orgânicas cloradas e brominadas semelhantes. A preocupação sobre os efeitos da saúde do declínio levou ao Protocolo de Montreal de 1987, a proibição da produção de muitos produtos químicos de descarte de ozônio e na primeira e segunda década do século XXI o início da recuperação de concentrações de ozônio estratosférico.
Importância para a vida residente na superfície na Terra

Ozônio na camada de ozônio filtra os comprimentos de onda de luz solar de cerca de 200 nm raios UV a 315 nm, com absorção de pico de ozônio em cerca de 250 nm. Esta absorção de UV de ozônio é importante para a vida, uma vez que estende a absorção de UV por oxigênio comum e nitrogênio no ar (que absorve todos os comprimentos de onda < 200 nm) através do UV-C inferior (200-280 nm) e toda a banda UV-B (280-315 nm). A pequena parte não absorvida que permanece de UV-B após a passagem através do ozônio causa queimadura solar em humanos, e danos diretos do DNA em tecidos vivos em plantas e animais. O efeito do ozônio nos raios UV-B de gama média é ilustrado pelo seu efeito sobre o UV-B em 290 nm, que tem uma intensidade de radiação 350 milhões de vezes tão poderosa no topo da atmosfera como na superfície. No entanto, o suficiente de radiação UV-B em frequência semelhante atinge o chão para causar alguma queimadura solar, e esses mesmos comprimentos de onda também estão entre os responsáveis pela produção de vitamina D em seres humanos.
A camada de ozônio tem pouco efeito sobre os comprimentos de onda UV mais longos chamados UV-A (315-400 nm), mas esta radiação não causa queimaduras solares ou danos diretos ao DNA, e embora provavelmente cause danos cutâneos a longo prazo em certos seres humanos, não é tão perigoso para as plantas e para a saúde de organismos que habitam a superfície na Terra em geral (ver ultravioleta para mais informações sobre o próximo ultravioleta).
Ozônio de baixo nível
Ozônio de baixo nível (ou ozônio troposférico) é um poluente atmosférico. Não é emitido diretamente por motores de carro ou por operações industriais, mas formado pela reação da luz solar no ar contendo hidrocarbonetos e óxidos de nitrogênio que reagem para formar o ozônio diretamente na fonte da poluição ou muitos quilômetros downwind.
O ozônio reage diretamente com alguns hidrocarbonetos, como aldeídos e assim começa a sua remoção do ar, mas os produtos são eles próprios componentes-chave de fumo. A fotólise de ozônio por luz UV leva à produção do HO• radical hidroxil e isso desempenha um papel na remoção de hidrocarbonetos do ar, mas também é o primeiro passo na criação de componentes de smog, como nitratos de peroxiacyl, que podem ser irritantes oculares poderosos. A vida atmosférica do ozônio troposférico é de cerca de 22 dias; seus principais mecanismos de remoção estão sendo depositados no chão, a reação acima mencionada dando HO•, e por reações com OH e o radical peroxi HO2•.
Há evidências de redução significativa nos rendimentos agrícolas por causa do aumento do ozônio e poluição no nível do solo que interfere com a fotossíntese e acrobacias crescimento global de algumas espécies de plantas. A Agência de Proteção Ambiental dos Estados Unidos (EPA) propôs um regulamento secundário para reduzir os danos nas culturas, além do regulamento primário projetado para a proteção da saúde humana.
Ozônio de baixo nível em áreas urbanas
Alguns exemplos de cidades com leituras de ozônio elevadas são Denver, Colorado; Houston, Texas; e Cidade do México, México. Houston tem uma leitura de cerca de 41 nmol/mol, enquanto a Cidade do México é muito mais perigosa, com uma leitura de cerca de 125 nmol/mol.
O ozônio de baixo nível, ou ozônio troposférico, é o tipo mais relacionado com a poluição do ozônio em áreas urbanas e está aumentando em geral. A poluição do ozônio em áreas urbanas afeta populações mais densas, e é agravada por altas populações de veículos, que emitem poluentes NÃO2 e VOCs, os principais contribuintes para níveis problemáticos de ozônio. A poluição do ozônio em áreas urbanas é especialmente relacionada com o aumento das temperaturas, aumentando a mortalidade relacionada ao calor durante as ondas de calor. Durante as ondas de calor em áreas urbanas, a poluição do ozônio do nível do solo pode ser 20% maior do que o habitual. A poluição do ozono nas áreas urbanas atinge níveis mais elevados de superação no verão e no outono, o que pode ser explicado por padrões climáticos e padrões de tráfego. As pessoas que sofrem a pobreza são mais afetadas pela poluição em geral, embora essas populações estejam menos propensas a contribuir para os níveis de poluição.
Como mencionado acima, Denver, Colorado, é uma das muitas cidades nos EUA que têm altas quantidades de ozônio. De acordo com a American Lung Association, a área de Denver-Aurora é a 14a área mais poluída de ozônio nos EUA. O problema dos altos níveis de ozônio não é novo para esta área. Em 2004, o EPA alocou o Denver Metro/North Front Range como áreas de não-atenção por padrão de ozônio de 8 horas de 1997, mas mais tarde diferiu esse status até 2007. O padrão de não-atenção indica que uma área não atende aos padrões de qualidade do ar da EPA. O Plano de Ação do Ozônio do Colorado foi criado em resposta, e numerosas mudanças foram implementadas a partir deste plano. A primeira grande mudança foi que o teste de emissão de automóveis foi expandido em todo o estado para mais condados que não anteriormente mandavam testes de emissões, como áreas de Larimer e Weld County. Houve também mudanças feitas para diminuir os óxidos de nitrogênio (NOx) e as emissões de compostos orgânicos voláteis (VOC), que devem ajudar a reduzir os níveis de ozônio.
Um grande contribuinte para altos níveis de ozônio na área é a indústria de petróleo e gás natural situada na bacia de Denver-Julesburg (DJB), que se sobrepõe com a maioria das áreas metropolitanas do Colorado. O ozônio é criado naturalmente na estratosfera da Terra, mas também é criado na troposfera dos esforços humanos. Brevemente mencionado acima, NOx e VOCs reagem com luz solar para criar ozônio através de um processo chamado fotoquímica. Uma hora os eventos de ozônio elevados (<75 ppb) "ocorrem durante junho-agosto indicando que os níveis elevados de ozônio são impulsionados pela fotoquímica regional". De acordo com um artigo da Universidade de Colorado-Boulder, "A emissão de VOC de petróleo e gás natural têm um papel importante na produção de ozônio e têm o potencial de contribuir para o elevado O3 níveis na Cordilheira Norte do Colorado (NCFR)". Usando análises complexas para pesquisar padrões de vento e emissões de grandes operações de petróleo e gás natural, os autores concluíram que "elevado O3 Os níveis no NCFR estão predominantemente correlacionados com o transporte aéreo de N- ESE, que são os setores de vento em que as operações de O&NG na área de Wattenberg Field do DJB estão localizadas".
Contida no Plano de Ação de Ozônio do Colorado, criado em 2008, existem planos para avaliar "controles de emissão para grandes fontes industriais de NOx" e "requisitos de controle em todo o estado para novos tanques de condensado de petróleo e gás e válvulas pneumáticas". Em 2011, o Plano Regional de Haze foi lançado que incluiu um plano mais específico para ajudar a diminuir as emissões de NOx. Estes esforços são cada vez mais difíceis de implementar e levar muitos anos para passar. Claro que há também outras razões que os níveis de ozônio permanecem altos. Estes incluem: uma população em crescimento que significa mais emissões de automóveis, e as montanhas ao longo do NCFR que podem capturar as emissões. Se estiver interessado, as leituras diárias de qualidade do ar podem ser encontradas no site do Departamento de Saúde Pública e Meio Ambiente do Colorado. Como observado anteriormente, Denver continua a experimentar altos níveis de ozônio até hoje. Vai levar muitos anos e uma abordagem de pensamento de sistemas para combater esta questão de altos níveis de ozônio na Faixa de Frente do Colorado.
Quebra de ozônio
O gás de ozônio ataca qualquer polímero que possua ligações olefinicas ou duplas dentro de sua estrutura de cadeia, tais como borracha natural, borracha nitrílica e borracha styrene-butadiene. Os produtos feitos usando esses polímeros são especialmente suscetíveis ao ataque, o que faz com que as rachaduras cresçam mais e mais profundas com o tempo, a taxa de crescimento de crack dependendo da carga transportada pelo componente de borracha e a concentração de ozônio na atmosfera. Tais materiais podem ser protegidos adicionando antiozonantes, como ceras, que se ligam à superfície para criar uma película protetora ou misturar com o material e fornecer proteção a longo prazo. O cracking de ozônio costumava ser um problema sério em pneus de carro, por exemplo, mas não é um problema com pneus modernos. Por outro lado, muitos produtos críticos, como juntas e anéis-O, podem ser atacados por ozônio produzido dentro de sistemas de ar comprimido. As linhas de combustível feitas de borracha reforçada também são susceptíveis a atacar, especialmente dentro do compartimento do motor, onde algum ozônio é produzido por componentes elétricos. Armazenar produtos de borracha em estreita proximidade com um motor elétrico DC pode acelerar a quebra de ozônio. O comutador do motor gera faíscas que por sua vez produzem ozônio.
Ozônio como um gás de efeito estufa
Embora o ozônio estivesse presente no nível do solo antes da Revolução Industrial, as concentrações de pico são agora muito maiores do que os níveis pré-industriais, e até mesmo as concentrações de fundo bem longe de fontes de poluição são substancialmente maiores. O ozônio atua como um gás de efeito estufa, absorvendo algumas das energias infravermelhas emitidas pela terra. Quantificar a potência do gás de efeito estufa do ozônio é difícil porque não está presente em concentrações uniformes em todo o mundo. No entanto, as avaliações científicas mais amplamente aceitas relativas às alterações climáticas (por exemplo, o Painel Intergovernamental sobre o Terceiro Relatório de Avaliação das Alterações Climáticas) sugerem que o forçamento radiativo do ozono troposférico é de cerca de 25% do dióxido de carbono.
O potencial de aquecimento global anual de ozônio troposférico é entre 918 e 1022 toneladas de dióxido de carbono equivalente / toneladas de ozônio troposférico. Isso significa, em uma base por molécula, o ozônio na troposfera tem um efeito de força radiativo aproximadamente 1.000 vezes mais forte que o dióxido de carbono. No entanto, o ozônio troposférico é um gás de efeito estufa de curta duração, que decai na atmosfera muito mais rapidamente do que o dióxido de carbono. Isso significa que, ao longo de um período de 20 anos, o potencial de aquecimento global de ozônio troposférico é muito menos, aproximadamente 62 a 69 toneladas de dióxido de carbono equivalente / toneladas de ozônio troposférico.
Devido à sua natureza de curta duração, o ozônio troposférico não tem efeitos globais fortes, mas tem efeitos de força radiativa muito fortes em escalas regionais. Na verdade, há regiões do mundo onde o ozônio troposférico tem um força radiativa de até 150% do dióxido de carbono. Por exemplo, o aumento do ozônio na troposfera é mostrado ser responsável por ~30% do aquecimento interior do Oceano Sul superior entre 1955 e 2000.
Efeitos de saúde
Nas últimas décadas, os cientistas estudaram os efeitos da exposição ao ozônio agudo e crônico sobre a saúde humana. Centenas de estudos sugerem que o ozônio é prejudicial para as pessoas em níveis atualmente encontrados em áreas urbanas. O ozônio tem sido mostrado para afetar o sistema nervoso respiratório, cardiovascular e central. A morte precoce e os problemas na saúde reprodutiva e desenvolvimento também são mostrados associados à exposição ao ozônio.
Populações vulneráveis
A American Lung Association identificou cinco populações especialmente vulneráveis aos efeitos do ozônio respiratório:
- Crianças e adolescentes
- Pessoas 65 anos de idade e mais
- Pessoas que trabalham ou exercem ao ar livre
- Pessoas com doenças pulmonares existentes, como asma e doença pulmonar obstrutiva crônica (também conhecida como DPOC, que inclui enfisema e bronquite crônica)
- Pessoas com doença cardiovascular
Evidências adicionais sugerem que as mulheres, aquelas com obesidade e populações de baixa renda também podem enfrentar maior risco do ozônio, embora mais pesquisas sejam necessárias.
Exposição de ozono aguda
A exposição ao ozono aguda varia de horas a alguns dias. Porque o ozônio é um gás, afeta diretamente os pulmões e todo o sistema respiratório. O ozônio inalado causa inflamação e aguda - mas reversível - alterações na função pulmonar, bem como hiperresponsabilidade das vias aéreas. Estas mudanças levam à falta de ar, sibilância e tosse que podem exacerbar doenças pulmonares, como asma ou doença pulmonar obstrutiva crônica (DPOC) resultando na necessidade de receber tratamento médico. A exposição aguda e crônica ao ozônio mostrou-se para causar um aumento do risco de infecções respiratórias, devido ao seguinte mecanismo.
Foram realizados vários estudos para determinar o mecanismo por trás dos efeitos nocivos do ozônio, particularmente nos pulmões. Estes estudos mostraram que a exposição ao ozônio causa mudanças na resposta imunológica dentro do tecido pulmonar, resultando em ruptura tanto da resposta imunológica inata quanto adaptativa, bem como alterando a função protetora das células epiteliais pulmonares. Acredita-se que essas mudanças na resposta imune e a resposta inflamatória relacionada são fatores que provavelmente contribuem para o aumento do risco de infecções pulmonares, e agravamento ou desencadeamento de asma e vias aéreas reativas após exposição à poluição do ozônio no nível do solo.
O sistema imunológico inato (celular) consiste em vários sinais químicos e tipos de células que funcionam de forma ampla e contra vários tipos patogénicos, tipicamente bactérias ou corpos estranhos / substâncias no hospedeiro. As células do sistema inato incluem fagócitos, neutrófilos, ambos pensados para contribuir para o mecanismo de patologia do ozônio nos pulmões, como o funcionamento desses tipos de células tem sido mostrado para mudar após a exposição ao ozônio. Os macrófagos, células que servem o propósito de eliminar patógenos ou materiais estranhos através do processo de "fagocitose", têm sido mostrados para alterar o nível de sinais inflamatórios que liberam em resposta ao ozônio, tanto up-regulating quanto resultando em uma resposta inflamatória no pulmão, ou down-regulating e reduzindo a proteção imunológica. Neutrophils, outro tipo importante de célula do sistema imunológico inato que visa principalmente patógenos bacterianos, são encontrados para estar presente nas vias aéreas dentro de 6 horas de exposição a altos níveis de ozônio. Apesar de altos níveis nos tecidos pulmonares, no entanto, sua capacidade de limpar bactérias parece prejudicada pela exposição ao ozônio.
O sistema imunológico adaptativo é o ramo da imunidade que fornece proteção a longo prazo através do desenvolvimento de anticorpos que visam patógenos específicos e também é impactado pela exposição de alto ozônio. Os linfócitos, um componente celular da resposta imunológica adaptativa, produzem uma quantidade aumentada de substâncias químicas inflamatórias chamadas "citocinas" após a exposição ao ozônio, o que pode contribuir para a hiperreatividade da via aérea e agravar os sintomas da asma.
As células epiteliais da via aérea também desempenham um papel importante na proteção de indivíduos de patógenos. No tecido normal, a camada epitelial forma uma barreira protetora, e também contém estruturas ciliares especializadas que trabalham para limpar corpos estranhos, muco e patógenos dos pulmões. Quando exposto ao ozônio, a cília se torna danificada e a folga mucociliar dos patógenos é reduzida. Além disso, a barreira epitelial torna-se enfraquecida, permitindo que os patógenos cruzem a barreira, proliferam e se espalhem em tecidos mais profundos. Juntos, essas mudanças na barreira epitelial ajudam a tornar os indivíduos mais suscetíveis a infecções pulmonares.
Inalar o ozônio não só afeta o sistema imunológico e pulmões, mas também pode afetar o coração também. O ozônio causa desequilíbrio autonômico de curto prazo levando a mudanças na freqüência cardíaca e redução na variabilidade da frequência cardíaca; e a exposição de altos níveis por tão pouco quanto um-hora resulta em uma arritmia supraventricular em idosos, tanto aumentar o risco de morte prematura e acidente vascular cerebral. O ozônio também pode levar à vasoconstrição, resultando no aumento da pressão arterial sistêmica, contribuindo para o aumento do risco de morbidade cardíaca e mortalidade em pacientes com doenças cardíacas pré-existentes.
Exposição crônica do ozono
Respirar o ozônio por períodos mais de oito horas de cada vez por semanas, meses ou anos define a exposição crônica. Numerosos estudos sugerem um impacto sério na saúde de várias populações dessa exposição.
Um estudo encontra associações positivas significativas entre o ozônio crônico e todas as causas, mortalidade circulatória e respiratória com 2%, 3% e 12% aumenta em risco por 10 ppb e relata uma associação (IC 95%) de ozônio anual e mortalidade por todas as causas com relação de risco de 1.02 (1,01-1,04), e com mortalidade cardiovascular de 1.03 (1,01-1,05). Um estudo semelhante encontra associações semelhantes com mortalidade por todas as causas e efeitos ainda maiores para a mortalidade cardiovascular. Um aumento do risco de mortalidade por causas respiratórias está associado à exposição crônica a longo prazo ao ozônio.
O ozônio crônico tem efeitos prejudiciais em crianças, especialmente aqueles com asma. O risco de internação em crianças com asma aumenta com a exposição crônica ao ozônio; as crianças mais jovens e as com baixa renda estão ainda em maior risco.
Os adultos que sofrem de doenças respiratórias (asma, DPOC, câncer de pulmão) estão em maior risco de mortalidade e morbidade e pacientes com doença crítica têm maior risco de desenvolver síndrome de sofrimento respiratório agudo com exposição ao ozônio crônica também.
Ozônio produzido por limpadores de ar
Geradores de ozônio vendidos como limpadores de ar intencionalmente produzem o ozônio de gás. Estes são frequentemente comercializados para controlar a poluição do ar interior e usar termos enganosos para descrever o ozônio. Alguns exemplos estão descrevendo-o como "oxigeno energético" ou "ar puro", sugerindo que o ozônio é um tipo saudável ou "melhor" de oxigênio. No entanto, de acordo com o EPA, "ozônio não é eficaz na remoção de muitos produtos químicos que causam odor" e "não remove eficazmente vírus, bactérias, moldes ou outros poluentes biológicos". Além disso, outro relatório afirma que "os resultados de alguns estudos controlados mostram que as concentrações de ozônio consideravelmente mais altas do que essas normas [segurança humana] são possíveis mesmo quando um usuário segue as instruções operacionais do fabricante".
O California Air Resources Board tem uma página listando limpadores de ar (muitos com ionizadores) atingindo seu limite de ozônio interno de 0,050 partes por milhão. A partir desse artigo:
| Todos os dispositivos portáteis de limpeza de ar interior vendidos na Califórnia devem ser certificados pelo California Air Resources Board (CARB). Para ser certificado, os limpadores de ar devem ser testados para a segurança elétrica e as emissões de ozônio, e atender a um limite de concentração de emissão de ozônio de 0,050 partes por milhão. Para mais informações sobre o regulamento, visite o regulamento de limpeza de ar. |
Poluição do ar por ozono
Os precursores do ozônio são um grupo de poluentes, predominantemente aqueles emitidos durante a combustão de combustíveis fósseis. A poluição de ozônio de nível térreo (ozôniotroposférico) é criada perto da superfície da Terra pela ação dos raios UV de luz do dia nestes precursores. O ozônio no nível do solo é principalmente de precursores de combustíveis fósseis, mas o metano é um precursor natural, e o nível de fundo natural muito baixo do ozônio no nível do solo é considerado seguro. Esta seção examina os impactos de saúde da queima de combustível fóssil, que aumenta o ozônio do nível do solo muito acima dos níveis de fundo.
Há uma grande quantidade de evidências para mostrar que o ozônio no nível do solo pode prejudicar a função pulmonar e irritar o sistema respiratório. A exposição ao ozônio (e os poluentes que o produzem) está ligada à morte prematura, asma, bronquite, ataque cardíaco e outros problemas cardiopulmonares.
A exposição a longo prazo ao ozônio tem demonstrado aumentar o risco de morte por doença respiratória. Um estudo de 450.000 pessoas que viviam nas cidades dos EUA viu uma correlação significativa entre níveis de ozônio e doença respiratória durante o período de 18 anos de seguimento. O estudo revelou que as pessoas que vivem em cidades com altos níveis de ozônio, como Houston ou Los Angeles, tiveram mais de 30% de risco de morrer de doença pulmonar.
As diretrizes de qualidade do ar, como as da Organização Mundial da Saúde, da Agência de Proteção Ambiental dos EUA (EPA) e da União Europeia, são baseadas em estudos detalhados projetados para identificar os níveis que podem causar efeitos mensuráveis na saúde.
De acordo com cientistas com o EPA, as pessoas susceptíveis podem ser adversamente afetadas pelos níveis de ozônio tão baixos quanto 40 nmol/mol. Na UE, o valor-alvo actual para as concentrações de ozono é de 120 μg/m3 que é cerca de 60 nmol/mol. Este objectivo aplica-se a todos os Estados-Membros nos termos da Directiva 2008/50/CE. A concentração de ozono é medida como média diária máxima de 8 horas médias e o alvo não deve ser excedido em mais de 25 dias de calendário por ano, a partir de janeiro de 2010. Embora a directiva exija no futuro uma rigorosa conformidade com 120 μg/m3 limite (ou seja, concentração média de ozono para não ser excedido em qualquer dia do ano), não há data definida para esta exigência e isso é tratado como um objetivo a longo prazo.
Nos EUA, o Clean Air Act direciona o EPA para definir padrões nacionais de qualidade do ar para vários poluentes, incluindo o ozono de nível térreo e os condados fora de conformidade com esses padrões são obrigados a tomar medidas para reduzir seus níveis. Em maio de 2008, sob uma ordem judicial, o EPA reduziu seu padrão de ozônio de 80 nmol/mol para 75 nmol/mol. O movimento provou ser controverso, uma vez que os próprios cientistas e conselhos da Agência recomendaram reduzir o padrão para 60 nmol/mol. Muitos grupos de saúde pública e ambiental também apoiaram o padrão de 60 nmol/mol, e a Organização Mundial da Saúde recomenda 100 μg/m3 (51 nmol/mol).
Em 7 de janeiro de 2010, a Agência de Proteção Ambiental dos Estados Unidos (EPA) anunciou propostas de revisões para o padrão nacional de qualidade do ar ambiente (NAAQS) para o ozono poluentes, o principal componente de smog:
... A EPA propõe que o nível do padrão primário de 8 horas, que foi definido em 0,075 μmol/mol na regra final de 2008, deve ser ajustado em um nível inferior dentro da faixa de 0,060 a 0,070 μmol/mol, para fornecer maior proteção para crianças e outros em risco populações contra uma variedade de O
3 – efeitos adversos relacionados à saúde que variam de diminuição da função pulmonar e aumento dos sintomas respiratórios a indicadores sérios de morbidade respiratória, incluindo visitas de emergência e internações hospitalares para causas respiratórias, e, possivelmente, morbidade relacionada a cardiovascular, bem como mortalidade total não acidental e cardiopulmonar...
Em 26 de outubro de 2015, o EPA publicou uma regra final com uma data efetiva de 28 de dezembro de 2015 que revisou o NAAQS primário de 8 horas de 0,075 ppm para 0,070 ppm.
O EPA desenvolveu um índice de qualidade do ar (IQA) para ajudar a explicar os níveis de poluição do ar ao público em geral. Sob os padrões atuais, frações médias de toupeira de ozônio de 85 a 104 nmol/mol são descritas como "não saudáveis para grupos sensíveis", 105 nmol/mol a 124 nmol/mol como "não saudáveis", e 125 nmol/mol a 404 nmol/mol como "muito insalubre".
O ozônio também pode estar presente na poluição do ar interior, em parte como resultado de equipamentos eletrônicos, como fotocopiadoras. Uma conexão também foi conhecida por existir entre o pólen aumentado, esporos fúngicos e ozônio causado por tempestades e internações hospitalares de asma sofredores.
Na era vitoriana, um mito folclórico britânico sustentava que o cheiro do mar foi causado pelo ozônio. Na verdade, o "melo característico do mar" é causado pelo sulfeto dimetil, um produto químico gerado pelo fitoplâncton. Os britânicos vitorianos consideraram o cheiro resultante "braçando".
Ondas de calor
Uma investigação para avaliar os efeitos da mortalidade conjunta do ozônio e do calor durante as ondas de calor europeias em 2003, concluiu que estes parecem ser aditivos.
Fisiologia
O ozônio, juntamente com formas reativas de oxigênio, como superóxido, oxigênio único, peróxido de hidrogênio e íons hipoclorito, é produzido por células brancas do sangue e outros sistemas biológicos (como as raízes de marigolds) como um meio de destruir corpos estranhos. O ozônio reage diretamente com ligações duplas orgânicas. Além disso, quando o ozônio quebra para dioxigen dá origem a radicais livres de oxigênio, que são altamente reativos e capazes de danificar muitas moléculas orgânicas. Além disso, acredita-se que as propriedades oxidantes poderosas do ozônio podem ser um fator contribuinte da inflamação. A relação causa-e-efeito de como o ozônio é criado no corpo e o que ele faz ainda está sob consideração e ainda está sujeito a várias interpretações, uma vez que outros processos químicos do corpo podem desencadear algumas das mesmas reações. Há evidências que ligam a via de oxidação de água catalisada pelo anticorpo da resposta imune humana à produção de ozônio. Neste sistema, o ozono é produzido pela produção de trioxidano de trioxidano de água e oxigênio monot produzido por neutrófilos.
Quando inalado, o ozônio reage com compostos que revestem os pulmões para formar metabolitos específicos, derivados do colesterol que são pensados para facilitar a acumulação e patogênese de placas ateroscleróticas (uma forma de doença cardíaca). Estes metabolitos foram confirmados como ocorrendo naturalmente nas artérias ateroscleróticas humanas e são categorizados em uma classe de secosterós denominados atheronals, gerado pela ozonoliálise da ligação dupla do colesterol para formar um secosterol 5,6 bem como um produto de condensação secundário através da aldolização.
Impacto no crescimento das plantas e nas colheitas
O ozônio tem sido implicado para ter um efeito adverso no crescimento da planta: "... clorofilas totais reduzidas de ozônio, concentração carotenóide e carboidrato, e aumento de 1-aminocyclopropane-1-carboxílico ácido (ACC) conteúdo e produção de etileno. Em plantas tratadas, a associação de folhas de ascorbato foi diminuída, enquanto a peroxidação lipídica e o vazamento de soluto foram significativamente maiores do que em controles livres de ozônio. Os dados indicaram que o ozônio desencadeou mecanismos de proteção contra o estresse oxidativo em cítricos." Estudos que usaram plantas de pimenta como modelo mostraram que o ozônio diminuiu a produção de frutas e mudou a qualidade da fruta. Além disso, também foi observada diminuição dos níveis de clorofila e defesas antioxidantes nas folhas, bem como aumento dos níveis reativos de oxigênio (ROS) e danos lipídicos e proteicos.
Um estudo de 2022 conclui que a Ásia Oriental perde 63 bilhões de dólares em culturas por ano devido à poluição do ozônio, um subproduto da combustão de combustíveis fósseis. A China perde cerca de um terço da sua produção potencial de trigo e um quarto da sua produção de arroz.
Regulamentação de segurança
Devido às propriedades fortemente oxidantes do ozônio, o ozônio é um irritante primário, afetando especialmente os olhos e sistemas respiratórios e pode ser perigoso em concentrações ainda baixas. O Centro Canadense de Segurança e Saúde da Ocupação relata que:
Mesmo as concentrações muito baixas de ozônio podem ser prejudiciais para o trato respiratório superior e os pulmões. A gravidade da lesão depende da concentração de ozônio e da duração da exposição. A lesão pulmonar grave e permanente ou a morte podem resultar de uma exposição a curto prazo a concentrações relativamente baixas."
Para proteger os trabalhadores potencialmente expostos ao ozônio, a Administração de Segurança e Saúde Ocupacional dos EUA estabeleceu um limite de exposição admissível (PEL) de 0,1 μmol/mol (29 CFR 1910.1000 tabela Z-1), calculado como uma média ponderada em tempo de 8 horas. As concentrações mais altas são especialmente perigosas e a NIOSH estabeleceu um Imediatamente perigoso para o Limite de Vida e Saúde (IDLH) de 5 μmol/mol. Os ambientes de trabalho onde o ozônio é usado ou onde é provável que seja produzido devem ter ventilação adequada e é prudente ter um monitor para o ozono que alarmará se a concentração exceder o PEL OSHA. Monitores contínuos para ozônio estão disponíveis a partir de vários fornecedores.
A exposição ao ozono elevado pode ocorrer em aeronaves de passageiros, com níveis dependendo da altitude e turbulência atmosférica. Os regulamentos da Administração Federal da Aviação dos EUA estabelecem um limite de 250 nmol/mol com uma média máxima de quatro horas de 100 nmol/mol. Alguns aviões estão equipados com conversores de ozônio no sistema de ventilação para reduzir a exposição do passageiro.
Produção
Geradores de ozônioou ozonadores, são usados para produzir ozônio para limpar o ar ou remover odores de fumaça em quartos desocupados. Estes geradores de ozônio podem produzir mais de 3 g de ozônio por hora. Ozono muitas vezes se forma na natureza em condições em que O2 não vai reagir. O ozono utilizado na indústria é medido em μmol/mol (ppm, partes por milhão), nmol/mol (ppb, partes por bilhão), μg/m3, mg/h (miligramas por hora) ou porcentagem de peso. O regime de concentrações aplicadas varia de 1% a 5% (no ar) e de 6% a 14% (no oxigênio) para métodos de geração mais antiga. Novos métodos eletrolíticos podem atingir até 20% a 30% de concentrações de ozônio dissolvido em água de saída.
A temperatura e a umidade desempenham um grande papel na quantidade de ozônio está sendo produzido usando métodos de geração tradicionais (como descarga de corona e luz ultravioleta). Os métodos de geração antiga produzirão menos de 50% da capacidade nominal se operados com ar ambiente úmido, em oposição ao ar muito seco. Novos geradores, usando métodos eletrolíticos, podem alcançar maior pureza e dissolução através do uso de moléculas de água como fonte de produção de ozônio.
Método de descarga coronal
Este é o tipo mais comum de gerador de ozônio para a maioria dos usos industriais e pessoais. Embora as variações do método de descarga coronal "faísca quente" da produção de ozônio existam, incluindo geradores de ozônio de grau médico e industrial, essas unidades geralmente funcionam por meio de um tubo de descarga de corona ou placa de ozônio. Eles são tipicamente econômicos e não exigem uma fonte de oxigênio diferente do ar ambiente para produzir concentrações de ozônio de 3 a 6%. Flutuações no ar ambiente, devido ao clima ou outras condições ambientais, causam variabilidade na produção de ozônio. No entanto, eles também produzem óxidos de nitrogênio como um subproduto. O uso de um secador de ar pode reduzir ou eliminar a formação de ácido nítrico removendo o vapor de água e aumentar a produção de ozônio. À temperatura ambiente, o ácido nítrico se formará em um vapor que é perigoso se inalado. Os sintomas podem incluir dor no peito, falta de ar, dores de cabeça e um nariz seco e garganta causando uma sensação de queima. O uso de um concentrador de oxigênio pode aumentar ainda mais a produção de ozônio e reduzir ainda mais o risco de formação de ácido nítrico removendo não só o vapor de água, mas também a maior parte do nitrogênio.
Luz ultravioleta
Geradores de ozônio UV, ou geradores de ozônio de vácuo-ultravioleta (VUV), empregam uma fonte de luz que gera uma luz ultravioleta de banda estreita, um subconjunto do que produzido pelo Sol. O UV do Sol sustenta a camada de ozônio na estratosfera da Terra.
Os geradores de ozônio UV usam o ar ambiente para a produção de ozônio, nenhum sistema de preparação de ar é usado (refrigerador de ar ou concentrador de oxigênio), portanto esses geradores tendem a ser menos caros. No entanto, os geradores de ozônio UV geralmente produzem ozônio com uma concentração de cerca de 0,5% ou menor que limita a taxa de produção potencial de ozônio. Outra desvantagem deste método é que exige que o ar ambiente (oxigênio) seja exposto à fonte UV por mais tempo, e qualquer gás que não esteja exposto à fonte UV não será tratado. Isso torna os geradores UV impraticáveis para uso em situações que lidam com fluxos de ar ou água em movimento rápido (esterilização de ar no produto, por exemplo). A produção de ozônio é um dos perigos potenciais da irradiação germicida ultravioleta. Os geradores de ozônio VUV são usados em piscinas e aplicações de spa que variam para milhões de galões de água. Os geradores de ozônio VUV, ao contrário dos geradores de descarga de corona, não produzem subprodutos de nitrogênio nocivos e também ao contrário dos sistemas de descarga de corona, os geradores de ozônio VUV funcionam extremamente bem em ambientes de ar úmidos. Também não há normalmente uma necessidade de mecanismos off-gas caros, e nenhuma necessidade de secadores de ar ou concentradores de oxigênio que exigem custos extras e manutenção.
Plasma frio
No método de plasma frio, o gás de oxigênio puro é exposto a um plasma criado por DBD. O oxigênio diatômico é dividido em átomos únicos, que então recombine em triplos para formar o ozônio. É comum na indústria confundir alguns geradores de ozônio DBD como geradores de descarga de CD Corona. Normalmente todos os geradores de ozônio de eletrodo de metal plano sólido produzem ozônio usando o método de descarga de barreira dielétrica. As máquinas de plasma frio usam oxigênio puro como fonte de entrada e produzem uma concentração máxima de cerca de 24% de ozônio. Eles produzem quantidades muito maiores de ozônio em um dado tempo em comparação com a produção ultravioleta que tem cerca de 2% de eficiência. As descargas manifestam-se como transferência filamentar de elétrons (micro descargas) em uma lacuna entre dois eletrodos. A fim de distribuir uniformemente as micro descargas, um isolador dielétrico deve ser usado para separar os eletrodos metálicos e para evitar o arcing.
Eletrolítico
A geração de ozônio eletrolítico (EOG) divide moléculas de água em H2, O2, e O3. Na maioria dos métodos EOG, o gás de hidrogênio será removido para deixar oxigênio e ozônio como os únicos produtos de reação. Portanto, o EOG pode alcançar maior dissolução na água sem outros gases concorrentes encontrados no método de descarga de corona, como os gases de nitrogênio presentes no ar ambiente. Este método de geração pode atingir concentrações de 20–30% e é independente da qualidade do ar porque a água é usada como material de origem. A produção de ozônio eleticamente é tipicamente desfavorável por causa do alto excesso potencial necessário para produzir ozono em comparação com o oxigênio. É por isso que o ozônio não é produzido durante a electrólise de água típica. No entanto, é possível aumentar a superpotencial de oxigênio por seleção cuidadosa do catalisador tal que o ozônio é preferencialmente produzido sob a electrólise. Os catalisadores normalmente escolhidos para esta abordagem são o dióxido de chumbo ou o diamante dopado de boro.
A proporção de ozônio para oxigênio é melhorada aumentando a densidade de corrente no ânodo, refrigerando o eletrólito em torno do ânodo próximo a 0 °C, usando um eletrólito ácido (como o ácido sulfúrico diluído) em vez de uma solução básica, e aplicando a corrente pulsada em vez de DC.
Considerações especiais
O ozônio não pode ser armazenado e transportado como outros gases industriais (porque rapidamente decai em oxigênio diatômico) e, portanto, deve ser produzido no local. Os geradores de ozônio disponíveis variam no arranjo e design dos eletrodos de alta tensão. Em capacidades de produção superiores a 20 kg por hora, um trocador de calor tubo de gás / água pode ser utilizado como eletrodo de terra e montado com eletrodos tubulares de alta tensão no lado do gás. O regime de pressão típica de gás é em torno de 2 barras (200 kPa) absoluta em oxigênio e 3 barras (300 kPa) absoluta no ar. Vários megawatts de potência elétrica podem ser instalados em grandes instalações, aplicados como corrente CA de fase única em 50 a 8000 Hz e tensões de pico entre 3.000 e 20.000 volts. A tensão aplicada é geralmente inversamente relacionada à frequência aplicada.
O parâmetro dominante que influencia a eficiência da geração de ozônio é a temperatura do gás, que é controlada pela temperatura da água de resfriamento e/ou velocidade do gás. Quanto mais frio a água, melhor a síntese de ozônio. Quanto menor a velocidade do gás, maior a concentração (mas menor o ozônio líquido produzido). Em condições industriais típicas, quase 90% do poder eficaz é dissipado como calor e precisa ser removido por um fluxo de água de resfriamento suficiente.
Devido à alta reatividade do ozônio, apenas alguns materiais podem ser usados como aço inoxidável (qualidade 316L), titânio, alumínio (desde que nenhuma umidade esteja presente), vidro, politetrafluoretileno ou fluoreto de polivinilideno. Viton pode ser usado com a restrição de forças mecânicas constantes e ausência de umidade (os limites de umidade aplicam-se dependendo da formulação). Hypalon pode ser usado com a restrição de que nenhuma água entra em contato com ela, exceto para níveis atmosféricos normais. Embrittlement ou encolhimento é o modo comum de falha de elastômeros com exposição ao ozônio. O cracking de ozônio é o modo comum de falha de selos de elastômeros como O-rings.
Borrachas de silicone são geralmente adequadas para uso como juntas em concentrações de ozônio abaixo de 1 wt%, como em equipamentos para envelhecimento acelerado de amostras de borracha.
Produção acidental
Ozônio pode ser formado a partir de O
2 por descargas elétricas e por ação de radiação eletromagnética de alta energia. Arcing não comprimido em contatos elétricos, escovas motoras ou interruptores mecânicos quebra as ligações químicas do oxigênio atmosférico em torno dos contatos [O
2 → 2O]. Os radicais livres de oxigênio dentro e ao redor do arco recumbine para criar ozônio [O
3]. Certos equipamentos elétricos geram níveis significativos de ozônio. Isso é especialmente verdadeiro em dispositivos que utilizam altas tensões, como purificadores de ar iônicos, impressoras a laser, fotocopiadoras, tasers e soldadores de arco. Motores elétricos usando escovas podem gerar ozônio de espuma repetida dentro da unidade. Motores grandes que usam escovas, como os usados por elevadores ou bombas hidráulicas, gerarão mais ozônio do que motores menores.
O ozônio é similarmente formado no fenômeno de tempestades de raios Catatumbo no rio Catatumbo, na Venezuela, embora a instabilidade do ozônio o torne duvidoso que tenha qualquer efeito na ozonosfera. É o maior gerador natural do mundo de ozônio, emprestando chamadas para que ele seja designado Patrimônio Mundial da UNESCO.
Produção de laboratório
No laboratório, o ozônio pode ser produzido por eletrólise usando uma bateria de 9 volts, um cátodo de haste de grafite de lápis, um ânodo de fio de platina e um eletrólito de ácido sulfúrico de 3 molares. As reações de meia célula que ocorrem são:
- O3 + 6 H+ + 6 e-}}&&(Delta E^{circ }=-{text{1.53 V}})\&{ce {6 H+ + 6 e- -> 3 H2}}&&(Delta E^{circ }={text{0 V}})\&{ce {2 H2O -> O2 + 4 H+ + 4 e-}}&&(Delta E^{circ }={text{1.23 V}})end{aligned}}}" xmlns="http://www.w3.org/1998/Math/MathML">3H. H. H.2O⟶ ⟶ ⟶ ⟶ O3+6H. H. H.++6e- Sim. - Sim. (? ? E∘ ∘ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =- Sim. - Sim. 1.53 V)6H. H. H.++6e- Sim. - Sim. ⟶ ⟶ ⟶ ⟶ 3H. H. H.2(? ? E∘ ∘ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0 V)2H. H. H.2O⟶ ⟶ ⟶ ⟶ O2+4H. H. H.++4e- Sim. - Sim. (? ? E∘ ∘ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1.23 V)(em inglês)
O3 + 6 H+ + 6 e-}}&&(Delta E^{circ }=-{text{1.53 V}})\&{ce {6 H+ + 6 e- -> 3 H2}}&&(Delta E^{circ }={text{0 V}})\&{ce {2 H2O -> O2 + 4 H+ + 4 e-}}&&(Delta E^{circ }={text{1.23 V}})end{aligned}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/bdfc78197a50a3f3889fc5c364b6bdcf9f4f1e54" style="vertical-align: -4.338ex; width:52.045ex; height:9.843ex;"/>
Onde? E... representa o potencial de eletrodo padrão.
Na reação líquida, três equivalentes de água são convertidos em um equivalente de ozônio e três equivalentes de hidrogênio. A formação de oxigénio é uma reacção concorrente.
Também pode ser gerado por um arco de alta tensão. Em sua forma mais simples, AC de alta tensão, como a saída de um transformador de neon-sign é conectado a duas hastes de metal com as extremidades colocadas suficientemente perto um do outro para permitir um arco. O arco resultante converterá oxigênio atmosférico para o ozônio.
Muitas vezes é desejável conter o ozônio. Isso pode ser feito com um aparelho composto por dois tubos de vidro concêntricos selados juntos na parte superior com portas de gás na parte superior e inferior do tubo exterior. O núcleo interno deve ter um comprimento de folha metálica inserido nele conectado a um lado da fonte de energia. O outro lado da fonte de alimentação deve ser conectado a outra peça de folha metálica enrolada em torno do tubo externo. Uma fonte de seca O
2 é aplicado à porta inferior. Quando a alta tensão é aplicada aos cabos da folha, a eletricidade irá descarregar entre o dioxigênio seco no meio e a forma O
3 e O
2 que irá fluir para fora da porta superior. Isto chama-se ozoniser de Siemen. A reação pode ser resumida da seguinte forma:
- [{text{electricity}}]2O3}}}" xmlns="http://www.w3.org/1998/Math/MathML">3O2→electricidade2O3(3O2->[{text{electricity}}]2O3}}}
[{text{electricity}}]2O3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/fc22efb27fc01c8f1f3e7c215eddbfc9444cd0bc" style="vertical-align: -1.005ex; margin-top: -0.345ex; width:18.522ex; height:4.509ex;"/>
Aplicações
Indústria
O maior uso do ozônio está na preparação de produtos farmacêuticos, lubrificantes sintéticos e muitos outros compostos orgânicos comercialmente úteis, onde é usado para cortar as ligações de carbono. Também pode ser usado para branqueamento de substâncias e para matar microrganismos em fontes de ar e água. Muitos sistemas de água potável municipais matam bactérias com ozônio em vez do cloro mais comum. O ozônio tem um potencial de oxidação muito alto. O ozônio não forma compostos de organoclorotina, nem permanece na água após o tratamento. O ozônio pode formar o bromato de carcinogênio suspeito em água de origem com altas concentrações de brometo. A água potável segura dos EUA A lei determina que esses sistemas introduzem uma quantidade de cloro para manter um mínimo de 0,2 μmol/mol cloro livre residual nos tubos, com base nos resultados de testes regulares. Onde a energia elétrica é abundante, o ozônio é um método econômico de tratamento de água, uma vez que é produzido sob demanda e não requer transporte e armazenamento de produtos químicos perigosos. Uma vez que tenha decaído, não deixa sabor ou odor em água potável.
Embora baixos níveis de ozônio tenham sido anunciados para ser de algum uso desinfectante em casas residenciais, a concentração de ozônio no ar seco necessário para ter um efeito rápido e substancial em patógenos transportados pelo ar excede os níveis seguros recomendados pela Agência de Segurança e Saúde Ocupacional dos EUA e Proteção Ambiental. O controle de umidade pode melhorar amplamente tanto o poder de matar do ozônio quanto a taxa em que ele decai de volta ao oxigênio (mais umidade permite mais eficácia). Formas esportivas da maioria dos patógenos são muito tolerantes ao ozônio atmosférico em concentrações nas quais os pacientes com asma começam a ter problemas.
Em 1908 ozonização artificial a Linha Central do Metro de Londres foi introduzida como um desinfectante aéreo. O processo foi encontrado para valer a pena, mas foi eliminado em 1956. No entanto, o efeito benéfico foi mantido pelo ozônio criado incidentalmente a partir das descargas elétricas dos motores de trem (ver acima: produção acidental).
Os geradores de ozônio foram disponibilizados para escolas e universidades no País de Gales para o período de outono de 2021, para desinfectar salas de aula após surtos de COVID-19.
Industrialmente, o ozono é usado para:
- Desinfetar a lavanderia em hospitais, fábricas de alimentos, casas de cuidados etc;
- Desinfetar a água no lugar do cloro
- Desodorize ar e objetos, como após um incêndio. Este processo é amplamente utilizado na restauração de tecido
- Matar bactérias em alimentos ou em superfícies de contato;
- Indústrias intensas de água, como cervejarias e fábricas de laticínios, podem fazer uso efetivo do ozônio dissolvido como uma substituição a higienizadores químicos, tais como ácido peracético, hipoclorito ou calor.
- Desinfectar torres de resfriamento e controlar Legionella com consumo químico reduzido, sangramento de água e aumento do desempenho.
- Sanitize piscinas e spas
- Mate insetos em grãos armazenados
- Esporos de levedura e molde Scrub do ar em plantas de processamento de alimentos;
- Lave frutas frescas e vegetais para matar levedura, molde e bactérias;
- Os contaminantes de ataque químico em água (iron, arsênico, sulfeto de hidrogênio, nitritos e orgânicos complexos misturados como "cor");
- Fornecer uma ajuda à floculação (aglomeração de moléculas, que auxilia na filtração, onde o ferro e o arsênico são removidos);
- Fabricação de compostos químicos através de síntese química
- Tecidos limpos e branqueados (o uso anterior é utilizado na restauração de tecido; o último uso é patenteado);
- Agir como um anticloro no branqueamento à base de cloro;
- Assistência no processamento de plásticos para permitir a adesão de tintas;
- amostras de borracha de idade para determinar a vida útil de um lote de borracha;
- Erradicar parasitas transmitidos pela água, como Giardia lamblia e Cryptosporidium em plantas de tratamento de água superficial.
O ozônio é um reagente em muitas reações orgânicas no laboratório e na indústria. Ozonólise é a clivagem de um alceno a compostos de carbonilo.
Muitos hospitais em todo o mundo usam grandes geradores de ozônio para descontaminar salas de operação entre cirurgias. Os quartos são limpos e, em seguida, selado hermético antes de ser preenchido com ozônio que efetivamente mata ou neutraliza todas as bactérias restantes.
O ozônio é usado como uma alternativa ao cloro ou dióxido de cloro no branqueamento da polpa de madeira. É frequentemente usado em conjunto com o oxigênio e o peróxido de hidrogênio para eliminar a necessidade de compostos contendo cloro na fabricação de papel branco de alta qualidade.
O ozônio pode ser usado para desintoxicar os resíduos de cianeto (por exemplo, da mineração de ouro e prata) oxidando o cianeto ao cianeto e, eventualmente, ao dióxido de carbono.
Desinfecção da água
Desde a invenção de reatores de plasma de Descarga de Barreira Dielétrica (DBD), tem sido empregado para tratamento de água com ozônio. No entanto, com desinfetantes alternativos mais baratos como cloro, tais aplicações de descontaminação de água de ozônio DBD têm sido limitadas pelo consumo de alta potência e equipamentos volumosos. Apesar disso, com pesquisas revelando os impactos negativos de desinfetantes comuns como cloro em relação aos resíduos tóxicos e ineficácia em matar certos microrganismos, a descontaminação do ozônio baseado no plasma DBD é de interesse em tecnologias atuais disponíveis. Embora a ozonização da água com uma alta concentração de brometo leva à formação de subprodutos de desinfecção brominados indesejáveis, a menos que a água potável seja produzida por dessalinização, a ozonização pode ser geralmente aplicada sem preocupação com esses subprodutos. As vantagens do ozônio incluem alto potencial de oxidação termodinâmica, menos sensibilidade ao material orgânico e melhor tolerância para variações de pH, mantendo a capacidade de matar bactérias, fungos, vírus, esporos e cistos. Embora o ozônio tenha sido amplamente aceito na Europa por décadas, ele é usado para descontaminação nos EUA devido a limitações de consumo de alta potência, instalação volumosa e estigma ligado com toxicidade de ozônio. Considerando isto, os esforços recentes de investigação foram orientados para o estudo de sistemas eficazes de tratamento da água do ozônio Os pesquisadores analisaram os reatores DBD de superfície de baixa potência leves e compactos, os reatores DBD de volume eficiente de energia e os reatores DBD de baixa escala de energia. Tais estudos podem ajudar a pavimentar o caminho para a reaceitação da descontaminação do ozônio baseado no plasma DBD da água, especialmente nos EUA.
Consumidores
Dispositivos que geram altos níveis de ozônio, alguns dos quais usam ionização, são usados para higienizar e desodorizar edifícios desabitados, salas, ductwork, woodsheds, barcos e outros veículos.
A água ozonada é usada para lavar roupas e para higienizar alimentos, água potável e superfícies em casa. De acordo com a Administração de Alimentos e Drogas dos EUA (FDA), é "querendo os regulamentos aditivos alimentares para fornecer para o uso seguro do ozônio em fases gasosas e aquosas como um agente antimicrobiano em alimentos, incluindo carne e aves". Estudos na Universidade Politécnica da Califórnia demonstraram que 0,3 μmol/mol níveis de ozônio dissolvido em água da torneira filtrada podem produzir uma redução de mais de 99,99% em microrganismos como a salmonela, E. coli 0157: H7 e Acampamentos. Esta quantidade é de 20.000 vezes os limites recomendados pela OMS indicados acima. O ozônio pode ser usado para remover resíduos de pesticidas de frutas e vegetais.
O ozônio é usado em casas e banheiras de hidromassagem para matar bactérias na água e reduzir a quantidade de cloro ou bromo exigidos reativando-os ao seu estado livre. Uma vez que o ozônio não permanece na água o suficiente, o ozônio por si só é ineficaz na prevenção da contaminação cruzada entre os banhistas e deve ser usado em conjunto com halogênios. Ozono gasoso criado pela luz ultravioleta ou pela descarga de corona é injetado na água.
O ozônio também é amplamente utilizado no tratamento da água em aquários e peixesponds. Seu uso pode minimizar o crescimento bacteriano, parasitas de controle, eliminar a transmissão de algumas doenças, e reduzir ou eliminar "amarela" da água. O ozônio não deve entrar em contato com as estruturas de guelras dos peixes. A água salgada natural (com formas de vida) fornece bastante "procura instantânea" que controla quantidades de ozônio ativam íons de brometo ao ácido hipobromous, e o ozônio decai inteiramente em poucos segundos a minutos. Se o ozônio alimentado por oxigênio for usado, a água será maior em oxigênio dissolvido e as estruturas de cinta de peixes irão atrofiá-los, tornando-os dependentes de água enriquecido por oxigênio.
Aquicultura
Ozônio – um processo de infusão de água com ozônio – pode ser usado na aquicultura para facilitar a degradação orgânica. O ozônio também é adicionado a sistemas de recirculação para reduzir os níveis de nitrito através da conversão em nitrato. Se os níveis de nitrito na água são altos, os nitritos também se acumularão no sangue e nos tecidos de peixes, onde interfere com o transporte de oxigênio (que causa oxidação do grupo heme de hemoglobina de ferroso (Fe2+
) para furar (Fe3+
), tornando a hemoglobina incapaz de ligar O
2). Apesar destes efeitos positivos aparentes, o uso de ozônio em sistemas de recirculação tem sido ligado à redução do nível de iodo biodisponível em sistemas de água salgada, resultando em sintomas de deficiência de iodo, como goitre e diminuição do crescimento da sola senegalesa (Solea senegalensis) larvas.
A água do mar ozonato é usada para desinfecção superficial de ovos de halibut de haddock e Atlântico contra o nodavírus. Nodavírus é um vírus letal e verticalmente transmitido que causa mortalidade grave em peixes. Os ovos de Haddock não devem ser tratados com alto nível de ozônio como ovos assim tratados não eclodiram e morreram após 3-4 dias.
Agricultura
Aplicação de ozônio em abacaxi recém-cortado e banana mostra aumento de flavonóides e total de conteúdo fenol quando a exposição é de até 20 minutos. O aumento do teor de ácido ascórbico (uma forma de vitamina C) é observado, mas o efeito positivo sobre o teor total de fenol e flavonóides pode superar o efeito negativo. Os tomates no tratamento com ozônio mostram um aumento no β-caroteno, luteína e licopeno. No entanto, a aplicação de ozônio em morangos no período pré-colheita mostra diminuição no teor de ácido ascórbico.
O ozônio facilita a extração de alguns metais pesados do solo usando EDTA. O EDTA forma compostos de coordenação fortes e solúveis em água com alguns metais pesados (Pb, Zn), tornando possível dissolvê-los do solo contaminado. Se o solo contaminado for pré-tratado com ozônio, a eficácia da extração de Pb, Am e Pu aumenta em 11,0–28,9%, 43,5% e 50,7%, respectivamente.
Efeito ambiental não intencional em polinizadores
A polinização das culturas é uma parte essencial de um ecossistema. O ozônio pode ter efeitos prejudiciais nas interações planta-polinizador. Os polinizadores transportam o pólen de uma planta para outra. Este é um ciclo essencial dentro de um ecossistema. Causar mudanças em certas condições atmosféricas em torno de locais de polinização ou com xenobióticos pode causar mudanças desconhecidas nos ciclos naturais de polinizadores e plantas com flores. Em um estudo realizado no noroeste da Europa, os polinizadores das culturas foram mais afetados negativamente quando os níveis de ozônio eram mais altos.
Medicina alternativa
O uso de ozônio para o tratamento de condições médicas não é apoiado por evidências de alta qualidade e geralmente é considerado uma medicina alternativa.




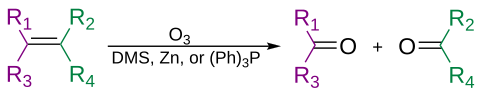

![{displaystyle V={frac {Kcdot [{ce {O3}}]^{2}}{[{ce {O2}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f43396c74b3b55399e8c0c22abcc448b024b8a2e)
![{displaystyle V_{1}=K_{1}cdot [{ce {O3}}]qquad V_{2}=K_{2}cdot [{ce {O}}]cdot [{ce {O3}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa89c5e2c3b0c501381aadcdaa39b60594d1b4c7)
![{displaystyle V=2K_{2}cdot [{ce {O}}]cdot [{ce {O3}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9243dbd85bcf44b84a7066876ae41fb536ccbfe2)
![{displaystyle K_{1}={frac {K_{1}}{K_{-1}}}={frac {[{ce {O2}}]cdot [{ce {O}}]}{[{ce {O3}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/048f2f135e0f4a159da14ab2b26a334d856b0464)
![{displaystyle [{ce {O}}]={frac {K_{1}cdot [{ce {O3}}]}{K_{-1}cdot [{ce {O2}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98fafe6a7ff5c5725717421d2ad60788083ee4d8)
![{displaystyle V={2K_{2}cdot K_{1}cdot [{ce {O_3}}]^{2} over K_{-1}cdot [{ce {O_2}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da560af608b21e57aab047710fb13a5c532467b5)
![{displaystyle V={K_{text{obs}}cdot [{ce {O_3}}]^{2} over [{ce {O_2}}]}=K_{text{obs}}cdot [{ce {O_3}}]^{2}cdot [{ce {O_2}}]^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/69189abb1a3881b3f8e427d5f963edd866401b67)