Naftaleno
naftaleno é um composto orgânico com a fórmula c
10 H
História
No início da década de 1820, dois relatórios separados descreveram um sólido branco com um odor pungente derivado da destilação do alcatrão de carvão. Em 1821, John Kidd citou essas duas divulgações e depois descreveu muitas das propriedades dessa substância e os meios de sua produção. Ele propôs o nome naftalina , como havia sido derivado de uma espécie de nafta (um termo amplo que abrange qualquer mistura de hidrocarboneto líquido e inflamável volátil, incluindo alcatrão de carvão). A fórmula química de naftaleno foi determinada por Michael Faraday em 1826. A estrutura de dois anéis de benzeno fundida foi proposta por Emil Erlenmeyer em 1866 e confirmada por Carl Gräbe três anos depois.
Propriedades físicas
Uma molécula de naftaleno pode ser vista como a fusão de um par de anéis de benzeno. (Na química orgânica, os anéis são fundidos se eles compartilham dois ou mais átomos.) Como tal, o naftaleno é classificado como um hidrocarboneto aromático policíclico benzenóide (HAP).
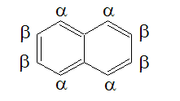
Os oito átomos de carbono que não são compartilhados pelos dois anéis carregam um átomo de hidrogênio cada. Para fins da nomenclatura padrão da IUPAC de compostos derivados, esses oito átomos são numerados de 1 a 8 em sequência ao redor do perímetro da molécula, começando com um átomo de carbono adjacente a um compartilhado. Os átomos de carbono compartilhados são rotulados 4a (entre 4 e 5) e 8a (entre 8 e 1).
Geometria molecular
A molécula é plana, como o benzeno. Ao contrário do benzeno, as ligações carbono -carbono no naftaleno não são do mesmo comprimento. As ligações C1 -C2, C3 -C4, C5 -C6 e C7 -C8 têm cerca de 1,37 Å (137 pm) de comprimento, enquanto as outras ligações carbono -carbono têm cerca de 1,42 Å (142 pm) de comprimento. Essa diferença, estabelecida pela difração de raios-X, é consistente com o modelo de ligação de valência no naftaleno e, em particular, com o teorema da conjugação cruzada. Esse teorema descreveria o naftaleno como uma unidade de benzeno aromática ligada a um dieno, mas não amplamente conjugado a ele (pelo menos no estado fundamental), o que é consistente com duas de suas três estruturas de ressonância.
Devido a essa ressonância, a molécula possui simetria bilateral através do plano do par de carbono compartilhado, bem como no plano que interrompe as ligações C2-C3 e C6-C7 e através do plano dos átomos de carbono. Assim, existem dois conjuntos de átomos de hidrogênio equivalentes: as posições alfa, numeradas 1, 4, 5 e 8, e as posições beta , 2, 3, 6 e 7. Dois isômeros são então possíveis para naftalenos mono-substituídos, correspondentes à substituição em uma posição alfa ou beta.

Isômeros estruturais de naftaleno que possuem dois anéis aromáticos fundidos incluem azuleno, que possui um decapenaene de 5 a 7, e o decapentane de biciclo [6.2.0] que possui um sistema de anel de 4 a 8 fundido.
A simetria do grupo de pontos do naftaleno é d
Condutividade elétrica
O naftaleno cristalino puro é um isolador moderado à temperatura ambiente, com resistividade de cerca de 10
Propriedades químicas
Reações com eletrofilos
Nas reações de substituição aromática eletrofílica, o naftaleno reage mais rapidamente que o benzeno. Por exemplo, a cloração e a brominação do naftaleno prosseguem sem um catalisador para dar 1-cloronaftaleno e 1-bromonaftaleno, respectivamente. Da mesma forma, enquanto o benzeno e o naftaleno podem ser alquilados usando condições de reação de Friedel -Crafts, o naftaleno também pode ser facilmente alquilado por reação com alcenos ou álcoois, usando catalisadores de ácido sulfúrico ou fosfórico.
Em termos de regioquímica, os eletrófilos atacam na posição alfa. A seletividade para a substituição alfa sobre beta pode ser racionalizada em termos das estruturas de ressonância do intermediário: para o intermediário de substituição alfa, sete estruturas de ressonância podem ser desenhadas, das quais quatro preservam um anel aromático. Para substituição beta, o intermediário possui apenas seis estruturas de ressonância e apenas duas delas são aromáticas. A sulfonação fornece o " alfa " Ácido naftaleno-1-sulfônico de naftaleno-1 como produto cinético, mas ácido naftaleno-2-sulfônico como produto termodinâmico. O 1-isômero se forma predominantemente a 25 ° C e o 2-isômero a 160 ° C. A sulfonação para dar o ácido 1 e 2-sulfônico ocorre prontamente:
- H. H. H.2Então...4 + C10.H. H. H.8 → C10.H. H. H.7Então...3H + H2O
Mais sulfonação dar di-, tri-, e ácidos tetrasulfônicos.
Lithiation
análogo à síntese do fenilitio é a conversão de 1-bromonaftaleno em 1-litionáftaleno, pela troca de lítio-halogênio:
- C10.H. H. H.7Br + BuLi → C10.H. H. H.7Li + BuBr
O litionáftaleno resultante passa por uma segunda litiação, em contraste com o comportamento do fenilito. Esses derivados de 1,8-dilitio são precursores de uma série de derivados peri-naftaleno.
Redução e oxidação
Com metais alcalinos, o naftaleno forma os sais de ânio radical verde-azulados escuros, como naftaleno de sódio, na
8
O naftaleno pode ser hidrogenado sob alta pressão na presença de catalisadores de metal para dar 1,2,3,4-tetra-hidronaftaleno ( c
12 ), também conhecido como tetralina. A hidrogenação adicional produz deca-hidronaftaleno ou descalina ( c 10 h
oxidação com o
- C10.H. H. H.8 + 4.5 O2 → C6H. H. H.4(CO)2O + 2 CO2 + 2 H2O
Esta reação é a base do uso principal do naftaleno. A oxidação também pode ser efetuada usando cromato estequiométrico convencional ou reagentes de permanganato.
Produção

A maioria dos naftaleno é derivada do alcatrão de carvão. De 1960 até os anos 90, quantidades significativas de naftaleno também foram produzidas a partir de frações pesadas de petróleo durante o refino do petróleo, mas a produção atual é principalmente do alcatrão de carvão. Aproximadamente 1,3 milhão de toneladas são produzidas anualmente.
Naftaleno é o componente único mais abundante do alcatrão de carvão. A composição do alcatrão de carvão varia com o tipo de carvão e o processamento, mas o alcatrão de carvão típico é de cerca de 10% de naftaleno em peso. Na prática industrial, a destilação do alcatrão de carvão produz um petróleo contendo cerca de 50% naftaleno, juntamente com doze outros compostos aromáticos. Este óleo, depois de ser lavado com hidróxido de sódio aquoso para remover componentes ácidos (principalmente vários fenóis) e com ácido sulfúrico para remover componentes básicos, sofre destilação fracionada para isolar naftaleno. O naftaleno bruto resultante desse processo é de cerca de 95% de naftaleno em peso. As principais impurezas são o composto aromático contendo enxofre benzotiofeno (& lt; 2%), Indano (0,2%), Indeno (& lt; 2%) e metilnaftaleno (& lt; 2%). O naftaleno derivado do petróleo é geralmente mais puro do que o derivado do alcatrão de carvão. Onde necessário, o naftaleno bruto pode ser purificado ainda mais pela recristalização de qualquer um de vários solventes, resultando em 99% de naftaleno em peso, referido como 80 ° C (ponto de fusão).
Na América do Norte, os produtores de alcatrão de carvão são a Koppers Inc., a Ruetgers Canada Inc. e a Recochem Inc., e o principal produtor de petróleo é a Monument Chemical Inc. na Europa Ocidental, os produtores conhecidos são Koppers, Ruetgers e Deza . Na Europa Oriental, o naftaleno é produzido por uma variedade de complexos de metalurgia integrada (Severstal, Evraz, Mechel, MMK) na Rússia, os fabricantes de naftaleno e fenol dedicados Inkor, Yenakievsky metalurgia em Ucraína e Arcelormairtal Temirtau em Kakhstan.
Outras fontes e ocorrências
Naftaleno e seus homólogos de alquil são os principais constituintes do creosote.
Quantidades de naftaleno são produzidas por magnólias e algumas espécies de veados, bem como o cupim subterrâneo da Formossana, possivelmente produzido pelo cupim como repelente contra "Ants, Fungos venenosos e vermes de nematóides." Algumas cepas do fungo endofítico muscodor albus produzem naftaleno entre uma variedade de compostos orgânicos voláteis, enquanto Muscodor Vitigenus produz naftaleno quase exclusivamente.
Usos
O naftaleno é usado principalmente como precursor de produtos químicos derivados. O maior uso de naftaleno é a produção industrial de anidrido ftálico, embora mais anidrido ftálico seja feito de O-xileno.
Fumigação
O naftaleno tem sido usado como fumigante. Foi o ingrediente principal nas bolas de marothballs, embora seu uso tenha sido amplamente substituído em favor de alternativas como 1,4-diclorobenzeno. Em um recipiente selado contendo pellets de naftaleno, os vapores de naftaleno aumentam os níveis tóxicos para as formas adultas e larvais de muitas mariposas que atacam têxteis. Outros usos fumigantes do naftaleno incluem o uso no solo como um pesticida fumigante, em espaços do sótão para repelir insetos e animais, como gambás e em traquedas de armazenamento de museus e armários para proteger o conteúdo do ataque de pragas de insetos.
Solvente
Usos derivados
O maior uso do naftaleno é a produção de anidrido ftalico, que é um intermediário usado para fazer plastificantes para cloreto de polivinil e fazer polímeros de resina alquídica usados em tintas e vernizes.
Ácidos sulfônicos e sulfonatos
Muitos ácidos e sulfonatos naftalenesulfônicos são úteis. Os ácidos naftalenesulfônicos são usados na síntese de 1-naftol e 2-naftol, precursores para vários corantes, pigmentos, produtos químicos de processamento de borracha e outros produtos químicos e produtos farmacêuticos. Eles também são usados como dispersantes em borrachas sintéticas e naturais, em pesticidas agrícolas, em corantes e em placas de bateria de chumbo -ácido. Os ácidos naftalendizados, como o ácido de Armstrong, são usados como precursores e para formar sais farmacêuticos como a CFT.
Os ácidos aminonaftalenesulfônicos são precursores para a síntese de muitos corantes sintéticos.
Sulfonatos de naftaleno de alquil (ANS) são usados em muitas aplicações industriais como surfactantes não metergentes (agentes de umedecimento) que dispersam efetivamente os sistemas coloidais em meios aquosos. As principais aplicações comerciais estão na indústria química agrícola, que usa as formulações de pó metável e granular (fluxo seco) e na indústria têxtil e de tecidos, que usa as propriedades de umedecimento e desgosto da ANS para operações de branqueamento e tingimento.
Alguns polímeros de naftalenesulfonato são superplastizadores usados para a produção de concreto de alta resistência. Eles são produzidos tratando o ácido naftalenesulfônico com formaldeído, seguido de neutralização com hidróxido de sódio ou hidróxido de cálcio.
Outros usos derivados

Muitos corantes azo são produzidos a partir de naftaleno. Os agricêmicos úteis incluem ácidos naftoxiacéticos.
A hidrogenação do naftaleno fornece tetra-hidronaftaleno (tetralina) e deca-hidronaftaleno (decalina), que são usados como solventes de baixa volatilidade. A tetralina é usada como solvente do doador de hidrogênio.
A alquilação do naftaleno com propileno fornece uma mistura de diisopropilnaftaleno, que são úteis como líquidos não voláteis para as tintas.Napthalenos substituídos servem como farmacêuticos como o propranolol (um betabloqueador) e nabumetona (um medicamento anti-inflamatório não esteróides).
Outras utilizações
Vários utilizam o caule do naftaleno de alta volatilidade: é usado para criar poros artificiais na fabricação de rodas de moagem de alta porosidade; É usado em estudos de engenharia de transferência de calor usando sublimação em massa; E foi explorado como um propulsor sublimável para propulsores de satélite de gás frio.
Efeitos de saúde
O Programa Nacional de Toxicologia dos EUA (NTP) realizou um experimento em que ratos e ratos masculinos e femininos foram expostos a vapores de naftaleno durante a semana por dois anos. Ratos masculinos e femininos exibiram evidências de carcinogênese com aumento de incidências de adenoma e neuroblastoma do nariz. As camundongos femininas exibiram algumas evidências de carcinogênese baseadas em aumentos de incidências de adenomas alveolares e bronchiolares do pulmão, enquanto camundongos machos não exibiram evidências de carcinogênese.
A Agência Internacional de Pesquisa sobre Câncer (IARC) classifica o naftaleno como possivelmente carcinogênico para humanos e animais (Grupo 2B). O IARC também aponta que a exposição aguda causa cataratas em humanos, ratos, coelhos e ratos; e que a anemia hemolítica (descrita acima) pode ocorrer em crianças e bebês após exposição oral ou de inalação ou após exposição materna durante a gravidez. Sob a proposição 65 da Califórnia, a naftaleno é listada como conhecida pelo Estado para causar câncer ". Foi identificado um mecanismo provável para os efeitos carcinogênicos das bolas de mariposas e alguns tipos de refogadores de ar contendo naftaleno.
Regulamento
As agências governamentais dos EUA estabeleceram limites de exposição ocupacional à exposição a naftaleno. A Administração de Segurança e Saúde Ocupacional estabeleceu um limite de exposição permitido a 10 ppm (50 mg/m
Mothballs e outros produtos contendo naftaleno foram banidos na UE desde 2008.
Na China, é proibido o uso de naftaleno nas bolas de mariposas. O perigo para a saúde humana e o uso comum da cânfora natural são citados como razões para a proibição.
Derivados de naftaleno
A lista parcial de derivados de naftaleno inclui os seguintes compostos:
| Nome | Fórmula química | Massa mole [g/mol] | Ponto de fusão [°C] | Ponto de ebulição [°C] | Densidade [g/cm3] | Índice de refração |
|---|---|---|---|---|---|---|
| 1 - Ácido naftóico | C11H. H. H.8O2 | 172.18 | 157 | 300 | – | |
| 2-ácido naftótico | C11H. H. H.8O2 | 172.18 | 185.5 | – | ||
| 1-cloreto de Naftoyl | C11H. H. H.7ClO | 190.63 | 16-19 | 190 (35 Torr) | 1.265 | 1.655 |
| 1-Naphthol | C10.H. H. H.8O | 144,17 | 94–96 | 278 | 1.224. | – |
| 1-Nafthaldeído | C11H. H. H.8O | 156.18 | 1–2 | 160 (15 Torr) | ||
| 1-Nitronaftaleno | C10.H. H. H.7Não.2 | 173,1 | 53–57 | 340 | 1.22 | – |
| 1-Fluoronaftaleno | C10.H. H. H.7F | 146.16 | -19. | 215 | 1.323 | 1.593 |
| 1-Chloronaphthalene | C10.H. H. H.7Cl | 162.62 | -6 | 259 | 1.194 | 1.632 |
| 2-Chloronaphthalene | C10.H. H. H.7Cl | 162.62 | 5 anos. | 256. | 1.138 | 1.643 |
| 1-Bromonaphthalene | C10.H. H. H.7B. | 207.07 | -2 | 279 | 1.489 | 1.670 |
| 1,2,7-Trimethylnaphthalene (Sapotalin) | C13H. H. H.14 | 170.25 | 143 | 128 | 0,987 | |
| Ácido naftaleno-2-sulfônico |
Ver também
- Campeão
- Dialin, Tetralin, Decalin
- Lista de moléculas interestelar e circunstelar
- Mothballs
- 1-Naphthol, 2-Naphthol
- Reação de Wagner-Jauregg (síntese de naftaleno clássico)
Referências
- ^ Naftaleno: nomes comerciais
- ^ Nomenclatura da Química Orgânica: IUPAC Recomendações e Nomes Preferidos 2013 (Livro Azul). Cambridge: The Royal Society of Chemistry. 2014. pp. 13, 35, 204, 207, 221–222, 302, 457, 461, 469, 601, 650. doi:10.1039/9781849733069-FP001 (inativo 2024-06-22). ISBN 978-0-85404-182-4.
{{cite book}}: Principal CS1: DOI inativo a partir de junho 2024 (link) - ↑ a b c " Critérios de qualidade da água ambiente para Naftaleno" (PDF). Agência de Proteção Ambiental dos Estados Unidos. 2014-04-23. Retrieved 2014-06-21.
- ) a b d e f i g i c i c i c i c i c i c i c i c i c i c i c i c i a c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i c i a Lide, David R., ed. (2009). CRC Manual de Química e Física (90a ed.). Boca Raton, Flórida: CRC Imprensa. ISBN 978-1-4200-9084-0.
- ↑ a b c Anatolievich, Kiper Ruslan. "naftaleno". chemister.ru. Retrieved 2014-06-21.
- ↑ a b d e f Seidell, Atherton; Linke, William F. (1919). Solubilidade de Compostos Inorgânicos e Orgânicos (2o ed.). Nova Iorque: D. Van Nostrand Company. pp. 443–446.
- ↑ a b Naftaleno em Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Instituto Nacional de Normas e Tecnologia, Gaithersburg (MD) (representado 2014-05-24)
- ^ «Thermal Conductivity of Naphthalene» (em inglês). DDBST GmbH. Arquivado do original em 2016-03-04. Retrieved 2014-06-21.
- ^ «Dynamic Viscosity of Naphthalene» (em inglês). DDBST GmbH. Arquivado do original em 2016-03-04. Retrieved 2014-06-21.
- ↑ a b d Douglas, Bodie E.; Ho, Shih-Ming (2007). Estrutura e Química de Sólidos Cristalinos. New York: Springer Science+Business Media, Inc. p. 288. ISBN 978-0-387-26147-8.
- ↑ a b d e f Sigma-Aldrich Co., Naphthalene.
- ^ Carcinogenicidade de Naftaleno
- ↑ a b c NIOSH Pocket Guide to Chemical Hazards (em inglês). «#0439». Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ "Naftaleno". Imediatamente Perigoso para Concentrações de Vida ou Saúde (IDLH). Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ Amoore JE, Hautala E (1983). "Odor como um auxílio à segurança química: limiares de odor em comparação com valores limite de limiar e voláteis para 214 produtos químicos industriais em diluição de ar e água". J Appl Toxicol. 3 (6): 272–290. doi:10.1002/jat.2550030603. PMID 6376602. S2CID 36525625.
- ^ John Kidd (1821). "Observações sobre Naftaleno, uma substância peculiar semelhante a um óleo essencial concreto, que é produzido durante a decomposição de alcatrão de carvão, pela exposição a um calor vermelho". Transações Filosóficas. 111: 209-221. doi:10.1098/rstl.1821.0017. S2CID 97798085.
- ^ Emil Erlenmeyer (1866). «Studien über die s. g. aromatischen Säuren» (em inglês). Annalen der Chemie und Pharmacie. 137 (3): 327–359. doi:10.1002/jlac.18661370309.
- ^ C. Graebe (1869) "Ueber die Constitution des Naphthalins" (Na estrutura do naftaleno), Annalen der Chemie und Pharmacie, 149: 20–28.
- ^ "Hidrocarbonetos Aromáticos Policíclicos (PAHs)" (PDF). Arquivado (PDF) do original em 2014-11-30.
Naftaleno é um PAH que é produzido comercialmente nos EUA
- ^ Livro azul, P-14.4 NUMBERING
- ^ Cruickshank, D. W. J.; Sparks, R. A. (18 de outubro de 1960). «Experimental and Theoretical Determinations of Bond Extensions in Naphthalene, Anthracene and Other Hydrocarbons» (em inglês). Proceedings of the Royal Society A: Ciências Matemáticas, Físicas e de Engenharia. 258 (1293): 270-285. Bibcode:1960RSPSA.258.270C. doi:10.1098/rspa.1960.0187. S2CID 96765335.
- ^ Dieter Cremer; Thomas Schmidt; Charles W. Bock (1985). "Determinação teórica da estrutura molecular e conformação. 14. É bicyclo[6.2.0]decapentaeno aromático ou antiaromático?". J. Org. Chem. 50 (15): 2684–2688. doi:10.1021/jo00215a018.
- ^ Bornmann, John A. (1962). «Semiconductivity of Naphthalene» (em inglês). O Jornal de Física Química. 36 (6): 1691-1692. Bibcode:1962JChPh..36.1691B. doi:10.1063/1.1732805. ISSN 0021-9606.
- ^ Schein, L. B.; Duke, C. B.; McGhie, A. R. (1978). «Observation of the Band-Hopping Transition for Electrons in Naphthalene» (em inglês). Cartas de Revisão Física. 40 (3): 197–200. Bibcode:1978PhRvL..40.197S. doi:10.1103/PhysRevLett.40.197. ISSN 0031-9007.
- ↑ a b d e f Gerd Collin; Hartmut Höke; Helmut Greim (2003). «Naftaleno and Hydronaphthalenes» (em inglês). Enciclopédia de Química Industrial de Ullmann. Wiley-VCH. ISBN 978-3527306732..
- ^ van Soolingen J, de Lang RJ, den Besten R, et al. (1995). «Um procedimento simples para a preparação de 1,8-bis(diphenylphosphino)naphthalene». Comunicações sintéticas. 25 (11): 1741–1744. doi:10.1080/00397919508015858.
- ^ «Termite 'mothball' keep insetos at bay» (em inglês). Sci/Tech. BBC News. 8 de abril de 1998.
- ^ Daisy BH, Strobel GA, Castillo U, et al. (novembro de 2002). "Naftaleno, um repelente de insetos, é produzido por Muscodor vitigenus, um novo fungo endofótico". Microbiologia. 148 (Pt 11): 3737–41. - Sim.10.1099/00221287-148-11-37. PMID 12427963.
- ^ «Summary of Possum Repellent Study» (em inglês). Arquivado do original em 28 de setembro de 2013.
- ^ K. Komatsua; Y. Murataa; N. Sugitaa; et al. (1993). "Uso de naftaleno como solvente para a formação seletiva do acréscimo 1:1 Diels-Alder de C60. com anthracene". Letras Tetrahedron. 34 (52): 8473–8476. doi:10.1016/S0040-4039(00)61362-X.
- ^ M.A. Filatov; A.V. Cheprakov (2011). «A síntese de novas tetrabenzo- e tetranaphthoporphyrins através das reações de adição de 4,7-dihydroisoindole». Tetrahedron. 67 (19): 3559–3566. doi:10.1016/j.tet.2011.01.052.
- ^ Tsifakis, Dimitrios; Charles, Christine; Boswell, Rod (2020-09-23). «Naphthalene as a Cubesat Cold Gas Thruster Propellant» (em inglês). Fronteiras em Física. 8: 389. Bibcode:2020FrP.....8..389T. doi:10.3389/fphy.2020.00389.1885/229663.
- ^ «New propulsion system using the key component in moth balls could propel satellites through space» (em inglês). Australian Broadcasting Corporation8 de Dezembro de 2021. Retrieved 11 de Dezembro, 2021.
- ^ Santucci K, Shah B (Jan 2000). «Associação de naftaleno com anemia hemolítica aguda». Acad Emerg Med. 7 (1): 42–7.10.1111/j.1553-2712.2000.tb01889.x. PMID 10894241.
- ^ Enciclopédia de MedlinePlus: Envenenamento de Naftaleno
- ^ «NTP Technical Reports 410 and 500» (em inglês). NTP Relatórios Técnicos 410 e 500, disponíveis a partir do NTP: Resumos e Relatórios de Longo Prazo. Arquivado do original em 24 de outubro de 2004. Retrieved 6 de Março, 2005.
- ^ IARC Monografias sobre a Avaliação de Riscos Carcinogênicos para Humanos. ISBN 978-92-832-1282-9. Retrieved 25 de Dezembro, 2008.
{{cite book}}:|work=ignorado (ajuda) - ^ Proposição 65 Arquivado em 2019-07-29 na Wayback Machine, Office of Environmental Health Hazard Assessment
- ^ "Os cientistas podem ter resolvido o mistério de mothballs cancerígenos", Fisorg.com, 20 de junho de 2006.
- ^ «Mothballs, air fresheners and Cancer» (em inglês). Associação de Saúde Ambiental da Nova Escócia. Retrieved 24 de Maio 2013.
- ^ «CDC - NIOSH Pocket Guide to Chemical Hazards - Naphthalene» (em inglês). Cdc.gov. Retrieved 6 de Março 2022.
- ^ Naftaleno (PDF). Epa.. Arquivado (PDF) do original em 2016-10-14. Retrieved 6 de Março 2022.
- ^ Alderson, Andrew (15 de novembro de 2008). "Mulheres bem retas – agora os Eurocrats estão banindo bolas de traça". O Telegraph. Arquivado do original em 2022-01-12. Retrieved 2013-11-23.
- ^ Gray, Kerrina (17 de novembro de 2013). «Council alertou contra o uso de bolas de traça venenosa». Seu Guardião Local. Notícias (London) Ltd. Retrieved 2012-11-23.
- ^ 国) 院 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、 、
Ligações externas
- Naftaleno... Nacional Centro de Informações sobre Pesticide
- Naftaleno—EPA Site de Toxics de Ar
- Naftaleno (PIM 363) — principalmente na toxicidade de naftaleno
- Naftaleno—CDC – NIOSH Pocket Guide to Chemical Hazards
- Naftaleno na base de dados de propriedades de pesticidas (PPDB)
- . Enciclopédia Britannica. Vol. 19 (11a ed.). 1911. pp. 167–168.