Microscopia
Microscopia é o campo técnico do uso de microscópios para visualizar objetos e áreas de objetos que não podem ser vistos a olho nu (objetos que não estão dentro da faixa de resolução do olho normal). Existem três ramos bem conhecidos da microscopia: microscopia óptica, eletrônica e de sonda de varredura, juntamente com o campo emergente da microscopia de raios-X.
A microscopia óptica e a microscopia eletrônica envolvem a difração, reflexão ou refração da radiação eletromagnética/feixes de elétrons que interagem com a amostra e a coleta da radiação espalhada ou outro sinal para criar uma imagem. Este processo pode ser realizado por irradiação de campo amplo da amostra (por exemplo, microscopia de luz padrão e microscopia eletrônica de transmissão) ou por varredura de um feixe fino sobre a amostra (por exemplo, microscopia confocal de varredura a laser e microscopia eletrônica de varredura). A microscopia de sonda de varredura envolve a interação de uma sonda de varredura com a superfície do objeto de interesse. O desenvolvimento da microscopia revolucionou a biologia, deu origem ao campo da histologia e, portanto, continua sendo uma técnica essencial na vida e nas ciências físicas. A microscopia de raios-X é tridimensional e não destrutiva, permitindo imagens repetidas da mesma amostra para estudos in situ ou 4D e fornecendo a capacidade de "ver dentro" a amostra que está sendo estudada antes de sacrificá-la para técnicas de resolução mais alta. Um microscópio de raios X 3D utiliza a técnica de tomografia computadorizada (microCT), girando a amostra em 360 graus e reconstruindo as imagens. A TC é normalmente realizada com um monitor de tela plana. Um microscópio de raios X 3D emprega uma variedade de objetivas, por exemplo, de 4X a 40X e também pode incluir um painel plano.
História
O campo da microscopia (microscopia óptica) remonta pelo menos ao século XVII. Os primeiros microscópios, lentes de aumento de lente única com ampliação limitada, datam pelo menos desde o uso generalizado de lentes em óculos no século 13, mas microscópios compostos mais avançados apareceram pela primeira vez na Europa por volta de 1620. Os primeiros praticantes da microscopia incluem Galileo Galilei, que descobriu em 1610 que poderia focar seu telescópio para ver pequenos objetos de perto e Cornelis Drebbel, que pode ter inventado o microscópio composto por volta de 1620 Antonie van Leeuwenhoek desenvolveu um microscópio simples de ampliação muito alta na década de 1670 e é frequentemente considerado o primeiro reconhecido microscopista e microbiologista.
Microscopia óptica
A microscopia óptica ou de luz envolve a passagem da luz visível transmitida ou refletida pela amostra através de uma única lente ou de várias lentes para permitir uma visão ampliada da amostra. A imagem resultante pode ser detectada diretamente pelo olho, gravada em uma placa fotográfica ou capturada digitalmente. A única lente com seus anexos, ou o sistema de lentes e equipamentos de imagem, juntamente com o equipamento de iluminação apropriado, estágio de amostra e suporte, compõe o microscópio de luz básico. O desenvolvimento mais recente é o microscópio digital, que usa uma câmera CCD para focalizar a exibição de interesse. A imagem é mostrada em uma tela de computador, então oculares são desnecessários.
Limitações
As limitações da microscopia óptica padrão (microscopia de campo claro) estão em três áreas;
- A técnica só pode imagem escura ou fortemente refração objetos efetivamente.
- Há uma resolução limitada por difração dependendo do comprimento de onda incidente; na faixa visível, a resolução de microscopia óptica é limitada a aproximadamente 0,2 micrômetros (ver: microscópio) e o limite prático de ampliação para ~1500x.
- A luz fora de foco de pontos fora do plano focal reduz a clareza da imagem.
As células vivas, em particular, geralmente carecem de contraste suficiente para serem estudadas com sucesso, uma vez que as estruturas internas da célula são incolores e transparentes. A maneira mais comum de aumentar o contraste é corar as estruturas com corantes seletivos, mas isso geralmente envolve matar e fixar a amostra. A coloração também pode introduzir artefatos, que são detalhes estruturais aparentes causados pelo processamento da amostra e, portanto, não são características da amostra. Em geral, essas técnicas utilizam diferenças no índice de refração das estruturas celulares. A microscopia de campo claro é comparável a olhar através de uma janela de vidro: não se vê o vidro, mas apenas a sujeira no vidro. Há uma diferença, pois o vidro é um material mais denso, e isso cria uma diferença de fase da passagem da luz. O olho humano não é sensível a essa diferença de fase, mas soluções ópticas inteligentes foram criadas para transformar essa diferença de fase em uma diferença de amplitude (intensidade da luz).
Técnicas
Para melhorar o contraste da amostra ou realçar estruturas em uma amostra, técnicas especiais devem ser usadas. Uma grande variedade de técnicas de microscopia está disponível para aumentar o contraste ou rotular uma amostra.
- Quatro exemplos de técnicas de transiluminação usadas para gerar contraste em uma amostra de papel de tecido. 1.559 μm/pixel.
Campo claro
A microscopia de campo claro é a mais simples de todas as técnicas de microscopia de luz. A iluminação da amostra é via luz branca transmitida, ou seja, iluminada por baixo e observada por cima. As limitações incluem baixo contraste da maioria das amostras biológicas e baixa resolução aparente devido ao desfoque do material fora de foco. A simplicidade da técnica e a preparação mínima da amostra necessária são vantagens significativas.
Iluminação oblíqua
O uso de iluminação oblíqua (de lado) dá à imagem uma aparência tridimensional e pode destacar características invisíveis. Uma técnica mais recente baseada nesse método é o contraste de modulação de Hoffmann, um sistema encontrado em microscópios invertidos para uso em cultura de células. A iluminação oblíqua aumenta o contraste mesmo em espécimes claros, no entanto, como a luz entra fora do eixo, a posição de um objeto parece mudar conforme o foco é alterado. Essa limitação impossibilita técnicas como seccionamento óptico ou medição precisa no eixo z.
Campo escuro
A microscopia de campo escuro é uma técnica para melhorar o contraste de espécimes transparentes e não corados. A iluminação de campo escuro usa uma fonte de luz cuidadosamente alinhada para minimizar a quantidade de luz transmitida diretamente (não espalhada) que entra no plano da imagem, coletando apenas a luz espalhada pela amostra. O campo escuro pode melhorar drasticamente o contraste da imagem – especialmente de objetos transparentes – enquanto requer pouca configuração do equipamento ou preparação da amostra. No entanto, a técnica sofre com a baixa intensidade de luz na imagem final de muitas amostras biológicas e continua sendo afetada pela baixa resolução aparente.
Iluminação Rheinberg é uma variante da iluminação de campo escuro na qual filtros coloridos e transparentes são inseridos logo antes do condensador, de modo que os raios de luz em alta abertura sejam coloridos de forma diferente daqueles em baixa abertura (ou seja, o o fundo da amostra pode ser azul enquanto o objeto aparece vermelho auto-luminoso). Outras combinações de cores são possíveis, mas sua eficácia é bastante variável.
Coloração por dispersão
A coloração por dispersão é uma técnica óptica que resulta em uma imagem colorida de um objeto incolor. Esta é uma técnica de coloração óptica e não requer manchas ou corantes para produzir um efeito de cor. Existem cinco configurações diferentes de microscópio usadas na técnica mais ampla de coloração por dispersão. Eles incluem linha de Becke de campo claro, oblíqua, campo escuro, contraste de fase e coloração de dispersão de parada objetiva.
Contraste de fase
- Em microscopia eletrônica: Imagem de contraste de fase
Técnicas mais sofisticadas mostrarão diferenças proporcionais na densidade óptica. Contraste de fase é uma técnica amplamente utilizada que mostra diferenças no índice de refração como diferença de contraste. Foi desenvolvido pelo físico holandês Frits Zernike na década de 1930 (pelo qual recebeu o Prêmio Nobel em 1953). O núcleo de uma célula, por exemplo, aparecerá escuro contra o citoplasma circundante. O contraste é excelente; no entanto, não é para uso com objetos grossos. Freqüentemente, um halo é formado mesmo em torno de pequenos objetos, o que obscurece os detalhes. O sistema consiste em um anel circular no condensador, que produz um cone de luz. Este cone é sobreposto a um anel de tamanho semelhante dentro da objetiva de fase. Cada objetiva tem um anel de tamanho diferente, portanto, para cada objetiva, outra configuração de condensador deve ser escolhida. O anel na objetiva tem propriedades ópticas especiais: em primeiro lugar, reduz a intensidade da luz direta, mas, mais importante, cria uma diferença de fase artificial de cerca de um quarto de comprimento de onda. Como as propriedades físicas dessa luz direta mudaram, ocorre interferência com a luz difratada, resultando na imagem de contraste de fase. Uma desvantagem da microscopia de contraste de fase é a formação de halo (halo-anel de luz).
Contraste de interferência diferencial
Superior e muito mais caro é o uso de contraste de interferência. As diferenças na densidade óptica aparecerão como diferenças no relevo. Um núcleo dentro de uma célula realmente aparecerá como um glóbulo no sistema de contraste de interferência diferencial mais usado, de acordo com Georges Nomarski. No entanto, deve-se ter em mente que este é um efeito ótico, e o relevo não se assemelha necessariamente à forma real. O contraste é muito bom e a abertura do condensador pode ser usada totalmente aberta, reduzindo assim a profundidade de campo e maximizando a resolução.
O sistema consiste em um prisma especial (prisma de Nomarski, prisma de Wollaston) no condensador que divide a luz em um feixe comum e um feixe extraordinário. A diferença espacial entre os dois feixes é mínima (menor que a resolução máxima da objetiva). Após a passagem pelo corpo de prova, os feixes são reunidos por um prisma semelhante na objetiva.
Em uma amostra homogênea, não há diferença entre os dois feixes e nenhum contraste está sendo gerado. No entanto, perto de um limite de refração (digamos, um núcleo dentro do citoplasma), a diferença entre o feixe ordinário e o extraordinário gerará um relevo na imagem. O contraste de interferência diferencial requer uma fonte de luz polarizada para funcionar; dois filtros polarizadores devem ser colocados no caminho óptico, um abaixo do condensador (o polarizador) e o outro acima da objetiva (o analisador).
Nota: Nos casos em que o desenho óptico de um microscópio produz uma separação lateral apreciável dos dois feixes, temos o caso da microscopia de interferência clássica, que não resulta em imagens de relevo, mas pode, no entanto, ser utilizada para a determinação quantitativa de espessuras de massa de objetos microscópicos.
Reflexão de interferência
Uma técnica adicional que usa interferência é a microscopia de reflexão de interferência (também conhecida como contraste de interferência refletida ou RIC). Ele depende da adesão celular ao slide para produzir um sinal de interferência. Se não houver célula presa ao vidro, não haverá interferência.
A microscopia de reflexão de interferência pode ser obtida usando os mesmos elementos usados pelo DIC, mas sem os prismas. Além disso, a luz que está sendo detectada é refletida e não transmitida como quando o DIC é empregado.
Fluorescência

Quando certos compostos são iluminados com luz de alta energia, eles emitem luz de frequência mais baixa. Este efeito é conhecido como fluorescência. Freqüentemente, os espécimes mostram sua imagem de autofluorescência característica, com base em sua composição química.
Este método é de importância crítica nas ciências da vida modernas, pois pode ser extremamente sensível, permitindo a detecção de moléculas individuais. Muitos corantes fluorescentes podem ser usados para corar estruturas ou compostos químicos. Um método poderoso é a combinação de anticorpos acoplados a um fluoróforo como na imunocoloração. Exemplos de fluoróforos comumente usados são fluoresceína ou rodamina.
Os anticorpos podem ser feitos sob medida para um composto químico. Por exemplo, uma estratégia frequentemente utilizada é a produção artificial de proteínas, com base no código genético (DNA). Essas proteínas podem então ser usadas para imunizar coelhos, formando anticorpos que se ligam à proteína. Os anticorpos são então acoplados quimicamente a um fluoróforo e usados para rastrear as proteínas nas células em estudo.
Proteínas fluorescentes altamente eficientes, como a proteína fluorescente verde (GFP), foram desenvolvidas usando a técnica de biologia molecular de fusão de genes, um processo que liga a expressão do composto fluorescente à da proteína alvo. Essa proteína fluorescente combinada é, em geral, não tóxica ao organismo e raramente interfere na função da proteína em estudo. Células ou organismos geneticamente modificados expressam diretamente as proteínas marcadas com fluorescência, o que permite o estudo da função da proteína original in vivo.
O crescimento de cristais de proteína resulta em cristais de proteína e sal. Ambos são incolores e microscópicos. A recuperação dos cristais de proteína requer imagens que podem ser feitas pela fluorescência intrínseca da proteína ou usando microscopia de transmissão. Ambos os métodos requerem um microscópio ultravioleta, pois a proteína absorve luz a 280 nm. A proteína também fluorescerá a aproximadamente 353 nm quando excitada com luz de 280 nm.
Como a emissão de fluorescência difere em comprimento de onda (cor) da luz de excitação, uma imagem fluorescente ideal mostra apenas a estrutura de interesse que foi marcada com o corante fluorescente. Essa alta especificidade levou ao uso generalizado da microscopia de luz de fluorescência na pesquisa biomédica. Diferentes corantes fluorescentes podem ser usados para corar diferentes estruturas biológicas, que podem ser detectadas simultaneamente, embora ainda sejam específicas devido à cor individual do corante.
Para impedir que a luz de excitação alcance o observador ou o detector, são necessários conjuntos de filtros de alta qualidade. Estes consistem tipicamente em um filtro de excitação que seleciona a faixa de comprimentos de onda de excitação, um espelho dicróico e um filtro de emissão que bloqueia a luz de excitação. A maioria dos microscópios de fluorescência é operada no modo Epi-iluminação (iluminação e detecção de um lado da amostra) para diminuir ainda mais a quantidade de luz de excitação que entra no detector.
Veja também: microscópio de fluorescência de reflexão interna total neurociência
Confocal
A microscopia confocal de varredura a laser usa um feixe de laser focado (por exemplo, 488 nm) que é digitalizado na amostra para excitar a fluorescência ponto a ponto. A luz emitida é direcionada através de um orifício para evitar que luz fora de foco alcance o detector, geralmente um tubo fotomultiplicador. A imagem é construída em um computador, plotando as intensidades de fluorescência medidas de acordo com a posição do laser de excitação. Em comparação com a iluminação total da amostra, a microscopia confocal fornece uma resolução lateral ligeiramente superior e melhora significativamente o corte óptico (resolução axial). A microscopia confocal é, portanto, comumente usada onde a estrutura 3D é importante.
Uma subclasse de microscópios confocais são microscópios de disco giratório que são capazes de digitalizar vários pontos simultaneamente na amostra. Um disco correspondente com orifícios rejeita a luz fora de foco. O detector de luz em um microscópio de disco giratório é uma câmera digital, normalmente EM-CCD ou sCMOS.
Microscopia de dois fótons
Um microscópio de dois fótons também é um microscópio de varredura a laser, mas em vez de luz laser UV, azul ou verde, um laser infravermelho pulsado é usado para excitação. Somente no minúsculo foco do laser a intensidade é alta o suficiente para gerar fluorescência por excitação de dois fótons, o que significa que nenhuma fluorescência fora de foco é gerada e nenhum orifício é necessário para limpar a imagem. Isso permite imagens profundas no tecido espalhado, onde um microscópio confocal não seria capaz de coletar fótons com eficiência. Microscópios de dois fótons com detecção de campo amplo são freqüentemente usados para imagens funcionais, por exemplo, imagiologia de cálcio, no tecido cerebral. Eles são comercializados como microscópios multifótons por várias empresas, embora os ganhos de usar a excitação de 3 fótons em vez da excitação de 2 fótons sejam marginais.
Microscopia de iluminação de plano único e microscopia de fluorescência de folha de luz
Usando um plano de luz formado pelo foco da luz através de uma lente cilíndrica em um ângulo estreito ou pela varredura de uma linha de luz em um plano perpendicular ao eixo da objetiva, seções ópticas de alta resolução podem ser obtidas. A iluminação de plano único, ou iluminação de folha de luz, também é realizada usando técnicas de modelagem de feixe que incorporam expansores de feixe de prisma múltiplo. As imagens são capturadas por CCDs. Essas variantes permitem uma captura de imagem com relação sinal/ruído muito rápida e alta.
Microscopia multifotônica de campo amplo
A microscopia multifotônica de campo amplo refere-se a uma técnica de imagem óptica não linear na qual uma grande área do objeto é iluminada e visualizada sem a necessidade de digitalização. Altas intensidades são necessárias para induzir processos ópticos não lineares, como fluorescência de dois fótons ou geração de segundo harmônico. Nos microscópios multifotônicos de varredura, as altas intensidades são alcançadas focando fortemente a luz, e a imagem é obtida por varredura de feixe. Na microscopia multifotônica de campo amplo, as altas intensidades são melhor alcançadas usando uma fonte de laser pulsada amplificada opticamente para atingir um grande campo de visão (~100 µm). A imagem neste caso é obtida como um único quadro com uma câmera CCD sem a necessidade de varredura, tornando a técnica particularmente útil para visualizar processos dinâmicos simultaneamente no objeto de interesse. Com a microscopia multifóton de campo amplo, a taxa de quadros pode ser aumentada em até 1.000 vezes em comparação com a microscopia de varredura multifóton. No tecido espalhado, no entanto, a qualidade da imagem degrada rapidamente com o aumento da profundidade.
Deconvolução
A microscopia de fluorescência é uma técnica poderosa para mostrar estruturas especificamente marcadas em um ambiente complexo e fornecer informações tridimensionais de estruturas biológicas. No entanto, esta informação é obscurecida pelo fato de que, após a iluminação, todas as estruturas marcadas com fluorescência emitem luz, independentemente de estarem ou não em foco. Assim, uma imagem de uma determinada estrutura é sempre borrada pela contribuição da luz de estruturas que estão fora de foco. Esse fenômeno resulta em perda de contraste, especialmente quando se usam objetivas com alto poder de resolução, tipicamente objetivas de imersão em óleo com alta abertura numérica.
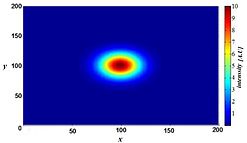
No entanto, o desfoque não é causado por processos aleatórios, como dispersão de luz, mas pode ser bem definido pelas propriedades ópticas da formação da imagem no sistema de imagem do microscópio. Se considerarmos uma pequena fonte de luz fluorescente (essencialmente um ponto brilhante), a luz que vem desse ponto se espalha mais longe de nossa perspectiva à medida que o ponto fica mais fora de foco. Sob condições ideais, isso produz uma "ampulheta" forma desta fonte pontual na terceira dimensão (axial). Essa forma é chamada de função de dispersão de ponto (PSF) do sistema de imagem do microscópio. Uma vez que qualquer imagem de fluorescência é composta por um grande número dessas pequenas fontes de luz fluorescente, diz-se que a imagem é "convolvida pela função de dispersão de ponto". O PSF matematicamente modelado de um sistema de imagem pulsado a laser terahertz é mostrado à direita.
A saída de um sistema de imagem pode ser descrita usando a equação:
S(x,Sim.)= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =PSF(x,Sim.)∗ ∗ o(x,Sim.)+n(x,y)=PSF(x,y)*o(x,y)+n}
Onde n é o ruído aditivo. Conhecer essa função de propagação de ponto significa que é possível reverter esse processo até certo ponto por métodos baseados em computador comumente conhecidos como microscopia de deconvolução. Existem vários algoritmos disponíveis para deconvolução 2D ou 3D. Eles podem ser classificados em métodos não restaurativos e restaurativos. Embora os métodos não restaurativos possam melhorar o contraste removendo a luz fora de foco dos planos focais, apenas os métodos restaurativos podem realmente reatribuir a luz ao seu local de origem adequado. O processamento de imagens fluorescentes dessa maneira pode ser uma vantagem sobre a aquisição direta de imagens sem luz fora de foco, como imagens de microscopia confocal, porque os sinais de luz eliminados tornam-se informações úteis. Para a deconvolução 3D, normalmente é fornecida uma série de imagens tiradas de diferentes planos focais (chamados de Z-stack) mais o conhecimento do PSF, que pode ser derivado experimental ou teoricamente do conhecimento de todos os parâmetros contribuintes do microscópio.
Técnicas de subdifração
Uma infinidade de técnicas de microscopia de super-resolução foram desenvolvidas recentemente que contornam o limite de difração.
Isso é obtido principalmente por imagens de uma amostra suficientemente estática várias vezes e modificando a luz de excitação ou observando mudanças estocásticas na imagem. Os métodos de deconvolução descritos na seção anterior, que removem o desfoque induzido pelo PSF e atribui um valor matematicamente 'correto' origem da luz, são usados, embora com uma compreensão ligeiramente diferente do que significa o valor de um pixel. Assumindo que na maior parte do tempo, um único fluoróforo contribui para um único blob em uma única imagem capturada, os blobs nas imagens podem ser substituídos por sua posição calculada, melhorando consideravelmente a resolução bem abaixo do limite de difração.
Para realizar tal suposição, o conhecimento e o controle químico sobre a fotofísica do fluoróforo estão no centro dessas técnicas, pelas quais são obtidas resoluções de ~ 20 nanômetros.
Microscopia amplificada codificada por tempo serial
A microscopia amplificada codificada em tempo serial (STEAM) é um método de imagem que fornece velocidade ultrarrápida do obturador e taxa de quadros, usando amplificação de imagem óptica para contornar a troca fundamental entre sensibilidade e velocidade e um fotodetector de pixel único para eliminar o necessidade de uma matriz de detectores e limitações de tempo de leitura O método é pelo menos 1000 vezes mais rápido do que as câmeras CCD e CMOS de última geração. Consequentemente, é potencialmente útil para aplicações científicas, industriais e biomédicas que requerem altas taxas de aquisição de imagens, incluindo diagnóstico em tempo real e avaliação de ondas de choque, microfluídica, MEMS e cirurgia a laser.
Extensões
A maioria dos instrumentos modernos oferece soluções simples para microfotografia e gravação eletrônica de imagens. No entanto, tais recursos nem sempre estão presentes e o microscopista mais experiente pode preferir uma imagem desenhada à mão a uma fotografia. Isso ocorre porque um microscopista com conhecimento do assunto pode converter com precisão uma imagem tridimensional em um desenho bidimensional preciso. Em uma fotografia ou outro sistema de captura de imagem, no entanto, apenas um plano fino está sempre em bom foco.
A criação de micrografias precisas requer uma técnica microscópica usando uma ocular monocular. É essencial que ambos os olhos estejam abertos e que o olho que não está observando no microscópio esteja concentrado em uma folha de papel na bancada ao lado do microscópio. Com prática, e sem mover a cabeça ou os olhos, é possível traçar com precisão as formas observadas "ver" a ponta do lápis na imagem microscópica.
É sempre menos cansativo observar com o microscópio focado para que a imagem seja vista no infinito e com os dois olhos sempre abertos.
Outras melhorias
Microespectroscopia: espectroscopia com um microscópio
Raio X
Como a resolução depende do comprimento de onda da luz. A microscopia eletrônica foi desenvolvida desde a década de 1930 que usa feixes de elétrons em vez de luz. Devido ao comprimento de onda muito menor do feixe de elétrons, a resolução é muito maior.
Embora menos comum, a microscopia de raios X também foi desenvolvida desde o final da década de 1940. A resolução da microscopia de raios X está entre a da microscopia de luz e a da microscopia eletrônica.
Microscopia eletrônica
Até a invenção da microscopia de subdifração, o comprimento de onda da luz limitava a resolução da microscopia tradicional a cerca de 0,2 micrômetros. Para obter maior resolução, o uso de um feixe de elétrons com um comprimento de onda muito menor é usado em microscópios eletrônicos.
- A microscopia eletrônica de transmissão (TEM) é bastante semelhante ao microscópio de luz composto, enviando um feixe de elétrons através de uma fatia muito fina do espécime. O limite de resolução em 2005 foi de cerca de 0,05 nanômetro e não aumentou significativamente desde então.
- A microscopia eletrônica de varredura (SEM) visualiza detalhes sobre as superfícies dos espécimes e dá uma visão 3D muito agradável. Dá resultados como os do microscópio de luz estéreo. A melhor resolução para SEM em 2011 foi 0,4 nanometer.
Microscópios eletrônicos equipados para espectroscopia de raios X podem fornecer análises elementares qualitativas e quantitativas. Este tipo de microscópio eletrônico, também conhecido como microscópio eletrônico analítico, pode ser uma ferramenta muito poderosa para a investigação de nanomateriais.
Microscopia de sonda de varredura
Esta é uma técnica de subdifração. Exemplos de microscópios de sonda de varredura são o microscópio de força atômica (AFM), o microscópio de tunelamento de varredura, o microscópio de força fotônica e o microscópio de rastreamento de recorrência. Todos esses métodos usam o contato físico de uma ponta de sonda sólida para escanear a superfície de um objeto, que deve ser quase plano.
Força ultrassônica
A microscopia de força ultrassônica (UFM) foi desenvolvida para melhorar os detalhes e o contraste da imagem em superfícies "planas" áreas de interesse onde as imagens AFM são limitadas em contraste. A combinação de AFM-UFM permite que uma imagem microscópica acústica de campo próximo seja gerada. A ponta AFM é usada para detectar as ondas ultrassônicas e supera a limitação de comprimento de onda que ocorre na microscopia acústica. Ao usar as mudanças elásticas sob a ponta do AFM, uma imagem com muito mais detalhes do que a topografia do AFM pode ser gerada.
A microscopia de força ultrassônica permite o mapeamento local da elasticidade na microscopia de força atômica pela aplicação de vibração ultrassônica ao cantilever ou amostra. Para analisar os resultados da microscopia de força ultrassônica de forma quantitativa, uma medição da curva força-distância é feita com vibração ultrassônica aplicada à base do cantilever, e os resultados são comparados com um modelo da dinâmica do cantilever e interação ponta-amostra baseado no técnica de diferenças finitas.
Microscopia ultravioleta
Os microscópios ultravioleta têm duas finalidades principais. A primeira é usar o comprimento de onda mais curto da energia eletromagnética ultravioleta para melhorar a resolução da imagem além do limite de difração dos microscópios ópticos padrão. Essa técnica é usada para inspeção não destrutiva de dispositivos com características muito pequenas, como as encontradas nos semicondutores modernos. A segunda aplicação para microscópios UV é o realce de contraste onde a resposta de amostras individuais é aumentada, em relação ao seu entorno, devido à interação da luz com as moléculas dentro da própria amostra. Um exemplo é o crescimento de cristais de proteínas. Cristais de proteínas são formados em soluções salinas. Como os cristais de sal e proteína são formados no processo de crescimento, e ambos são comumente transparentes ao olho humano, eles não podem ser diferenciados com um microscópio óptico padrão. Como o triptofano da proteína absorve a luz a 280 nm, a geração de imagens com um microscópio UV com filtros passa-banda de 280 nm simplifica a diferenciação entre os dois tipos de cristais. Os cristais de proteína aparecem escuros enquanto os cristais de sal são transparentes.
Microscopia infravermelha
O termo microscopia infravermelha refere-se à microscopia realizada em comprimentos de onda infravermelhos. Na configuração típica do instrumento, um Fourier Transform Infrared Spectrometer (FTIR) é combinado com um microscópio óptico e um detector infravermelho. O detector infravermelho pode ser um detector de ponto único, uma matriz linear ou uma matriz de plano focal 2D. O FTIR oferece a capacidade de realizar análises químicas por espectroscopia de infravermelho e o microscópio e o detector de ponto ou matriz permitem que essa análise química seja resolvida espacialmente, ou seja, realizada em diferentes regiões da amostra. Como tal, a técnica também é chamada de microespectroscopia infravermelha Uma arquitetura alternativa chamada Laser Direct Infrared (LDIR) Imaging envolve a combinação de uma fonte de luz infravermelha sintonizável e um detector de ponto único em uma objetiva voadora. Esta técnica é freqüentemente usada para imagens químicas infravermelhas, onde o contraste da imagem é determinado pela resposta de regiões de amostra individuais a comprimentos de onda de infravermelho específicos selecionados pelo usuário, geralmente bandas de absorção de infravermelho específicas e ressonâncias moleculares associadas. Uma limitação fundamental da microespectroscopia infravermelha convencional é que a resolução espacial é limitada pela difração. Especificamente, a resolução espacial é limitada a uma figura relacionada ao comprimento de onda da luz. Para microscópios IR práticos, a resolução espacial é limitada a 1-3x o comprimento de onda, dependendo da técnica específica e do instrumento usado. Para comprimentos de onda de infravermelho médio, isso define um limite de resolução espacial prático de ~3-30 μm.
Versões IR de microscopia de subdifração também existem. Estes incluem microscópio óptico de varredura de campo próximo IR (NSOM), microespectroscopia fototérmica e espectroscopia infravermelha baseada em microscópio de força atômica (AFM-IR), bem como microscopia óptica de campo próximo de varredura do tipo dispersão (s-SNOM) & nano-FTIR que fornecem resolução espacial em nanoescala em comprimentos de onda de infravermelho.
Microscopia holográfica digital
Na microscopia holográfica digital (DHM), as frentes de onda interferentes de uma fonte de luz coerente (monocromática) são registradas em um sensor. A imagem é reconstruída digitalmente por um computador a partir do holograma gravado. Além da imagem de campo claro comum, uma imagem de mudança de fase é criada.
O DHM pode operar tanto no modo de reflexão quanto no modo de transmissão. No modo de reflexão, a imagem de deslocamento de fase fornece uma medição de distância relativa e, portanto, representa um mapa topográfico da superfície refletora. No modo de transmissão, a imagem de deslocamento de fase fornece uma medição quantitativa sem etiqueta da espessura óptica da amostra. As imagens de mudança de fase de células biológicas são muito semelhantes às imagens de células coradas e foram analisadas com sucesso por software de análise de alto conteúdo.
Um recurso exclusivo do DHM é a capacidade de ajustar o foco após a gravação da imagem, pois todos os planos de foco são registrados simultaneamente pelo holograma. Esse recurso possibilita a imagem de partículas em movimento em um volume ou a varredura rápida de uma superfície. Outra característica atraente é a capacidade do DHM de usar ótica de baixo custo, corrigindo aberrações óticas por software.
Patologia digital (microscopia virtual)
A patologia digital é um ambiente de informação baseado em imagem habilitado pela tecnologia de computador que permite o gerenciamento de informações geradas a partir de uma lâmina digital. A patologia digital é possibilitada em parte pela microscopia virtual, que é a prática de converter lâminas de vidro em lâminas digitais que podem ser visualizadas, gerenciadas e analisadas.
Microscopia a laser
A microscopia a laser é um campo em rápido crescimento que usa fontes de iluminação a laser em várias formas de microscopia. Por exemplo, a microscopia a laser focada em aplicações biológicas usa lasers de pulso ultracurto, em várias técnicas rotuladas como microscopia não linear, microscopia de saturação e microscopia de excitação de dois fótons.
Lasers de raios X de laboratório de alta intensidade e pulso curto estão em desenvolvimento há vários anos. Quando essa tecnologia se concretizar, será possível obter imagens tridimensionais ampliadas de estruturas biológicas elementares no estado vivo em um instante definido com precisão. Para contraste ideal entre água e proteína e para melhor sensibilidade e resolução, o laser deve ser ajustado próximo à linha de nitrogênio em cerca de 0,3 nanômetros. A resolução será limitada principalmente pela expansão hidrodinâmica que ocorre enquanto o número necessário de fótons está sendo registrado. Assim, enquanto o espécime é destruído pela exposição, sua configuração pode ser capturada antes de explodir.
Os cientistas têm trabalhado em projetos práticos e protótipos para microscópios holográficos de raios-x, apesar do desenvolvimento prolongado do laser apropriado.
Microscopia fotoacústica
Uma técnica de microscopia baseada no efeito fotoacústico, ou seja, a geração de (ultra)som causada pela absorção de luz. Um feixe de laser focado e de intensidade modulada é escaneado sobre uma amostra. O (ultra) som gerado é detectado por meio de um transdutor de ultrassom. Comumente são empregados transdutores de ultrassom piezoelétricos.
O contraste da imagem está relacionado ao coeficiente de absorção da amostra α α - Sim.. Isto contrasta com a microscopia de campo brilhante ou escuro, onde o contraste de imagem é devido à transmissão ou dispersão. Em princípio, o contraste da microscopia de fluorescência é proporcional à absorção da amostra também. No entanto, em microscopia de fluorescência o rendimento quântico de fluorescência ? ? fEu...{displaystyle eta _{fl}} precisa ser desigual a zero para que um sinal possa ser detectado. Em microscopia fotoacústica, no entanto, cada substância absorvente dá um sinal fotoacústico PANão. PA que é proporcional
PA∝ ∝ α α ∗ ∗ )) ∗ ∗ ((1- Sim. - Sim. ? ? fEu...)∗ ∗ Eg+(EEu...umSeR- Sim. - Sim. Eg)){displaystyle PApropto alpha *Gamma *((1-eta _{fl})*E_{g}+(E_{laser}-E_{g})})}
Aqui. )) Não. "Gamma" é o coeficiente de Grüneisen, EEu...umSeR{displaystyle E_{laser}} é a energia do fóton do laser e Eg{displaystyle E_{g}} é a energia de lacuna da amostra. Portanto, a microscopia fotoacústica parece bem adequada como uma técnica complementar à microscopia de fluorescência, como um rendimento quântico de alta fluorescência leva a sinais de alta fluorescência e um baixo rendimento quântico de fluorescência leva a sinais fotoacústicos elevados.
Desconsiderando os efeitos não lineares, a resolução lateral dx é limitada pelo limite de difração de Abbe:
Dx= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =λ λ /(2∗ ∗ NA){displaystyle dx=lambda /(2*NA)}
Onde? λ λ - Sim. é o comprimento de onda do laser de excitação e NA é a abertura numérica da lente objetiva. O limite de difração Abbe mantém se a frente de onda de entrada é paralela. Na realidade, no entanto, o perfil de feixe de laser é Gaussian. Portanto, a fim de calcular a resolução alcançável, as fórmulas para vigas gaussianas truncadas têm de ser usadas.
Microscopia amadora
Microscopia amadora é a investigação e observação de espécimes biológicos e não biológicos para fins recreativos. Coletores de minerais, insetos, conchas e plantas podem usar microscópios como ferramentas para descobrir características que os ajudem a classificar seus itens coletados. Outros amadores podem estar interessados em observar a vida encontrada na água da lagoa e de outras amostras. Os microscópios também podem ser úteis para a avaliação da qualidade da água para pessoas que mantêm um aquário doméstico. A documentação fotográfica e o desenho das imagens microscópicas são prazeres adicionais. Existem concursos para a arte da fotomicrografia. Os participantes deste passatempo podem usar lâminas microscópicas preparadas comercialmente ou preparar suas próprias lâminas.
Embora a microscopia seja uma ferramenta central na documentação de espécimes biológicos, muitas vezes é insuficiente para justificar a descrição de uma nova espécie com base apenas em investigações microscópicas. Muitas vezes, testes genéticos e bioquímicos são necessários para confirmar a descoberta de uma nova espécie. Um laboratório e acesso à literatura acadêmica é uma necessidade. Há, porém, uma vantagem que os amadores têm sobre os profissionais: tempo para explorar o ambiente. Freqüentemente, amadores avançados se unem a profissionais para validar suas descobertas e possivelmente descrever novas espécies.
No final do século XIX, a microscopia amadora tornou-se um hobby popular nos Estados Unidos e na Europa. Vários 'amadores profissionais' estavam sendo pagos por suas viagens de amostragem e explorações microscópicas por filantropos, para mantê-los entretidos na tarde de domingo (por exemplo, o especialista em diatomáceas A. Grunow, sendo pago por (entre outros) um industrial belga). O professor John Phin publicou "Practical Hints on the Selection and Use of the Microscope (Second Edition, 1878)," e também foi o editor do "American Journal of Microscopy."
Exemplos de imagens de microscopia amadora:
Aplicação em ciência forense
A microscopia tem aplicações nas ciências forenses. O microscópio pode detectar, resolver e visualizar os menores itens de evidência, muitas vezes sem qualquer alteração ou destruição. O microscópio é usado para identificar e comparar fibras, cabelos, solos e poeira... etc.
Em marcas de tinta, manchas de sangue ou projéteis, nenhum tratamento de espécime é necessário e as evidências aparecem diretamente no exame microscópico. Para vestígios de matéria particular, a preparação da amostra deve ser feita antes do exame microscópico.
Os microscópios de luz são os mais usados em medicina forense, usando fótons para formar imagens, os microscópios mais aplicáveis para examinar espécimes forenses são os seguintes:
1. O microscópio composto
2. O microscópio de comparação
3. O microscópio estereoscópico
4. O microscópio polarizador
5. O microespectrofotômetro
Esta diversidade dos tipos de microscópios em aplicações forenses vem principalmente de suas faixas de ampliação, que são (1- 1200X), (50-30.000X) e (500- 250.000X) para a microscopia óptica, SEM e TEM respectivamente.
Contenido relacionado
Microsegundo
Amiga 3000
LambdaMOO