Metal alcalino
Os metais alcalinos consistem nos elementos químicos lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr). Juntamente com o hidrogênio, eles constituem o grupo 1, que se encontra no bloco s da tabela periódica. Todos os metais alcalinos têm seu elétron mais externo em um orbital s: essa configuração eletrônica compartilhada resulta em propriedades características muito semelhantes. De fato, os metais alcalinos fornecem o melhor exemplo de tendências de grupo em propriedades na tabela periódica, com elementos exibindo comportamento homólogo bem caracterizado. Esta família de elementos também é conhecida como a família do lítio devido ao seu elemento principal.
Os metais alcalinos são todos metais brilhantes, macios e altamente reativos em temperatura e pressão padrão e perdem prontamente seu elétron mais externo para formar cátions com carga +1. Todos eles podem ser cortados facilmente com uma faca devido à sua maciez, expondo uma superfície brilhante que embaça rapidamente ao ar devido à oxidação pela umidade atmosférica e oxigênio (e no caso do lítio, nitrogênio). Devido à sua alta reatividade, devem ser armazenados sob óleo para evitar reação com o ar, e são encontrados naturalmente apenas em sais e nunca como elementos livres. O césio, o quinto metal alcalino, é o mais reativo de todos os metais. Todos os metais alcalinos reagem com a água, com os metais alcalinos mais pesados reagindo mais vigorosamente do que os mais leves.
Todos os metais alcalinos descobertos ocorrem na natureza como seus compostos: em ordem de abundância, o sódio é o mais abundante, seguido pelo potássio, lítio, rubídio, césio e, finalmente, o frâncio, que é muito raro devido ao seu teor extremamente alto radioatividade; francium ocorre apenas em vestígios minúsculos na natureza como um passo intermediário em alguns ramos laterais obscuros das cadeias de decaimento natural. Experimentos foram conduzidos para tentar a síntese de ununênio (Uue), que provavelmente será o próximo membro do grupo; nenhum teve sucesso. No entanto, o ununênio pode não ser um metal alcalino devido aos efeitos relativísticos, que se prevê terem uma grande influência nas propriedades químicas dos elementos superpesados; mesmo que seja um metal alcalino, prevê-se que tenha algumas diferenças nas propriedades físicas e químicas de seus homólogos mais leves.
A maioria dos metais alcalinos tem muitas aplicações diferentes. Uma das aplicações mais conhecidas dos elementos puros é o uso de rubídio e césio em relógios atômicos, dos quais os relógios atômicos de césio formam a base do segundo. Uma aplicação comum dos compostos de sódio é a lâmpada de vapor de sódio, que emite luz com muita eficiência. O sal de mesa, ou cloreto de sódio, é usado desde a antiguidade. O lítio é usado como medicamento psiquiátrico e como ânodo em baterias de lítio. O sódio, o potássio e o lítio são elementos essenciais, tendo importantes funções biológicas como eletrólitos e, embora os outros metais alcalinos não sejam essenciais, eles também têm vários efeitos no organismo, tanto benéficos quanto prejudiciais.
História
Compostos de sódio são conhecidos desde os tempos antigos; o sal (cloreto de sódio) tem sido uma mercadoria importante nas atividades humanas, como atesta a palavra inglesa salário, referindo-se a salarium, dinheiro pago aos soldados romanos pela compra de sal . Embora a potassa tenha sido usada desde os tempos antigos, não foi entendida durante a maior parte de sua história como uma substância fundamentalmente diferente dos sais minerais de sódio. Georg Ernst Stahl obteve evidências experimentais que o levaram a sugerir a diferença fundamental dos sais de sódio e potássio em 1702, e Henri-Louis Duhamel du Monceau conseguiu provar essa diferença em 1736. A composição química exata dos compostos de potássio e sódio e a status como elemento químico de potássio e sódio, não era conhecido então, e assim Antoine Lavoisier não incluiu nenhum dos álcalis em sua lista de elementos químicos em 1789.
O potássio puro foi isolado pela primeira vez em 1807 na Inglaterra por Humphry Davy, que o derivou da potassa cáustica (KOH, hidróxido de potássio) pelo uso de eletrólise do sal fundido com a recém-inventada pilha voltaica. Tentativas anteriores de eletrólise do sal aquoso não tiveram sucesso devido à extrema reatividade do potássio. O potássio foi o primeiro metal a ser isolado por eletrólise. Mais tarde naquele mesmo ano, Davy relatou a extração de sódio da soda cáustica de substância semelhante (NaOH, soda cáustica) por uma técnica semelhante, demonstrando que os elementos e, portanto, os sais, são diferentes.
A petalita (Li Al Si4O10) foi descoberta em 1800 pelo químico brasileiro José Bonifácio de Andrada em uma mina na ilha de Utö, na Suécia. No entanto, foi somente em 1817 que Johan August Arfwedson, então trabalhando no laboratório do químico Jöns Jacob Berzelius, detectou a presença de um novo elemento ao analisar o minério de petalita. Este novo elemento foi notado por ele para formar compostos semelhantes aos de sódio e potássio, embora seu carbonato e hidróxido fossem menos solúveis em água e mais alcalinos do que os outros metais alcalinos. Berzelius deu ao material desconhecido o nome "lithion/lithina", da palavra grega λιθoς (transliterada como lithos, que significa "pedra"), para refletir sua descoberta em um mineral sólido, em oposição ao potássio, que havia sido descoberto em cinzas de plantas, e ao sódio, que era conhecido em parte por sua alta abundância no sangue animal. Ele chamou o metal dentro do material de "lítio". Lítio, sódio e potássio fizeram parte da descoberta da periodicidade, pois estão entre uma série de tríades de elementos do mesmo grupo que foram observados por Johann Wolfgang Döbereiner em 1850 como tendo propriedades semelhantes.
O rubídio e o césio foram os primeiros elementos a serem descobertos por meio do espectroscópio, inventado em 1859 por Robert Bunsen e Gustav Kirchhoff. No ano seguinte, eles descobriram césio na água mineral de Bad Dürkheim, na Alemanha. A descoberta do rubídio ocorreu no ano seguinte em Heidelberg, na Alemanha, encontrando-o no mineral lepidolita. Os nomes de rubídio e césio vêm das linhas mais proeminentes em seus espectros de emissão: uma linha vermelha brilhante para rubídio (da palavra latina rubidus, que significa vermelho escuro ou vermelho brilhante) e uma linha azul celeste linha para césio (derivada da palavra latina caesius, que significa céu azul).
Por volta de 1865, John Newlands produziu uma série de artigos onde listava os elementos em ordem crescente de peso atômico e propriedades físicas e químicas semelhantes que se repetiam em intervalos de oito; ele comparou tal periodicidade com as oitavas da música, onde as notas separadas por uma oitava têm funções musicais semelhantes. Sua versão coloca todos os metais alcalinos então conhecidos (lítio a césio), bem como cobre, prata e tálio (que mostram o estado de oxidação +1 característico dos metais alcalinos), juntos em um grupo. Sua mesa colocou o hidrogênio com os halogênios.
Depois de 1869, Dmitri Mendeleev propôs sua tabela periódica colocando o lítio no topo de um grupo com sódio, potássio, rubídio, césio e tálio. Dois anos depois, Mendeleev revisou sua tabela, colocando o hidrogênio no grupo 1 acima do lítio e também movendo o tálio para o grupo do boro. Nesta versão de 1871, cobre, prata e ouro foram colocados duas vezes, uma vez como parte do grupo IB e outra como parte de um "grupo VIII" abrangendo os grupos de 8 a 11 de hoje. Após a introdução da tabela de 18 colunas, os elementos do grupo IB foram movidos para sua posição atual no bloco d, enquanto os metais alcalinos foram deixados no grupo IA. Mais tarde, o nome do grupo foi alterado para grupo 1 em 1988. O nome trivial "metais alcalinos" vem do fato de que os hidróxidos dos elementos do grupo 1 são todos álcalis fortes quando dissolvidos em água.
Houve pelo menos quatro descobertas errôneas e incompletas antes de Marguerite Perey, do Instituto Curie em Paris, França, descobrir o frâncio em 1939, purificando uma amostra de actínio-227, que havia sido relatado como tendo uma energia de decaimento de 220 keV. No entanto, Perey notou partículas de decaimento com um nível de energia abaixo de 80 keV. Perey pensou que essa atividade de decaimento poderia ter sido causada por um produto de decaimento não identificado anteriormente, que foi separado durante a purificação, mas emergiu novamente do actínio-227 puro. Vários testes eliminaram a possibilidade de o elemento desconhecido ser tório, rádio, chumbo, bismuto ou tálio. O novo produto exibia propriedades químicas de um metal alcalino (como coprecipitar com sais de césio), o que levou Perey a acreditar que se tratava do elemento 87, causado pelo decaimento alfa do actínio-227. Perey então tentou determinar a proporção de decaimento beta para decaimento alfa no actínio-227. Seu primeiro teste colocou a ramificação alfa em 0,6%, um valor que ela posteriormente revisou para 1%.
- 227
89Acções
α (1.38%)→21.77 223
87Pe.
β- Sim.→22 min. 223
88Ra
α→11.4219
86RN
O próximo elemento abaixo do frâncio (eka-francium) na tabela periódica seria o ununênio (Uue), elemento 119. A síntese do ununênio foi tentada pela primeira vez em 1985, bombardeando um alvo de einstênio-254 com íons cálcio-48 em o acelerador superHILAC em Berkeley, Califórnia. Nenhum átomo foi identificado, levando a um rendimento limite de 300 nb.
- 25499E + 4820 → 302
119U
* → sem átomos
É altamente improvável que esta reação seja capaz de criar quaisquer átomos de ununênio em um futuro próximo, dada a tarefa extremamente difícil de produzir quantidades suficientes de einstênio-254, que é favorecido para a produção de elementos ultrapesados por causa de seu grande massa, meia-vida relativamente longa de 270 dias e disponibilidade em quantidades significativas de vários microgramas, para fazer um alvo grande o suficiente para aumentar a sensibilidade do experimento ao nível exigido; o einstênio não foi encontrado na natureza e só foi produzido em laboratório, e em quantidades menores do que as necessárias para a síntese efetiva de elementos superpesados. No entanto, dado que o ununênio é apenas o primeiro elemento do período 8 na tabela periódica estendida, ele pode muito bem ser descoberto em um futuro próximo por meio de outras reações e, de fato, uma tentativa de sintetizá-lo está em andamento no Japão. Atualmente, nenhum dos elementos do período 8 foi descoberto ainda, e também é possível, devido a instabilidades de gotejamento, que apenas os elementos do período 8 inferior, até cerca do elemento 128, sejam fisicamente possíveis. Nenhuma tentativa de síntese foi feita para quaisquer metais alcalinos mais pesados: devido ao seu número atômico extremamente alto, eles exigiriam métodos e tecnologias novos e mais poderosos para serem produzidos.
Ocorrência
No Sistema Solar

A regra de Oddo-Harkins afirma que os elementos com números atômicos pares são mais comuns do que aqueles com números atômicos ímpares, com exceção do hidrogênio. Esta regra argumenta que os elementos com números atômicos ímpares têm um próton desemparelhado e são mais propensos a capturar outro, aumentando assim seu número atômico. Em elementos com números atômicos pares, os prótons são emparelhados, com cada membro do par compensando o spin do outro, aumentando a estabilidade. Todos os metais alcalinos têm números atômicos ímpares e não são tão comuns quanto os elementos com números atômicos pares adjacentes a eles (os gases nobres e os metais alcalino-terrosos) no Sistema Solar. Os metais alcalinos mais pesados também são menos abundantes do que os mais leves, pois os metais alcalinos do rubídio só podem ser sintetizados em supernovas e não na nucleossíntese estelar. O lítio também é muito menos abundante que o sódio e o potássio, pois é mal sintetizado tanto na nucleossíntese do Big Bang quanto nas estrelas: o Big Bang só poderia produzir vestígios de lítio, berílio e boro devido à ausência de um núcleo estável com 5 ou 8 núcleons, e a nucleossíntese estelar só poderia passar por esse gargalo pelo processo triplo-alfa, fundindo três núcleos de hélio para formar carbono e pulando esses três elementos.
Na Terra
A Terra formou-se a partir da mesma nuvem de matéria que formou o Sol, mas os planetas adquiriram composições diferentes durante a formação e evolução do sistema solar. Por sua vez, a história natural da Terra fez com que partes deste planeta tivessem diferentes concentrações dos elementos. A massa da Terra é de aproximadamente 5,98×1024 kg. É composto principalmente de ferro (32,1%), oxigênio (30,1%), silício (15,1%), magnésio (13,9%), enxofre (2,9%), níquel (1,8%), cálcio (1,5%) e alumínio ( 1,4%); com os 1,2% restantes consistindo em vestígios de outros elementos. Devido à diferenciação planetária, acredita-se que a região do núcleo seja composta principalmente de ferro (88,8%), com quantidades menores de níquel (5,8%), enxofre (4,5%) e menos de 1% de oligoelementos.
Os metais alcalinos, devido a sua alta reatividade, não ocorrem naturalmente na forma pura na natureza. Eles são litófilos e, portanto, permanecem próximos à superfície da Terra porque combinam prontamente com o oxigênio e, portanto, associam-se fortemente à sílica, formando minerais de densidade relativamente baixa que não afundam no núcleo da Terra. Potássio, rubídio e césio também são elementos incompatíveis devido aos seus grandes raios iônicos.
Sódio e potássio são muito abundantes na Terra, estando ambos entre os dez elementos mais comuns na crosta terrestre; o sódio representa aproximadamente 2,6% da crosta terrestre medida em peso, tornando-se o sexto elemento mais abundante em geral e o metal alcalino mais abundante. O potássio representa aproximadamente 1,5% da crosta terrestre e é o sétimo elemento mais abundante. O sódio é encontrado em muitos minerais diferentes, dos quais o mais comum é o sal comum (cloreto de sódio), que ocorre em grandes quantidades dissolvidas na água do mar. Outros depósitos sólidos incluem halita, anfibólio, criolita, nitratina e zeólita. Muitos desses depósitos sólidos ocorrem como resultado da evaporação dos mares antigos, que ainda ocorre agora em lugares como o Grande Lago Salgado de Utah e o Mar Morto. Apesar de sua abundância quase igual na crosta terrestre, o sódio é muito mais comum do que o potássio no oceano, tanto porque o tamanho maior do potássio torna seus sais menos solúveis quanto porque o potássio está ligado a silicatos no solo e o que lixivia de potássio é absorvido muito mais prontamente pela vida vegetal do que o sódio.
Apesar de sua semelhança química, o lítio normalmente não ocorre junto com sódio ou potássio devido ao seu tamanho menor. Devido à sua reatividade relativamente baixa, pode ser encontrado na água do mar em grandes quantidades; estima-se que a água do mar seja de aproximadamente 0,14 a 0,25 partes por milhão (ppm) ou 25 micromolar. Sua relação diagonal com o magnésio geralmente permite que ele substitua o magnésio em minerais de ferromagnésio, onde sua concentração crustal é de cerca de 18 ppm, comparável à do gálio e do nióbio. Comercialmente, o mineral de lítio mais importante é o espodumênio, que ocorre em grandes depósitos em todo o mundo.
O rubídio é aproximadamente tão abundante quanto o zinco e mais abundante que o cobre. Ocorre naturalmente nos minerais leucita, polucita, carnalita, zinnwaldita e lepidolita, embora nenhum deles contenha apenas rubídio e nenhum outro metal alcalino. O césio é mais abundante do que alguns elementos comumente conhecidos, como antimônio, cádmio, estanho e tungstênio, mas é muito menos abundante do que o rubídio.
Frâncio-223, o único isótopo de frâncio que ocorre naturalmente, é o produto do decaimento alfa do actínio-227 e pode ser encontrado em quantidades vestigiais em minerais de urânio. Em uma determinada amostra de urânio, estima-se que haja apenas um átomo de frâncio para cada 1018 átomos de urânio. Foi calculado que existem no máximo 30 gramas de frâncio na crosta terrestre a qualquer momento, devido à sua meia-vida extremamente curta de 22 minutos.
Propriedades
Físico e químico
As propriedades físicas e químicas dos metais alcalinos podem ser facilmente explicadas por terem uma configuração eletrônica de valência ns1, o que resulta em uma ligação metálica fraca. Portanto, todos os metais alcalinos são macios e têm baixas densidades, pontos de fusão e ebulição, bem como calores de sublimação, vaporização e dissociação. Todos eles cristalizam na estrutura cristalina cúbica de corpo centrado e têm cores de chama distintas porque o elétron externo é facilmente excitado. A configuração ns1 também resulta em metais alcalinos com raios atômicos e iônicos muito grandes, bem como condutividade térmica e elétrica muito alta. Sua química é dominada pela perda de seu elétron de valência solitário no orbital s mais externo para formar o estado de oxidação +1, devido à facilidade de ionizar esse elétron e à segunda energia de ionização muito alta. A maior parte da química foi observada apenas para os cinco primeiros membros do grupo. A química do frâncio não está bem estabelecida devido à sua extrema radioatividade; assim, a apresentação de suas propriedades aqui é limitada. O pouco que se sabe sobre o frâncio mostra que ele tem um comportamento muito próximo do césio, como esperado. As propriedades físicas do frâncio são ainda mais incompletas porque o elemento volumoso nunca foi observado; portanto, quaisquer dados que possam ser encontrados na literatura são certamente extrapolações especulativas.
| Nome | Lítio | Sódio | Potássio | Rubículo | Cássio | Francium |
|---|---|---|---|---|---|---|
| Número atômico | 3 | 11 | 19 | 37 | 55 | 87 |
| Peso atômico padrão | 6.94(1) | 22.98976928(2) | 39.0983(1) | 85.4678 (3) | 132.9054519(2) | [223] |
| Configuração de eletron | Dois.1 | Três.1 | 4s1 | 5s1 | 6s1 | 7s1 |
| Ponto de fusão (°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| Ponto de ebulição (°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| Densidade (g·cm-3) | 0,534 | 0,968 | 0,809 | 1.532 | 1.93 | ? |
| Calor de fusão (kJ·mol- Sim.) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| Calor de vaporização (kJ·mol- Sim.) | 136 | 97.42 | 79.1 | 69 | 6.1. | ? |
| Calor de formação de gás monatômico (kJ·mol- Sim.) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| Resistência elétrica a 25 °C (nΩ·cm) | 94.7 | 48.8 | 73.9 | 131 | 208 | ? |
| Raio atômico (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| Raio iônico de hexacoordinate M+ (pm) | 76 | 102 | 138 | 152 | 167 | ? |
| Primeira energia de ionização (kJ·mol−1) | 520.2 | 495.8 | 418.8 | 403.0 | 375.7 | 39. |
| Afinidade electron (kJ·mol)- Sim.) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| Enthalpy da dissociação de M2(KJ·mol)- Sim.) | 10. | 73.6 | 57.3 | 45.6 | 44.77 | ? |
| Pauling electronicegativity | 0,98 | 0,93 | 0,802 | 0,802 | 0,789 | ? |
| Elétrons de Allen | 0.91 | 0,87 | 0,753 | 0.71 | 0.66 | 0,67 |
| Potencial padrão do eletrodo (EO quê?+→M0); V) | -3.04 | -2.71 | -2.93 | -2.98 | -3.03 | ? |
| Cor do teste de chama Comprimento de onda de emissão/absorção principal (nm) | Crimson 670.8 | Amarelo 589.2 | Violeta 76. | Vermelho-violeta 780.0 | Azul 455.5 | ? |
Os metais alcalinos são mais semelhantes entre si do que os elementos de qualquer outro grupo. De fato, a semelhança é tão grande que é muito difícil separar potássio, rubídio e césio, devido a seus raios iônicos semelhantes; lítio e sódio são mais distintos. Por exemplo, ao descer a tabela, todos os metais alcalinos conhecidos mostram aumento do raio atômico, diminuição da eletronegatividade, aumento da reatividade e diminuição dos pontos de fusão e ebulição, bem como calores de fusão e vaporização. Em geral, suas densidades aumentam ao descer a tabela, exceto que o potássio é menos denso que o sódio. Uma das pouquíssimas propriedades dos metais alcalinos que não apresenta uma tendência muito suave são seus potenciais de redução: o valor do lítio é anômalo, sendo mais negativo que os demais. Isso ocorre porque o íon Li+ tem uma energia de hidratação muito alta na fase gasosa: embora o íon lítio perturbe significativamente a estrutura da água, causando uma mudança maior na entropia, essa alta energia de hidratação é suficiente para fazem com que os potenciais de redução o indiquem como sendo o metal alcalino mais eletropositivo, apesar da dificuldade de ionizá-lo na fase gasosa.
Os metais alcalinos estáveis são todos os metais de cor prateada, exceto o césio, que tem uma tonalidade dourada pálida: é um dos três metais claramente coloridos (os outros dois são cobre e ouro). Além disso, os metais alcalino-terrosos pesados cálcio, estrôncio e bário, bem como os lantanídeos divalentes európio e itérbio, são amarelo pálido, embora a cor seja muito menos proeminente do que para o césio. Seu brilho embaça rapidamente no ar devido à oxidação. Todos eles cristalizam na estrutura cristalina cúbica de corpo centrado e têm cores de chama distintas porque o elétron externo é facilmente excitado. De fato, essas cores de teste de chama são a maneira mais comum de identificá-los, pois todos os seus sais com íons comuns são solúveis.
Todos os metais alcalinos são altamente reativos e nunca são encontrados em formas elementares na natureza. Por conta disso, costumam ser armazenados em óleo mineral ou querosene (óleo de parafina). Eles reagem agressivamente com os halogênios para formar os haletos de metais alcalinos, que são compostos cristalinos iônicos brancos que são todos solúveis em água, exceto o fluoreto de lítio (Li F). Os metais alcalinos também reagem com a água para formar hidróxidos fortemente alcalinos e, portanto, devem ser manuseados com muito cuidado. Os metais alcalinos mais pesados reagem mais vigorosamente que os mais leves; por exemplo, quando jogado na água, o césio produz uma explosão maior do que o potássio se o mesmo número de moles de cada metal for usado. Os metais alcalinos têm as primeiras energias de ionização mais baixas em seus respectivos períodos da tabela periódica devido à sua baixa carga nuclear efetiva e à capacidade de atingir uma configuração de gás nobre perdendo apenas um elétron. Os metais alcalinos não reagem apenas com a água, mas também com doadores de prótons como álcoois e fenóis, amônia gasosa e alcinos, os últimos demonstrando o grau fenomenal de sua reatividade. Seu grande poder como agentes redutores os torna muito úteis na liberação de outros metais de seus óxidos ou halogenetos.
A segunda energia de ionização de todos os metais alcalinos é muito alta, pois está em uma camada completa que também está mais próxima do núcleo; assim, eles quase sempre perdem um único elétron, formando cátions. Os álcalis são uma exceção: são compostos instáveis que contêm metais alcalinos em um estado de oxidação -1, o que é muito incomum, pois antes da descoberta dos álcalis, não se esperava que os metais alcalinos fossem capazes de formar ânions e pensava-se que capaz de aparecer em sais apenas como cátions. Os ânions alcalinos preencheram s-subcamadas, o que lhes dá estabilidade suficiente para existir. Todos os metais alcalinos estáveis, exceto o lítio, são conhecidos por serem capazes de formar álcalis, e os álcalis têm muito interesse teórico devido à sua estequiometria incomum e baixo potencial de ionização. Alcalídeos são quimicamente semelhantes aos eletretos, que são sais com elétrons aprisionados atuando como ânions. Um exemplo particularmente notável de um alcalóide é o "hidreto de sódio inverso", H+Na− (ambos os íons sendo complexados), em oposição ao sódio usual hidreto, Na+H−: é instável isoladamente, devido à sua alta energia resultante do deslocamento de dois elétrons do hidrogênio para o sódio, embora vários derivados sejam previstos para ser metaestável ou estável.
Em solução aquosa, os íons de metais alcalinos formam íons aqua da fórmula [M(H2O)n] +, onde n é o número de solvatação. Seus números de coordenação e formas concordam bem com aqueles esperados de seus raios iônicos. Em solução aquosa, as moléculas de água diretamente ligadas ao íon metálico pertencem à primeira esfera de coordenação, também conhecida como primeira camada de solvatação ou primária. A ligação entre uma molécula de água e o íon metálico é uma ligação covalente dativa, com o átomo de oxigênio doando ambos os elétrons para a ligação. Cada molécula de água coordenada pode ser ligada por pontes de hidrogênio a outras moléculas de água. Diz-se que estes últimos residem na segunda esfera de coordenação. No entanto, para os cátions de metais alcalinos, a segunda esfera de coordenação não é bem definida, pois a carga +1 no cátion não é alta o suficiente para polarizar as moléculas de água na camada de solvatação primária o suficiente para formar fortes ligações de hidrogênio com aquelas em a segunda esfera de coordenação, produzindo uma entidade mais estável. O número de solvatação para Li+ foi determinado experimentalmente como 4, formando o tetraédrico [Li(H2O)4] +: enquanto números de solvatação de 3 a 6 foram encontrados para íons aqua de lítio, números de solvatação menores que 4 podem ser o resultado da formação de pares de íons de contato, e os números de solvatação mais altos podem ser interpretados em termos de água moléculas que se aproximam de [Li(H2O)4]+ através de uma face do tetraedro, embora simulações de dinâmica molecular possam indicar a existência de um íon hexaaqua octaédrico. Provavelmente também existem seis moléculas de água na esfera de solvatação primária do íon sódio, formando o octaédrico [Na(H2O)6]+ íon. Embora se pensasse anteriormente que os metais alcalinos mais pesados também formavam íons hexaaquáticos octaédricos, descobriu-se que o potássio e o rubídio provavelmente formam o [K(H2O)8 ]+ e [Rb(H2O)8]+, que possuem a estrutura antiprismática quadrada, e esse césio forma a 12-coordenada [Cs(H2O)12]+.
Lítio
A química do lítio mostra várias diferenças em relação ao resto do grupo, pois o pequeno cátion Li+ polariza os ânions e dá aos seus compostos um caráter mais covalente. O lítio e o magnésio têm uma relação diagonal devido aos seus raios atômicos semelhantes, de modo que apresentam algumas semelhanças. Por exemplo, o lítio forma um nitreto estável, uma propriedade comum entre todos os metais alcalino-terrosos (grupo do magnésio), mas única entre os metais alcalinos. Além disso, entre seus respectivos grupos, apenas o lítio e o magnésio formam compostos organometálicos com caráter covalente significativo (por exemplo, LiMe e MgMe2).
O fluoreto de lítio é o único haleto de metal alcalino que é pouco solúvel em água, e o hidróxido de lítio é o único hidróxido de metal alcalino que não é deliquescente. Por outro lado, o perclorato de lítio e outros sais de lítio com grandes ânions que não podem ser polarizados são muito mais estáveis do que os compostos análogos dos outros metais alcalinos, provavelmente porque Li+ tem uma alta energia de solvatação. Este efeito também significa que a maioria dos sais de lítio simples são comumente encontrados na forma hidratada, porque as formas anidras são extremamente higroscópicas: isso permite que sais como cloreto de lítio e brometo de lítio sejam usados em desumidificadores e condicionadores de ar.
Frâncio
Prevê-se também que o frâncio mostre algumas diferenças devido ao seu alto peso atômico, fazendo com que seus elétrons viajem a frações consideráveis da velocidade da luz e, assim, tornando os efeitos relativísticos mais proeminentes. Em contraste com a tendência de diminuição das eletronegatividades e energias de ionização dos metais alcalinos, prevê-se que a eletronegatividade e a energia de ionização do frâncio sejam maiores que as do césio devido à estabilização relativística dos elétrons 7s; além disso, espera-se que seu raio atômico seja anormalmente baixo. Assim, ao contrário da expectativa, o césio é o mais reativo dos metais alcalinos, não o frâncio. Todas as propriedades físicas conhecidas do frâncio também se desviam das tendências claras que vão do lítio ao césio, como a primeira energia de ionização, afinidade eletrônica e polarização do ânion, embora devido à escassez de dados conhecidos sobre o frâncio, muitas fontes fornecem valores extrapolados, ignorando que efeitos relativísticos tornam a tendência do lítio para o césio inaplicável no frâncio. Algumas das poucas propriedades do frâncio que foram previstas levando em conta a relatividade são a afinidade eletrônica (47,2 kJ/mol) e a entalpia de dissociação da molécula Fr2 (42,1 kJ/mol). A molécula CsFr é polarizada como Cs+Fr−, mostrando que a subcamada 7s do frâncio é muito mais fortemente afetada por efeitos relativísticos do que a subcamada 6s do césio. Além disso, espera-se que o superóxido de frâncio (FrO2) tenha um caráter covalente significativo, ao contrário dos outros superóxidos de metais alcalinos, devido às contribuições de ligação dos elétrons 6p do frâncio.
Nuclear
| Z. | Alkali metal | Estável | Décadas | instável: itálico odd-odd isótopos cor-de-rosa | ||
|---|---|---|---|---|---|---|
| 3 | lítio | 2 | — | 7 Li | 6 Li | |
| 11 | sódio | 1 | — | 23 Nao | ||
| 19 | potássio | 2 | 1 | 39 KK | 41 KK | 40 KK |
| 37 | rubi | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | caesium | 1 | — | 133 C | ||
| 87 | Franco | — | — | Nenhum isótopo primordial (223 Pe. é um nuclídeo radiogênico) | ||
| Radioactivo: 40K, t1/2 1.25 × 109 anos; 87Rb, t1/2-2001 4.9 × 1010. anos; 223Pe.1/2-2001 22.0 min. | ||||||
Todos os metais alcalinos têm números atômicos ímpares; portanto, seus isótopos devem ser ímpares (os números de prótons e nêutrons são ímpares) ou ímpares e pares (o número de prótons é ímpar, mas o número de nêutrons é par). Núcleos ímpares têm números de massa pares, enquanto núcleos ímpares pares têm números de massa ímpares. Os nuclídeos primordiais ímpares são raros porque a maioria dos núcleos ímpares são altamente instáveis em relação ao decaimento beta, porque os produtos de decaimento são pares-pares e, portanto, são mais fortemente ligados devido aos efeitos de emparelhamento nuclear.
Devido à grande raridade de núcleos ímpares-ímpares, quase todos os isótopos primordiais dos metais alcalinos são ímpares-pares (as exceções são o isótopo estável à luz lítio-6 e o radioisótopo de vida longa potássio-40). Para um determinado número de massa ímpar, pode haver apenas um único nuclídeo beta-estável, uma vez que não há diferença na energia de ligação entre par-ímpar e ímpar-par comparável àquela entre par-par e ímpar-ímpar, deixando outros nuclídeos do mesmo número de massa (isóbaros) livres para decaimento beta em direção ao nuclídeo de menor massa. Um efeito da instabilidade de um número ímpar de qualquer tipo de núcleons é que os elementos ímpares, como os metais alcalinos, tendem a ter menos isótopos estáveis do que os elementos pares. Dos 26 elementos monoisotópicos que possuem apenas um único isótopo estável, todos, exceto um, têm um número atômico ímpar e todos, exceto um, também possuem um número par de nêutrons. O berílio é a única exceção a ambas as regras, devido ao seu baixo número atômico.
Todos os metais alcalinos, exceto lítio e césio, têm pelo menos um radioisótopo de ocorrência natural: sódio-22 e sódio-24 são vestígios de radioisótopos produzidos cosmogenicamente, potássio-40 e rubídio-87 têm meias-vidas muito longas e, portanto, ocorrem naturalmente , e todos os isótopos do frâncio são radioativos. O césio também foi considerado radioativo no início do século 20, embora não tenha radioisótopos naturais. (O frâncio ainda não havia sido descoberto naquela época.) O radioisótopo natural de longa duração do potássio, potássio-40, representa cerca de 0,012% do potássio natural e, portanto, o potássio natural é fracamente radioativo. Esta radioatividade natural tornou-se a base para uma afirmação equivocada da descoberta do elemento 87 (o próximo metal alcalino depois do césio) em 1925. O rubídio natural é similarmente ligeiramente radioativo, com 27,83% sendo o radioisótopo de vida longa rubídio-87.
O césio-137, com meia-vida de 30,17 anos, é um dos dois principais produtos de fissão de vida média, juntamente com o estrôncio-90, que são responsáveis pela maior parte da radioatividade do combustível nuclear irradiado após vários anos de resfriamento, até várias centenas de anos após o uso. Constitui a maior parte da radioatividade ainda deixada pelo acidente de Chernobyl. O césio-137 sofre decaimento beta de alta energia e eventualmente torna-se o bário-137 estável. É um forte emissor de radiação gama. O césio-137 tem uma taxa muito baixa de captura de nêutrons e não pode ser descartado dessa maneira, mas deve ser permitido decair. O césio-137 tem sido usado como traçador em estudos hidrológicos, análogo ao uso do trítio. Pequenas quantidades de césio-134 e césio-137 foram liberadas no meio ambiente durante quase todos os testes de armas nucleares e alguns acidentes nucleares, principalmente o acidente de Goiânia e o desastre de Chernobyl. A partir de 2005, o césio-137 é a principal fonte de radiação na zona de alienação em torno da usina nuclear de Chernobyl. Suas propriedades químicas como um dos metais alcalinos o tornam um dos mais problemáticos dos produtos de fissão de vida curta a média, porque se move e se espalha facilmente na natureza devido à alta solubilidade em água de seus sais, e é absorvido pelo corpo, que o confunde com seus congêneres essenciais, sódio e potássio.
Tendências periódicas
Os metais alcalinos são mais semelhantes entre si do que os elementos de qualquer outro grupo. Por exemplo, ao descer a tabela, todos os metais alcalinos conhecidos mostram aumento do raio atômico, diminuição da eletronegatividade, aumento da reatividade e diminuição dos pontos de fusão e ebulição, bem como calores de fusão e vaporização. Em geral, suas densidades aumentam ao descer a tabela, exceto que o potássio é menos denso que o sódio.
Raios atômicos e iônicos
Os raios atômicos dos metais alcalinos aumentam ao longo do grupo. Por causa do efeito de blindagem, quando um átomo tem mais de uma camada de elétrons, cada elétron sente repulsão elétrica dos outros elétrons, bem como atração elétrica do núcleo. Nos metais alcalinos, o elétron mais externo sente apenas uma carga líquida de +1, já que parte da carga nuclear (que é igual ao número atômico) é cancelada pelos elétrons internos; o número de elétrons internos de um metal alcalino é sempre um a menos que a carga nuclear. Portanto, o único fator que afeta o raio atômico dos metais alcalinos é o número de camadas eletrônicas. Como esse número aumenta ao longo do grupo, o raio atômico também deve aumentar ao longo do grupo.
Os raios iônicos dos metais alcalinos são muito menores que seus raios atômicos. Isso ocorre porque o elétron mais externo dos metais alcalinos está em uma camada eletrônica diferente dos elétrons internos e, portanto, quando é removido, o átomo resultante tem uma camada eletrônica a menos e é menor. Além disso, a carga nuclear efetiva aumentou e, assim, os elétrons são atraídos mais fortemente para o núcleo e o raio iônico diminui.
Primeira energia de ionização
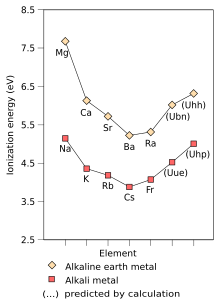
A primeira energia de ionização de um elemento ou molécula é a energia necessária para mover o elétron mais fracamente mantido de um mol de átomos gasosos do elemento ou moléculas para formar um mol de íons gasosos com carga elétrica +1. Os fatores que afetam a primeira energia de ionização são a carga nuclear, a quantidade de blindagem pelos elétrons internos e a distância do elétron mais frouxamente mantido do núcleo, que é sempre um elétron externo nos elementos do grupo principal. Os dois primeiros fatores alteram a carga nuclear efetiva que o elétron mais solto sente. Como o elétron mais externo dos metais alcalinos sempre sente a mesma carga nuclear efetiva (+1), o único fator que afeta a primeira energia de ionização é a distância do elétron mais externo ao núcleo. Como essa distância aumenta ao longo do grupo, o elétron mais externo sente menos atração do núcleo e, portanto, a primeira energia de ionização diminui. (Esta tendência é quebrada no frâncio devido à estabilização relativística e contração do orbital 7s, aproximando o elétron de valência do frâncio do núcleo do que seria esperado de cálculos não relativísticos. Isso torna o elétron mais externo do frâncio sente mais atração do núcleo, aumentando sua primeira energia de ionização ligeiramente além da do césio.)
A segunda energia de ionização dos metais alcalinos é muito maior do que a primeira, pois o segundo elétron mais solto faz parte de um invólucro de elétrons totalmente preenchido e, portanto, é difícil de remover.
Reatividade
As reatividades dos metais alcalinos aumentam ao longo do grupo. Este é o resultado de uma combinação de dois fatores: as primeiras energias de ionização e as energias de atomização dos metais alcalinos. Como a primeira energia de ionização dos metais alcalinos diminui ao longo do grupo, é mais fácil para o elétron mais externo ser removido do átomo e participar de reações químicas, aumentando assim a reatividade ao longo do grupo. A energia de atomização mede a força da ligação metálica de um elemento, que cai do grupo à medida que os átomos aumentam de raio e, portanto, a ligação metálica deve aumentar de comprimento, tornando os elétrons deslocalizados cada vez mais longe da atração dos núcleos do mais pesado metais alcalinos. Adicionando as energias de atomização e primeira ionização, obtém-se uma quantidade intimamente relacionada (mas não igual) à energia de ativação da reação de um metal alcalino com outra substância. Essa quantidade diminui ao longo do grupo, assim como a energia de ativação; assim, as reações químicas podem ocorrer mais rapidamente e a reatividade aumenta ao longo do grupo.
Eletronegatividade
A eletronegatividade é uma propriedade química que descreve a tendência de um átomo ou grupo funcional de atrair elétrons (ou densidade eletrônica) para si. Se a ligação entre o sódio e o cloro no cloreto de sódio fosse covalente, o par de elétrons compartilhados seria atraído pelo cloro porque a carga nuclear efetiva nos elétrons externos é +7 no cloro, mas é apenas +1 no sódio. O par de elétrons é atraído tão perto do átomo de cloro que eles são praticamente transferidos para o átomo de cloro (uma ligação iônica). No entanto, se o átomo de sódio for substituído por um átomo de lítio, os elétrons não serão atraídos tão perto do átomo de cloro quanto antes porque o átomo de lítio é menor, tornando o par de elétrons mais fortemente atraído pela carga nuclear efetiva mais próxima do lítio. Portanto, os átomos de metal alcalino maiores (mais abaixo no grupo) serão menos eletronegativos, pois o par de ligação é menos fortemente atraído por eles. Como mencionado anteriormente, espera-se que o frâncio seja uma exceção.
Devido à maior eletronegatividade do lítio, alguns de seus compostos têm um caráter mais covalente. Por exemplo, o iodeto de lítio (Li I) se dissolverá em solventes orgânicos, uma propriedade da maioria dos compostos covalentes. O fluoreto de lítio (LiF) é o único haleto alcalino que não é solúvel em água, e o hidróxido de lítio (LiOH) é o único hidróxido de metal alcalino que não é deliquescente.
Pontos de fusão e ebulição
O ponto de fusão de uma substância é o ponto em que ela muda do estado sólido para o líquido, enquanto o ponto de ebulição de uma substância (no estado líquido) é o ponto em que a pressão de vapor do líquido se iguala à pressão ambiental ao redor do líquido e todo o líquido muda de estado para gasoso. À medida que um metal é aquecido até seu ponto de fusão, as ligações metálicas que mantêm os átomos no lugar enfraquecem para que os átomos possam se mover, e as ligações metálicas eventualmente se quebram completamente no ponto de ebulição do metal. Portanto, a queda dos pontos de fusão e ebulição dos metais alcalinos indica que a resistência das ligações metálicas dos metais alcalinos diminui ao longo do grupo. Isso ocorre porque os átomos de metal são mantidos juntos pela atração eletromagnética dos íons positivos para os elétrons deslocalizados. À medida que os átomos aumentam de tamanho descendo no grupo (porque seu raio atômico aumenta), os núcleos dos íons se afastam dos elétrons deslocalizados e, portanto, a ligação metálica se torna mais fraca, de modo que o metal pode derreter e ferver mais facilmente, diminuindo assim os pontos de fusão e ebulição. (O aumento da carga nuclear não é um fator relevante devido ao efeito de blindagem.)
Densidade
Todos os metais alcalinos têm a mesma estrutura cristalina (cúbica de corpo centrado) e, portanto, os únicos fatores relevantes são o número de átomos que podem caber em um determinado volume e a massa de um dos átomos, uma vez que a densidade é definida como massa por unidade de volume. O primeiro fator depende do volume do átomo e, portanto, do raio atômico, que aumenta ao longo do grupo; assim, o volume de um átomo de metal alcalino aumenta descendo o grupo. A massa de um átomo de metal alcalino também aumenta ao longo do grupo. Assim, a tendência das densidades dos metais alcalinos depende de seus pesos atômicos e raios atômicos; se os valores para esses dois fatores forem conhecidos, as razões entre as densidades dos metais alcalinos podem ser calculadas. A tendência resultante é que as densidades dos metais alcalinos aumentam na tabela, com exceção do potássio. Por terem o menor peso atômico e o maior raio atômico de todos os elementos em seus períodos, os metais alcalinos são os metais menos densos da tabela periódica. Lítio, sódio e potássio são os únicos três metais na tabela periódica que são menos densos que a água: na verdade, o lítio é o sólido menos denso conhecido à temperatura ambiente.
Compostos
Os metais alcalinos formam séries completas de compostos com todos os ânions normalmente encontrados, que ilustram bem as tendências do grupo. Esses compostos podem ser descritos como envolvendo os metais alcalinos perdendo elétrons para espécies aceitadoras e formando íons monopositivos. Essa descrição é mais precisa para haletos alcalinos e se torna cada vez menos precisa à medida que as cargas catiônicas e aniônicas aumentam e o ânion se torna maior e mais polarizável. Por exemplo, a ligação iônica dá lugar à ligação metálica ao longo da série NaCl, Na2O, Na2S, Na3P, Na3As, Na3Sb, Na3Bi, Na.
Hidroxidos
Todos os metais alcalinos reagem vigorosa ou explosivamente com água fria, produzindo uma solução aquosa de um hidróxido de metal alcalino fortemente básico e liberando gás hidrogênio. Essa reação se torna mais vigorosa descendo o grupo: o lítio reage constantemente com efervescência, mas o sódio e o potássio podem entrar em combustão, e o rubídio e o césio afundam na água e geram gás hidrogênio tão rapidamente que ondas de choque se formam na água que podem quebrar recipientes de vidro. Quando um metal alcalino é jogado na água, ele produz uma explosão, da qual existem dois estágios separados. O metal reage primeiro com a água, quebrando as pontes de hidrogênio na água e produzindo gás hidrogênio; isso ocorre mais rapidamente para os metais alcalinos pesados mais reativos. Em segundo lugar, o calor gerado pela primeira parte da reação muitas vezes inflama o gás hidrogênio, fazendo com que ele queime explosivamente no ar circundante. Esta explosão secundária de gás hidrogênio produz a chama visível acima da tigela de água, lago ou outro corpo de água, não a reação inicial do metal com a água (que tende a acontecer principalmente debaixo d'água). Os hidróxidos de metais alcalinos são os hidróxidos mais básicos conhecidos.
Pesquisas recentes sugeriram que o comportamento explosivo dos metais alcalinos na água é impulsionado por uma explosão de Coulomb, e não apenas pela geração rápida do próprio hidrogênio. Todos os metais alcalinos fundem como parte da reação com a água. As moléculas de água ionizam a superfície metálica nua do metal líquido, deixando uma superfície metálica carregada positivamente e íons de água carregados negativamente. A atração entre o metal carregado e os íons de água aumentará rapidamente a área da superfície, causando um aumento exponencial da ionização. Quando as forças repulsivas dentro da superfície do metal líquido excedem as forças da tensão superficial, ele explode vigorosamente.
Os próprios hidróxidos são os hidróxidos mais básicos conhecidos, reagindo com ácidos para dar sais e com álcoois para dar alcóxidos oligoméricos. Eles reagem facilmente com dióxido de carbono para formar carbonatos ou bicarbonatos, ou com sulfeto de hidrogênio para formar sulfetos ou bissulfetos, e podem ser usados para separar tióis de petróleo. Eles reagem com óxidos anfóteros: por exemplo, os óxidos de alumínio, zinco, estanho e chumbo reagem com os hidróxidos de metais alcalinos para dar aluminatos, zincatos, estanatos e plumbatos. O dióxido de silício é ácido e, portanto, os hidróxidos de metais alcalinos também podem atacar o vidro de silicato.
Compostos intermetálicos
Os metais alcalinos formam muitos compostos intermetálicos entre si e os elementos dos grupos 2 a 13 na tabela periódica de estequiometrias variadas, como os amálgamas de sódio com mercúrio, incluindo Na5Hg8 e Na3Hg. Alguns deles têm características iônicas: tomando como exemplo as ligas com ouro, o mais eletronegativo dos metais, NaAu e KAu são metálicos, mas RbAu e CsAu são semicondutores. NaK é uma liga de sódio e potássio que é muito útil porque é líquida à temperatura ambiente, embora devam ser tomadas precauções devido à sua extrema reatividade em relação à água e ao ar. A mistura eutética funde a -12,6 °C. Uma liga de 41% de césio, 47% de sódio e 12% de potássio tem o ponto de fusão mais baixo conhecido de qualquer metal ou liga, -78 °C.
Compostos com os elementos do grupo 13
Os compostos intermetálicos dos metais alcalinos com os elementos mais pesados do grupo 13 (alumínio, gálio, índio e tálio), como o NaTl, são maus condutores ou semicondutores, ao contrário das ligas normais com os elementos anteriores, o que implica que o álcali o metal envolvido perdeu um elétron para os ânions Zintl envolvidos. No entanto, enquanto os elementos do grupo 14 e além tendem a formar grupos aniônicos discretos, os elementos do grupo 13 tendem a formar íons poliméricos com os cátions de metais alcalinos localizados entre a rede iônica gigante. Por exemplo, NaTl consiste em um ânion polimérico (—Tl−—)n com uma estrutura cúbica de diamante covalente com íons Na+ localizados entre os rede aniônica. Os metais alcalinos maiores não podem se encaixar de maneira semelhante em uma rede aniônica e tendem a forçar os elementos mais pesados do grupo 13 a formar aglomerados aniônicos.
O boro é um caso especial, sendo o único não-metal do grupo 13. Os boretos de metais alcalinos tendem a ser ricos em boro, envolvendo ligações boro-boro apreciáveis envolvendo estruturas deltaédricas e são termicamente instáveis devido aos metais alcalinos terem uma alta pressão de vapor em temperaturas elevadas. Isso torna a síntese direta problemática porque os metais alcalinos não reagem com o boro abaixo de 700 °C e, portanto, isso deve ser realizado em recipientes selados com o metal alcalino em excesso. Além disso, excepcionalmente neste grupo, a reatividade com o boro diminui ao longo do grupo: o lítio reage completamente a 700 °C, mas o sódio a 900 °C e o potássio não até 1200 °C, e a reação é instantânea para o lítio, mas leva horas para o potássio. Os boretos de rubídio e césio nem sequer foram caracterizados. Várias fases são conhecidas, como LiB10, NaB6, NaB15 e KB6. Sob alta pressão, a ligação boro-boro nos boretos de lítio muda de seguir as regras de Wade para formar ânions Zintl como o resto do grupo 13.
Compostos com os elementos do grupo 14
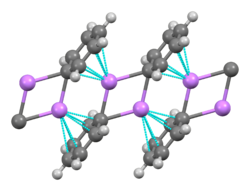
Lítio e sódio reagem com carbono para formar acetiletos, Li2C2 e Na2C2 , que também pode ser obtido pela reação do metal com acetileno. Potássio, rubídio e césio reagem com grafite; seus átomos são intercalados entre as camadas hexagonais de grafite, formando compostos de intercalação de grafite de fórmulas MC60 (cinza escuro, quase preto), MC48 (cinza escuro, quase preto), MC36 (azul), MC24 (azul aço) e MC8 (bronze) (M = K, Rb ou Cs) . Esses compostos são mais de 200 vezes mais condutores elétricos do que o grafite puro, sugerindo que o elétron de valência do metal alcalino é transferido para as camadas de grafite (por exemplo, M+C-8). Ao aquecer KC8, a eliminação de átomos de potássio resulta na conversão em sequência para KC24, KC36, KC48 e finalmente KC60. KC8 é um agente redutor muito forte e pirofórico e explode em contato com a água. Enquanto os metais alcalinos maiores (K, Rb e Cs) inicialmente formam MC8, os menores inicialmente formam MC6 e, de fato, requerem reação dos metais com grafite em altas temperaturas em torno de 500 °C para se formar. Além disso, os metais alcalinos são agentes redutores tão fortes que podem até mesmo reduzir o buckminsterfulereno para produzir fullerídeos sólidos MnC60; sódio, potássio, rubídio e césio podem formar fullerides onde n = 2, 3, 4 ou 6, e rubídio e césio adicionalmente podem atingir n = 1.
Quando os metais alcalinos reagem com os elementos mais pesados do grupo do carbono (silício, germânio, estanho e chumbo), formam-se substâncias iônicas com estruturas semelhantes a gaiolas, como os silicídios M4 Si4 (M = K, Rb ou Cs), que contém M+ e Si4−4 íons. A química dos germanetos de metais alcalinos, envolvendo o íon germaneto Ge4− e outros íons aglomerados (Zintl), como Ge2−4, Ge 4−9, Ge2−9 e [(Ge9)2]6 −, é amplamente análogo ao dos silicídios correspondentes. Estanitos de metais alcalinos são principalmente iônicos, às vezes com o íon estanito (Sn4−) e às vezes com íons Zintl mais complexos, como Sn4−9, que aparece no nonastanido tetrapotássico (K4Sn9). O íon plumbide monoatômico (Pb4−) é desconhecido e, de fato, sua formação é considerada energeticamente desfavorável; os plumbidos de metais alcalinos possuem íons Zintl complexos, como Pb4−9. Esses germanetos, estanitos e plumbietos de metais alcalinos podem ser produzidos pela redução de germânio, estanho e chumbo com sódio metálico em amônia líquida.
Nitretos e pnictídeos
O lítio, o mais leve dos metais alcalinos, é o único metal alcalino que reage com o nitrogênio em condições padrão, e seu nitreto é o único nitreto de metal alcalino estável. O nitrogênio é um gás não reativo porque quebrar a forte ligação tripla na molécula de dinitrogênio (N2) requer muita energia. A formação de um nitreto de metal alcalino consumiria a energia de ionização do metal alcalino (formando íons M+), a energia necessária para quebrar a ligação tripla em N2 e a formação de íons N3-, e toda a energia liberada da formação de um nitreto de metal alcalino é da energia de rede do nitreto de metal alcalino. A energia da rede é maximizada com íons pequenos e altamente carregados; os metais alcalinos não formam íons altamente carregados, apenas formando íons com carga +1, portanto apenas o lítio, o menor metal alcalino, pode liberar energia de rede suficiente para fazer a reação com o nitrogênio exotérmica, formando o nitreto de lítio. As reações dos outros metais alcalinos com nitrogênio não liberariam energia de rede suficiente e, portanto, seriam endotérmicas, de modo que não formariam nitretos em condições padrão. Nitreto de sódio (Na3N) e nitreto de potássio (K3N), embora existentes, são extremamente instáveis, sendo propensos a se decompor novamente em seus elementos constituintes e não podem ser produzido pela reação dos elementos uns com os outros em condições padrão. O impedimento estérico proíbe a existência de nitreto de rubídio ou césio. No entanto, o sódio e o potássio formam sais de azida incolores envolvendo o linear N−3 ânion; devido ao grande tamanho dos cátions de metais alcalinos, eles são termicamente estáveis o suficiente para poderem derreter antes de se decomporem.
Todos os metais alcalinos reagem prontamente com fósforo e arsênico para formar fosfetos e arsenetos com a fórmula M3Pn (onde M representa um metal alcalino e Pn representa um pnictogênio - fósforo, arsênico, antimônio, ou bismuto). Isso se deve ao maior tamanho dos íons P3− e As3−, de modo que menos energia de rede precisa ser liberada para a formação dos sais. Estes não são os únicos fosfetos e arsenetos dos metais alcalinos: por exemplo, o potássio tem nove diferentes fosfetos conhecidos, com fórmulas K3P, K4P3 , K5P4, KP, K4P6, K3 P7, K3P11, KP10.3 e KP15. Enquanto a maioria dos metais forma arsenetos, apenas os metais alcalinos e alcalino-terrosos formam principalmente arsenetos iônicos. A estrutura do Na3As é complexa com distâncias Na–Na incomumente curtas de 328–330 pm, que são mais curtas do que no sódio metálico, e isso indica que mesmo com esses metais eletropositivos a ligação não pode ser diretamente iônica . Outros arsenetos de metais alcalinos não conformes com a fórmula M3As são conhecidos, como LiAs, que tem brilho metálico e condutividade elétrica indicando a presença de alguma ligação metálica. Os antimonídeos são instáveis e reativos, pois o íon Sb3− é um forte agente redutor; a reação deles com ácidos forma o gás tóxico e instável estibina (SbH3). De fato, eles têm algumas propriedades metálicas, e os antimonetos de metais alcalinos da estequiometria MSb envolvem átomos de antimônio ligados em uma estrutura espiral Zintl. Os bismutos nem sequer são totalmente iônicos; são compostos intermetálicos contendo ligações parcialmente metálicas e parcialmente iônicas.
Óxidos e calcogenetos
Todos os metais alcalinos reagem vigorosamente com o oxigênio em condições padrão. Eles formam vários tipos de óxidos, como óxidos simples (contendo o íon O2−), peróxidos (contendo o O2−2 íon, onde há uma ligação simples entre os dois átomos de oxigênio), superóxidos (contendo a classe O-2 ion), e muitos outros. O lítio queima no ar para formar óxido de lítio, mas o sódio reage com o oxigênio para formar uma mistura de óxido de sódio e peróxido de sódio. O potássio forma uma mistura de peróxido de potássio e superóxido de potássio, enquanto o rubídio e o césio formam exclusivamente o superóxido. A sua reatividade aumenta ao longo do grupo: enquanto o lítio, o sódio e o potássio apenas queimam no ar, o rubídio e o césio são pirofóricos (pegam fogo espontaneamente no ar).
Os metais alcalinos menores tendem a polarizar os ânions maiores (o peróxido e o superóxido) devido ao seu pequeno tamanho. Isso atrai os elétrons nos ânions mais complexos para um de seus átomos de oxigênio constituintes, formando um íon de óxido e um átomo de oxigênio. Isso faz com que o lítio forme o óxido exclusivamente na reação com o oxigênio à temperatura ambiente. Este efeito torna-se drasticamente mais fraco para o sódio e o potássio maiores, permitindo-lhes formar os peróxidos menos estáveis. O rubídio e o césio, no fundo do grupo, são tão grandes que até mesmo os superóxidos menos estáveis podem se formar. Como o superóxido libera mais energia quando formado, o superóxido é preferencialmente formado para os metais alcalinos maiores, onde os ânions mais complexos não são polarizados. (Os óxidos e peróxidos para esses metais alcalinos existem, mas não se formam na reação direta do metal com oxigênio em condições padrão.) Além disso, o tamanho pequeno do Li+ e do O2− contribui para a formação de uma estrutura de rede iônica estável. Sob condições controladas, no entanto, todos os metais alcalinos, com exceção do frâncio, são conhecidos por formar seus óxidos, peróxidos e superóxidos. Os peróxidos e superóxidos de metais alcalinos são poderosos agentes oxidantes. O peróxido de sódio e o superóxido de potássio reagem com o dióxido de carbono para formar o carbonato de metal alcalino e o gás oxigênio, o que permite sua utilização em purificadores de ar submarinos; a presença do vapor de água, naturalmente presente na respiração, torna ainda mais eficiente a eliminação do dióxido de carbono pelo superóxido de potássio. Todos os metais alcalinos estáveis, exceto o lítio, podem formar ozonídeos vermelhos (MO3) através da reação a baixa temperatura do hidróxido anidro em pó com o ozônio: os ozonídeos podem então ser extraídos usando amônia líquida. Eles se decompõem lentamente em condições padrão em superóxidos e oxigênio, e hidrolisam imediatamente em hidróxidos quando em contato com a água. Potássio, rubídio e césio também formam sesquióxidos M2O3, que podem ser melhor considerados peróxidos disuperóxidos, [(M+)4(O 2−2)(O-2)2].
O rubídio e o césio podem formar uma grande variedade de subóxidos com os metais em estados de oxidação formal abaixo de +1. O rubídio pode formar Rb6O e Rb9O2 (cor de cobre) após a oxidação no ar, enquanto o césio forma uma imensa variedade de óxidos , como o ozonídeo CsO3 e vários subóxidos de cores vivas, como Cs7O (bronze), Cs4O (vermelho-violeta ), Cs11O3 (violeta), Cs3O (verde escuro), CsO, Cs3 O2, bem como Cs7O2. O último deles pode ser aquecido sob vácuo para gerar Cs2O.
Os metais alcalinos também podem reagir de forma análoga com os calcogênios mais pesados (enxofre, selênio, telúrio e polônio), e todos os calcogenetos de metais alcalinos são conhecidos (com exceção do frâncio). A reação com um excesso de calcogênio pode resultar similarmente em calcogenetos inferiores, com íons de calcogênio contendo cadeias dos átomos de calcogênio em questão. Por exemplo, o sódio pode reagir com o enxofre para formar o sulfeto (Na2S) e vários polissulfetos com a fórmula Na2Sx ( x de 2 a 6), contendo o S2−
x íons. Devido à basicidade dos íons Se2− e Te2−, os selenetos e teluretos de metais alcalinos são alcalinos em solução; quando reagem diretamente com selênio e telúrio, poliselenetos e politeluretos de metais alcalinos são formados junto com os selenetos e teluretos com o Se2−
x e Te2−
x íons. Eles podem ser obtidos diretamente dos elementos na amônia líquida ou quando o ar não está presente, e são compostos incolores e solúveis em água que o ar oxida rapidamente de volta ao selênio ou telúrio. Os polonetos de metais alcalinos são todos compostos iônicos contendo o íon Po2−; eles são muito estáveis quimicamente e podem ser produzidos por reação direta dos elementos em torno de 300–400 °C.
Haletos, hidretos e pseudo-haletos
Os metais alcalinos estão entre os elementos mais eletropositivos da tabela periódica e, portanto, tendem a se ligar ionicamente aos elementos mais eletronegativos da tabela periódica, os halogênios (flúor, cloro, bromo, iodo e astato), formando sais conhecidos como os haletos de metais alcalinos. A reação é muito vigorosa e às vezes pode resultar em explosões. Todos os vinte halogenetos de metais alcalinos estáveis são conhecidos; os instáveis não são conhecidos, com exceção do astatide sódico, devido à grande instabilidade e raridade do astato e do frâncio. O mais conhecido dos vinte é certamente o cloreto de sódio, também conhecido como sal comum. Todos os haletos de metais alcalinos estáveis têm a fórmula MX onde M é um metal alcalino e X é um halogênio. Eles são todos sólidos cristalinos iônicos brancos que possuem altos pontos de fusão. Todos os haletos de metais alcalinos são solúveis em água, exceto o fluoreto de lítio (LiF), que é insolúvel em água devido à sua entalpia de rede muito alta. A alta entalpia de rede do fluoreto de lítio se deve aos pequenos tamanhos dos íons Li+ e F−, fazendo com que as interações eletrostáticas entre eles sejam fortes: um efeito semelhante ocorre para fluoreto de magnésio, consistente com a relação diagonal entre lítio e magnésio.
Os metais alcalinos também reagem de maneira semelhante com o hidrogênio para formar hidretos iônicos de metais alcalinos, onde o ânion hidreto atua como um pseudohaleto: estes são freqüentemente usados como agentes redutores, produzindo hidretos, hidretos de metais complexos ou gás hidrogênio. Outros pseudohalogenetos também são conhecidos, notadamente os cianetos. Estes são isoestruturais para os respectivos haletos, exceto para o cianeto de lítio, indicando que os íons de cianeto podem girar livremente. Óxidos ternários de haletos de metais alcalinos, como Na3ClO, K3BrO (amarelo), Na4Br2O, Na4I2O e K4Br2O também são conhecidos. Os poli-halogenetos são bastante instáveis, embora os de rubídio e césio sejam bastante estabilizados pelo fraco poder de polarização desses cátions extremamente grandes.
Complexos de coordenação
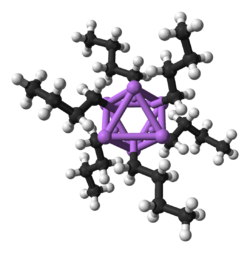
Os catiões de metais alcalinos não costumam formar complexos de coordenação com bases de Lewis simples devido à sua baixa carga de apenas +1 e ao seu tamanho relativamente grande; assim, o íon Li+ forma a maioria dos complexos e os íons de metais alcalinos mais pesados formam cada vez menos (embora ocorram exceções para complexos fracos). O lítio, em particular, tem uma química de coordenação muito rica na qual exibe números de coordenação de 1 a 12, embora a hexacoordenação octaédrica seja seu modo preferido. Em solução aquosa, os íons de metais alcalinos existem como complexos hexaidrato octaédricos ([M(H2O)6)]+), com o exceção do íon lítio, que devido ao seu pequeno tamanho forma complexos tetraédricos tetrahidratados ([Li(H2O)4)]+) ; os metais alcalinos formam esses complexos porque seus íons são atraídos por forças eletrostáticas de atração para as moléculas polares de água. Por causa disso, sais anidros contendo cátions de metais alcalinos são freqüentemente usados como dessecantes. Metais alcalinos também formam facilmente complexos com éteres coroa (por exemplo, 12-coroa-4 para Li+, 15-coroa-5 para Na+, 18-coroa-6 para K +, e 21-coroa-7 para Rb+) e criptandos devido à atração eletrostática.
Soluções de amônia
Os metais alcalinos se dissolvem lentamente em amônia líquida, formando soluções amoniacais de cátion metálico solvatado M+ e elétron solvatado e−, que reagem para formar gás hidrogênio e o álcali amida de metal (MNH2, onde M representa um metal alcalino): isso foi notado pela primeira vez por Humphry Davy em 1809 e redescoberto por W. Weyl em 1864. O processo pode ser acelerado por um catalisador. Soluções semelhantes são formadas pelos metais alcalino-terrosos divalentes pesados cálcio, estrôncio, bário, bem como pelos lantanídeos bivalentes, európio e itérbio. O sal de amida é bastante insolúvel e prontamente precipita da solução, deixando soluções de amônia intensamente coloridas dos metais alcalinos. Em 1907, Charles Krause identificou a cor como sendo devida à presença de elétrons solvatados, que contribuem para a alta condutividade elétrica dessas soluções. Em baixas concentrações (abaixo de 3 M), a solução é azul escura e tem dez vezes a condutividade do cloreto de sódio aquoso; em concentrações mais altas (acima de 3 M), a solução é cor de cobre e tem aproximadamente a condutividade de metais líquidos como o mercúrio. Além do sal de amida de metal alcalino e elétrons solvatados, tais soluções de amônia também contêm o cátion de metal alcalino (M+), o átomo de metal alcalino neutro (M), moléculas diatômicas de metal alcalino (M2) e ânions de metais alcalinos (M−). Estes são instáveis e, eventualmente, tornam-se a amida de metal alcalino mais termodinamicamente estável e o gás hidrogênio. Elétrons solvatados são poderosos agentes redutores e são freqüentemente usados em síntese química.
Organometálico
Organolítio
Sendo o menor metal alcalino, o lítio forma a maior variedade e os compostos organometálicos mais estáveis, que são ligados covalentemente. Os compostos de organolítio são sólidos ou líquidos voláteis eletricamente não condutores que se fundem a baixas temperaturas e tendem a formar oligômeros com a estrutura (RLi)x onde R é o grupo orgânico. Como a natureza eletropositiva do lítio coloca a maior parte da densidade de carga da ligação no átomo de carbono, criando efetivamente um carbânion, os compostos de organolítio são bases e nucleófilos extremamente poderosos. Para uso como bases, os butil-lítios são frequentemente usados e estão comercialmente disponíveis. Um exemplo de um composto de organolítio é o metil-lítio ((CH3Li)x), que existe na forma tetramérica (x = 4, tetraédricas) e formas hexaméricas (x = 6, octaédricas). Os compostos de organolítio, especialmente o n-butil-lítio, são reagentes úteis na síntese orgânica, como era de se esperar, dada a relação diagonal do lítio com o magnésio, que desempenha um papel importante na reação de Grignard. Por exemplo, alquil-lítios e aril-lítios podem ser usados para sintetizar aldeídos e cetonas por reação com carbonilas metálicas. A reação com níquel tetracarbonila, por exemplo, prossegue através de um complexo instável de acil-níquel carbonila que então sofre substituição eletrofílica para dar o aldeído desejado (usando H+ como eletrófilo) ou cetona (usando um haleto de alquila) produtos.
- LiR + [Ni(CO))4] -CO.→ Li+[RCONi (CO)]3]- Sim.
- Li+[RCONi (CO)]3]- Sim. H. H. H.+→solvente Li+ + RCHO + [(solvente)Ni(CO))3]
- Li+[RCONi (CO)]3]- Sim. R'Br→solvente Li+ + R'COR + [(solvente)Ni(CO))3]
Alquil-lítios e aril-lítios também podem reagir com N, N-amidas dissubstituídas para dar aldeídos e cetonas, e cetonas simétricas por meio da reação com monóxido de carbono. Eles se decompõem termicamente para eliminar um β-hidrogênio, produzindo alcenos e hidreto de lítio: outra rota é a reação de éteres com alquil- e aril-lítios que atuam como bases fortes. Em solventes apolares, os aril-lítios reagem como os carbânions que efetivamente são, transformando dióxido de carbono em ácidos carboxílicos aromáticos (ArCO2H) e arilcetonas em carbinóis terciários (Ar'2C(Ar)OH). Finalmente, eles podem ser usados para sintetizar outros compostos organometálicos através da troca de metal-halogênio.
Metais alcalinos mais pesados
Ao contrário dos compostos organolítios, os compostos organometálicos dos metais alcalinos mais pesados são predominantemente iônicos. A aplicação de compostos organossódicos em química é limitada em parte devido à competição de compostos organolítio, que estão comercialmente disponíveis e exibem uma reatividade mais conveniente. O principal composto organossódico de importância comercial é o ciclopentadieneto de sódio. O tetrafenilborato de sódio também pode ser classificado como um composto organossódico, pois no estado sólido o sódio está ligado aos grupos arila. Os compostos organometálicos dos metais alcalinos superiores são ainda mais reativos do que os compostos organossódicos e de utilidade limitada. Um reagente notável é a base de Schlosser, uma mistura de n-butil-lítio e terc-butóxido de potássio. Este reagente reage com o propeno para formar o composto alilpotássio (KCH2CHCH2). cis-2-buteno e trans-2-buteno se equilibram quando em contato com metais alcalinos. Considerando que a isomerização é rápida com lítio e sódio, é lenta com os metais alcalinos mais pesados. Os metais alcalinos mais pesados também favorecem a conformação estericamente congestionada. Várias estruturas cristalinas de compostos organopotássicos foram relatadas, estabelecendo que elas, como os compostos de sódio, são poliméricas. Os compostos organossódicos, organopotássicos, organorrubídicos e organocésios são todos principalmente iônicos e são insolúveis (ou quase) em solventes apolares.
Os derivados alquílicos e arílicos de sódio e potássio tendem a reagir com o ar. Provocam a clivagem dos éteres, gerando alcóxidos. Ao contrário dos compostos de alquil-lítio, os alquilsódios e os alquilpotássicos não podem ser produzidos pela reação dos metais com haletos de alquila porque o acoplamento de Wurtz ocorre:
- RM + R'X → R–R' + MX
Como tal, eles devem ser feitos pela reação de compostos de alquilmercúrio com sódio ou potássio metálico em solventes de hidrocarbonetos inertes. Enquanto o metilsódio forma tetrâmeros como o metil-lítio, o metil-potássio é mais iônico e tem a estrutura de arsenieto de níquel com ânions metil discretos e cátions de potássio.
Os metais alcalinos e seus hidretos reagem com hidrocarbonetos ácidos, por exemplo ciclopentadienos e alcinos terminais, para dar sais. Amônia líquida, éter ou solventes de hidrocarbonetos são usados, sendo o mais comum o tetraidrofurano. O mais importante desses compostos é o ciclopentadieneto de sódio, NaC5H5, um importante precursor de muitos derivados de ciclopentadienil de metais de transição. Da mesma forma, os metais alcalinos reagem com ciclooctatetraeno em tetrahidrofurano para dar ciclooctatetraenidos de metal alcalino; por exemplo, o ciclooctatetraenido dipotássico (K2C8H8) é um importante precursor de muitos derivados de ciclooctatetraenil de metal, como o uranoceno. Os grandes cátions de metais alcalinos de polarização muito fraca podem estabilizar grandes ânions aromáticos e radicais polarizáveis, como o naftaleno de sódio verde-escuro, Na+[C10H8•]−, um forte agente redutor.
Reações representativas de metais alcalinos
Reação com oxigênio
Ao reagir com o oxigênio, os metais alcalinos formam óxidos, peróxidos, superóxidos e subóxidos. No entanto, os três primeiros são mais comuns. A tabela abaixo mostra os tipos de compostos formados na reação com o oxigênio. O composto entre parênteses representa o produto menor da combustão.
| Alkali metal | Oxidação | Peróxido | Superóxido |
| Li | Li2O | (Li)2O2) | |
| Nao | (Na)2O) | Nao2O2 | |
| KK | KO2 | ||
| Rb | RbO2 | ||
| C | COSSO2 |
Os peróxidos de metais alcalinos são compostos iônicos instáveis em água. O ânion peróxido é fracamente ligado ao cátion e é hidrolisado, formando ligações covalentes mais fortes.
- Nao2O2 + 2H2O → 2NaOH + H2O2
Os outros compostos de oxigênio também são instáveis na água.
- 2KO2 + 2H2O → 2KOH + H2O2 + O2
- Li2O + H2O → 2LiOH
Reação com enxofre
Com o enxofre, formam sulfetos e polissulfetos.
- 2Na + 1/8S8 → Na2S + 1/8S8 → Na2S2Na...2S7
Como os sulfetos de metais alcalinos são essencialmente sais de um ácido fraco e uma base forte, eles formam soluções básicas.
- S2... + H2O → HS- Sim. + HO- Sim.
- HS- Sim. + H2O → H2S + HO- Sim.
Reação com nitrogênio
O lítio é o único metal que se combina diretamente com o nitrogênio à temperatura ambiente.
- 3Li + 1/3N2 → Li3N
Li3N pode reagir com a água para liberar amônia.
- Li3N + 3H2O → 3LiOH + NH3
Reação com hidrogênio
Com o hidrogênio, os metais alcalinos formam hidretos salinos que se hidrolisam em água.
- Na + H2 → NaH (em altas temperaturas)
- NaH + H2O → NaOH + H2
Reação com carbono
O lítio é o único metal que reage diretamente com o carbono para dar acetileto de dilítio. Na e K podem reagir com acetileno para dar acetiletos.
- 2Li + 2C → Li2C2
- Na + C2H. H. H.2 → NaC2H + 1/2H2 (em 150)0C)
- Na + NaC2H → Na2C2 (em 2200C)
Reação com água
Na reação com a água, eles geram íons hidróxido e gás hidrogênio. Esta reação é vigorosa e altamente exotérmica e o hidrogênio resultante pode inflamar no ar ou até mesmo explodir no caso de Rb e Cs.
- Na + H2O → NaOH + 1/2H2
Reação com outros sais
Os metais alcalinos são agentes redutores muito bons. Eles podem reduzir os cátions metálicos que são menos eletropositivos. O titânio é produzido industrialmente pela redução do tetracloreto de titânio com Na a 4000C (processo van Arkel–de Boer).
- TiCl4 + 4Na → 4NaCl + Ti
Reação com compostos organohaletos
Metais alcalinos reagem com derivados de halogênio para gerar hidrocarbonetos por meio da reação de Wurtz.
- 2CH3-Cl + 2Na → H3C-CH3 + 2NaCl
Metais alcalinos em amônia líquida
Metais alcalinos dissolvem-se em amônia líquida ou outros solventes doadores, como aminas alifáticas ou hexametilfosforamida para dar soluções azuis. Acredita-se que essas soluções contenham elétrons livres.
- Na + xNH3 → Na+ + e (NH3)x- Sim.
Devido à presença de elétrons solvatados, essas soluções são agentes redutores muito poderosos usados na síntese orgânica.
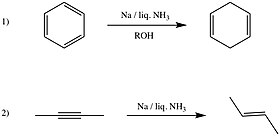
A reação 1) é conhecida como redução de bétula. Outras reduções que podem ser realizadas por essas soluções são:
- S8 + 2- Sim. → S82...
- Fe(CO)5 + 2- Sim. → Fe (CO)42... + CO
Extensões
Embora o frâncio seja o metal alcalino mais pesado já descoberto, existem alguns trabalhos teóricos prevendo as características físicas e químicas de hipotéticos metais alcalinos mais pesados. Sendo o primeiro elemento do período 8, o elemento não descoberto ununênio (elemento 119) é previsto para ser o próximo metal alcalino depois do frâncio e se comportar muito como seus congêneres mais leves; no entanto, também é previsto que difira dos metais alcalinos mais leves em algumas propriedades. Prevê-se que sua química esteja mais próxima da do potássio ou do rubídio, em vez do césio ou do frâncio. Isso é incomum, pois as tendências periódicas, ignorando os efeitos relativísticos, preveriam que o ununênio seria ainda mais reativo do que o césio e o frâncio. Esta reatividade reduzida é devida à estabilização relativística do elétron de valência do unênio, aumentando a primeira energia de ionização do unênio e diminuindo os raios metálicos e iônicos; este efeito já é visto para o frâncio. Isso pressupõe que o ununênio se comportará quimicamente como um metal alcalino, o que, embora provável, pode não ser verdade devido a efeitos relativísticos. A estabilização relativística do orbital 8s também aumenta a afinidade eletrônica do ununênio muito além daquela do césio e do frâncio; de fato, espera-se que o ununênio tenha uma afinidade eletrônica maior do que todos os metais alcalinos mais leves que ele. Os efeitos relativísticos também causam uma queda muito grande na polarização do unênio. Por outro lado, prevê-se que o ununênio continue a tendência de diminuição dos pontos de fusão ao longo do grupo, sendo esperado um ponto de fusão entre 0 °C e 30 °C.
A estabilização do elétron de valência do ununênio e, portanto, a contração do orbital 8s faz com que seu raio atômico seja reduzido para 240 pm, muito próximo ao do rubídio (247 pm), de modo que a química do ununênio em o estado de oxidação +1 deve ser mais semelhante à química do rubídio do que à do frâncio. Por outro lado, prevê-se que o raio iônico do íon Uue+ seja maior que o do Rb+, porque os orbitais 7p são desestabilizados e, portanto, maiores que o orbitais p das camadas inferiores. O ununênio também pode apresentar os estados de oxidação +3 e +5, que não são vistos em nenhum outro metal alcalino, além do estado de oxidação +1 que é característico dos outros metais alcalinos e também é o principal estado de oxidação de todos os metais conhecidos. metais alcalinos: isso ocorre devido à desestabilização e expansão do espinor 7p3/2, fazendo com que seus elétrons mais externos tenham uma energia de ionização menor do que seria esperado. De fato, espera-se que muitos compostos de ununênio tenham um grande caráter covalente, devido ao envolvimento dos elétrons 7p3/2 na ligação.
Não foi feito tanto trabalho prevendo as propriedades dos metais alcalinos além do unênio. Embora uma simples extrapolação da tabela periódica (pelo princípio aufbau) colocaria o elemento 169, unhexênio, sob ununênio, os cálculos de Dirac-Fock preveem que o próximo elemento após o ununênio com propriedades semelhantes a metais alcalinos pode ser o elemento 165, unhexênio, que está previsto para ter a configuração eletrônica [Og] 5g18 6f14 7d10 8s2 8p 1/22 9s1. Esse elemento seria intermediário em propriedades entre um metal alcalino e um elemento do grupo 11 e, embora suas propriedades físicas e atômicas estivessem mais próximas do primeiro, sua química pode estar mais próxima da deste último. Cálculos posteriores mostram que o unhexpentium seguiria a tendência de aumentar a energia de ionização além do césio, tendo uma energia de ionização comparável à do sódio, e que também deveria continuar a tendência de diminuir os raios atômicos além do césio, tendo um raio atômico comparável ao do potássio . No entanto, os elétrons 7d do unhexpentium também podem participar de reações químicas junto com o elétron 9s, possivelmente permitindo estados de oxidação além de +1, daí o provável comportamento de metal de transição do unhexpentium. Devido aos metais alcalinos e alcalino-terrosos serem ambos elementos do bloco s, essas previsões para as tendências e propriedades do ununênio e unhexpentium também são bastante semelhantes para os correspondentes metais alcalino-terrosos unbinilium (Ubn) e unhexhexium (Uhh). Unsepttrium, elemento 173, pode ser um homólogo ainda melhor e mais pesado do ununênio; com uma configuração eletrônica prevista de [Usb] 6g1, ele retorna à situação de metal alcalino de ter um elétron facilmente removido muito acima de uma camada p fechada em energia e espera-se que seja ainda mais reativo do que o césio.
As propriedades prováveis de outros metais alcalinos além do unseptrio ainda não foram exploradas em 2019 e podem ou não existir. Nos períodos 8 e acima da tabela periódica, os efeitos relativísticos e de estrutura de casca tornam-se tão fortes que as extrapolações de congêneres mais leves tornam-se completamente imprecisas. Além disso, os efeitos relativísticos e de estrutura de casca (que estabilizam os orbitais s e desestabilizam e expandem os orbitais d, f e g de camadas superiores) têm efeitos opostos, causando diferenças ainda maiores entre relativísticos e não relativísticos cálculos das propriedades de elementos com números atômicos tão altos. O interesse nas propriedades químicas do ununênio, unhexpentium e unseptrio decorre do fato de que eles estão localizados próximos aos locais esperados das ilhas de estabilidade, centradas nos elementos 122 (306Ubb) e 164 (482Uhq).
Pseudo-metais alcalinos
Muitas outras substâncias são semelhantes aos metais alcalinos em sua tendência de formar cátions monopositivos. Analogamente aos pseudohalógenos, eles às vezes são chamados de "pseudo-metais alcalinos". Essas substâncias incluem alguns elementos e muitos outros íons poliatômicos; os íons poliatômicos são especialmente semelhantes aos metais alcalinos em seu grande tamanho e fraco poder de polarização.
Hidrogênio
O elemento hidrogênio, com um elétron por átomo neutro, geralmente é colocado no topo do Grupo 1 da tabela periódica por causa de sua configuração eletrônica. Mas o hidrogênio normalmente não é considerado um metal alcalino; O hidrogênio metálico, que existe apenas em pressões muito altas, é conhecido por suas propriedades elétricas e magnéticas, não por suas propriedades químicas. Sob condições típicas, o hidrogênio puro existe como um gás diatômico que consiste em dois átomos por molécula (H2); no entanto, os metais alcalinos formam moléculas diatômicas (como dilítio, Li2) somente em altas temperaturas, quando estão no estado gasoso.
O hidrogênio, como os metais alcalinos, tem um elétron de valência e reage facilmente com os halogênios, mas as semelhanças terminam aí por causa do pequeno tamanho de um próton nu H+ em comparação com o metal alcalino cátions. Sua colocação acima do lítio se deve principalmente à sua configuração eletrônica. Às vezes é colocado acima do flúor devido às suas propriedades químicas semelhantes, embora a semelhança também não seja absoluta.
A primeira energia de ionização do hidrogênio (1312,0 kJ/mol) é muito maior do que a dos metais alcalinos. Como apenas um elétron adicional é necessário para preencher a camada mais externa do átomo de hidrogênio, o hidrogênio geralmente se comporta como um halogênio, formando o íon hidreto negativo, e muito ocasionalmente é considerado um halogênio com base nisso. (Os metais alcalinos também podem formar íons negativos, conhecidos como álcalis, mas estes são pouco mais que curiosidades de laboratório, sendo instáveis.) Um argumento contra essa colocação é que a formação de hidretos a partir do hidrogênio é endotérmica, ao contrário da formação exotérmica de haletos a partir dos halogênios. . O raio do ânion H− também não se encaixa na tendência de aumento de tamanho ao longo dos halogênios: de fato, H− é muito difuso porque seu único próton não pode controlar facilmente ambos elétrons. Esperava-se há algum tempo que o hidrogênio líquido apresentasse propriedades metálicas; embora tenha sido demonstrado que não é esse o caso, sob pressões extremamente altas, como as encontradas nos núcleos de Júpiter e Saturno, o hidrogênio se torna metálico e se comporta como um metal alcalino; nesta fase, é conhecido como hidrogênio metálico. A resistividade elétrica do hidrogênio metálico líquido a 3000 K é aproximadamente igual à do rubídio líquido e do césio a 2000 K nas respectivas pressões quando eles passam por uma transição de não-metal para metal.
A configuração eletrônica 1s1 do hidrogênio, embora análoga à dos metais alcalinos (ns1), é única porque não há subcamada 1p. Portanto, ele pode perder um elétron para formar o hidrônio H+ ou ganhar um para formar o íon hidreto H−. No primeiro caso, assemelha-se superficialmente aos metais alcalinos; no último caso, os halogênios, mas as diferenças devido à falta de um subnível 1p são importantes o suficiente para que nenhum dos grupos se ajuste bem às propriedades do hidrogênio. O grupo 14 também é um bom ajuste em termos de propriedades termodinâmicas, como energia de ionização e afinidade eletrônica, mas o hidrogênio não pode ser tetravalente. Assim, nenhuma das três colocações é inteiramente satisfatória, embora o grupo 1 seja a colocação mais comum (se for escolhida uma) por causa da configuração eletrônica e do fato de que o hidrônio é de longe a mais importante de todas as espécies monoatômicas de hidrogênio, sendo a base da química ácido-base. Como um exemplo das propriedades não ortodoxas do hidrogênio decorrentes de sua configuração eletrônica incomum e tamanho pequeno, o íon de hidrogênio é muito pequeno (raio em torno de 150 fm em comparação com o tamanho de 50–220 pm da maioria dos outros átomos e íons) e também é inexistente em sistemas condensados, exceto em associação com outros átomos ou moléculas. De fato, a transferência de prótons entre substâncias químicas é a base da química ácido-base. Também única é a capacidade do hidrogênio de formar ligações de hidrogênio, que são um efeito de fenômenos de transferência de carga, eletrostática e correlativa de elétrons. Embora ligações de lítio análogas também sejam conhecidas, elas são principalmente eletrostáticas. No entanto, o hidrogênio pode assumir o mesmo papel estrutural que os metais alcalinos em alguns cristais moleculares, e tem uma estreita relação com os metais alcalinos mais leves (especialmente o lítio).
Amônio e derivados
O íon amônio (NH+4) tem propriedades muito semelhantes aos metais alcalinos mais pesados, atuando como um intermediário de metal alcalino entre o potássio e o rubídio, e é frequentemente considerado um parente próximo. Por exemplo, a maioria dos sais de metais alcalinos são solúveis em água, uma propriedade compartilhada pelos sais de amônio. Espera-se que o amônio se comporte de forma estável como um metal (NH+4 íons em um mar de elétrons deslocalizados) a pressões muito altas (embora menos do que a pressão típica onde as transições do comportamento isolante para o metálico ocorrem por volta de 100 GPa) e podem ocorrer dentro dos gigantes de gelo Urano e Netuno , que podem ter impactos significativos em seus campos magnéticos internos. Estima-se que a transição de uma mistura de moléculas de amônia e di-hidrogênio para amônio metálico pode ocorrer em pressões logo abaixo de 25 GPa. Sob condições padrão, o amônio pode formar um amálgama metálico com o mercúrio.
Outros "pseudo-metais alcalinos" incluem os catiões alquilamónio, nos quais alguns dos átomos de hidrogénio no catião amónio são substituídos por grupos alquilo ou arilo. Em particular, os cátions de amônio quaternário (NR+4 ) são muito úteis, pois são carregados permanentemente e são frequentemente usados como uma alternativa ao caro Cs+ para estabilizar ânions muito grandes e facilmente polarizáveis, como HI-2. Os hidróxidos de tetraalquilamônio, como os hidróxidos de metais alcalinos, são bases muito fortes que reagem com o dióxido de carbono atmosférico para formar carbonatos. Além disso, o átomo de nitrogênio pode ser substituído por um átomo de fósforo, arsênico ou antimônio (os pnictogênios não metálicos mais pesados), criando um fosfônio (PH +4) ou arsônio (AsH +4) que pode ser substituído de forma semelhante; enquanto estibônio (SbH+4) em si não é conhecido, alguns de seus derivados orgânicos são caracterizados.
Cobaltoceno e derivados
Cobaltoceno, Co(C5H5)2, é um metaloceno, o cobalto análogo do ferroceno. É um sólido roxo escuro. O cobaltoceno tem 19 elétrons de valência, um a mais do que o normalmente encontrado em complexos de metais de organotransição, como seu parente muito estável, o ferroceno, de acordo com a regra dos 18 elétrons. Este elétron adicional ocupa um orbital que é antiligante em relação às ligações Co-C. Consequentemente, muitas reações químicas de Co(C5H5)2 são caracterizadas por sua tendência a perder este "extra" ; elétron, produzindo um cátion de 18 elétrons muito estável conhecido como cobaltocênio. Muitos sais de cobaltocênio coprecipitam com sais de césio, e o hidróxido de cobaltocênio é uma base forte que absorve o dióxido de carbono atmosférico para formar o carbonato de cobaltocênio. Como os metais alcalinos, o cobaltoceno é um forte agente redutor, e o decametilcobaltoceno é ainda mais forte devido ao efeito indutivo combinado dos dez grupos metil. O cobalto pode ser substituído por seu congênere mais pesado, o ródio, para dar o rodoceno, um agente redutor ainda mais forte. O iridoceno (envolvendo o irídio) seria presumivelmente ainda mais potente, mas não é muito bem estudado devido à sua instabilidade.
Tálio
O tálio é o elemento estável mais pesado do grupo 13 da tabela periódica. Na parte inferior da tabela periódica, o efeito do par inerte é bastante forte, devido à estabilização relativística do orbital 6s e à diminuição da energia de ligação à medida que os átomos aumentam de tamanho, de modo que a quantidade de energia liberada na formação de mais duas ligações não é vale a pena as altas energias de ionização dos elétrons 6s. Ele exibe o estado de oxidação +1 que todos os metais alcalinos conhecidos exibem, e os compostos de tálio com tálio em seu estado de oxidação +1 se assemelham aos compostos correspondentes de potássio ou prata estequiometricamente devido aos raios iônicos semelhantes do Tl+ (164 pm), íons K+ (152 pm) e Ag+ (129 pm). Às vezes era considerado um metal alcalino na Europa continental (mas não na Inglaterra) nos anos imediatamente seguintes à sua descoberta, e foi colocado logo após o césio como o sexto metal alcalino na tabela periódica de Dmitri Mendeleev de 1869 e Julius Lothar Meyer. 39;s 1868 tabela periódica. (A tabela periódica de Mendeleev de 1871 e a tabela periódica de Meyer de 1870 colocaram o tálio em sua posição atual no grupo boro e deixaram o espaço abaixo do césio em branco.) No entanto, o tálio também exibe o estado de oxidação +3, que não exibições conhecidas de metal alcalino (embora se preveja que o ununênio, o sétimo metal alcalino não descoberto, possivelmente exiba o estado de oxidação +3). O sexto metal alcalino é agora considerado frâncio. Enquanto Tl+ é estabilizado pelo efeito do par inerte, esse par inerte de elétrons 6s ainda é capaz de participar quimicamente, de modo que esses elétrons são estereoquimicamente ativos em solução aquosa. Além disso, os haletos de tálio (exceto TlF) são bastante insolúveis em água, e TlI tem uma estrutura incomum devido à presença do par inerte estereoquimicamente ativo no tálio.
Cobre, prata e ouro
Os metais do grupo 11 (ou metais cunhados), cobre, prata e ouro, são tipicamente categorizados como metais de transição, pois podem formar íons com d-shells incompletos. Fisicamente, eles têm pontos de fusão relativamente baixos e altos valores de eletronegatividade associados aos metais pós-transição. "O subnível d preenchido e o elétron s livre de Cu, Ag e Au contribuem para sua alta condutividade elétrica e térmica. Os metais de transição à esquerda do grupo 11 experimentam interações entre os elétrons s e o subnível d parcialmente preenchido que reduz a mobilidade dos elétrons." Quimicamente, os metais do grupo 11 se comportam como metais do grupo principal em seus estados de valência +1 e, portanto, são um pouco relacionados aos metais alcalinos: esta é uma das razões para serem rotulados anteriormente como "grupo IB", em paralelo os metais alcalinos' "grupo IA". Eles são ocasionalmente classificados como metais pós-transição. Seus espectros são análogos aos dos metais alcalinos. Seus íons monopositivos são paramagnéticos e não contribuem com cor para seus sais, como os dos metais alcalinos.
Na tabela periódica de Mendeleev de 1871, cobre, prata e ouro são listados duas vezes, uma vez no grupo VIII (com a tríade de ferro e metais do grupo da platina) e uma vez no grupo IB. No entanto, o Grupo IB foi colocado entre parênteses para observar que era uma tentativa. O principal critério de Mendeleev para a atribuição de grupos era o estado de oxidação máximo de um elemento: com base nisso, os elementos do grupo 11 não poderiam ser classificados no grupo IB, devido à existência de compostos de cobre (II) e ouro (III). sendo conhecido naquela época. No entanto, a eliminação do grupo IB tornaria o grupo I o único grupo principal (o grupo VIII foi rotulado como um grupo de transição) sem uma bifurcação A-B. Logo depois, a maioria dos químicos optou por classificar esses elementos no grupo IB e retirá-los do grupo VIII pela simetria resultante: essa foi a classificação predominante até o surgimento da moderna tabela periódica de 18 colunas de comprimento médio, que separava os álcalis metais e metais do grupo 11.
Os metais de cunhagem eram tradicionalmente considerados como uma subdivisão do grupo dos metais alcalinos, devido a eles compartilharem a configuração eletrônica característica s1 dos metais alcalinos (grupo 1: p6s1; grupo 11: d10s1). No entanto, as semelhanças estão amplamente confinadas às estequiometrias dos compostos +1 de ambos os grupos, e não às suas propriedades químicas. Isso decorre do subnível d preenchido, fornecendo um efeito de blindagem muito mais fraco no elétron s mais externo do que o subnível p preenchido, de modo que os metais da cunhagem têm energias de primeira ionização muito mais altas e raios iônicos menores do que os metais alcalinos correspondentes. Além disso, possuem maiores pontos de fusão, durezas e densidades, e menores reatividades e solubilidades em amônia líquida, além de possuírem caráter mais covalente em seus compostos. Finalmente, os metais alcalinos estão no topo da série eletroquímica, enquanto os metais cunhados estão quase no fundo. Os metais de cunhagem' A casca d preenchida é muito mais facilmente rompida do que a camada de metais alcalinos' camada p preenchida, de modo que a segunda e a terceira energias de ionização sejam mais baixas, permitindo estados de oxidação mais altos que +1 e uma química de coordenação mais rica, dando assim aos metais do grupo 11 um claro caráter de metal de transição. Particularmente notável é o ouro formando compostos iônicos com rubídio e césio, nos quais forma o íon auride (Au−) que também ocorre na forma solvatada em solução de amônia líquida: aqui o ouro se comporta como um pseudo-halógeno porque seu 5d A configuração 106s1 tem um elétron a menos que a configuração quase fechada 5d106s2 do mercúrio.
Produção e isolamento
A produção de metais alcalinos puros é um tanto complicada devido à sua extrema reatividade com substâncias comumente usadas, como a água. De seus minérios de silicato, todos os metais alcalinos estáveis podem ser obtidos da mesma maneira: o ácido sulfúrico é usado primeiro para dissolver o íon de metal alcalino desejado e os íons de alumínio(III) do minério (lixiviação), após o que a precipitação básica remove os íons de alumínio do mistura precipitando-a como o hidróxido. O restante carbonato de metal alcalino insolúvel é então precipitado seletivamente; o sal é então dissolvido em ácido clorídrico para produzir o cloreto. O resultado é então deixado evaporar e o metal alcalino pode então ser isolado. O lítio e o sódio são normalmente isolados por eletrólise de seus cloretos líquidos, com cloreto de cálcio normalmente adicionado para diminuir o ponto de fusão da mistura. Os metais alcalinos mais pesados, no entanto, são mais tipicamente isolados de uma maneira diferente, onde um agente redutor (normalmente sódio para potássio e magnésio ou cálcio para os metais alcalinos mais pesados) é usado para reduzir o cloreto de metal alcalino. O produto líquido ou gasoso (o metal alcalino) passa então por destilação fracionada para purificação. A maioria das rotas para os metais alcalinos puros requer o uso de eletrólise devido à sua alta reatividade; uma das poucas que não o faz é a pirólise da correspondente azida de metal alcalino, que produz o metal para sódio, potássio, rubídio e césio e o nitreto para o lítio.
Os sais de lítio devem ser extraídos da água de fontes minerais, piscinas de salmoura e depósitos de salmoura. O metal é produzido eletroliticamente a partir de uma mistura de cloreto de lítio fundido e cloreto de potássio.
O sódio ocorre principalmente na água do mar e no fundo do mar seco, mas agora é produzido por eletrólise do cloreto de sódio, diminuindo o ponto de fusão da substância para menos de 700 °C por meio do uso de uma célula Downs. O sódio extremamente puro pode ser produzido através da decomposição térmica da azida de sódio. O potássio ocorre em muitos minerais, como a silvita (cloreto de potássio). Anteriormente, o potássio era geralmente produzido a partir da eletrólise de cloreto de potássio ou hidróxido de potássio, encontrado extensivamente em lugares como Canadá, Rússia, Bielorrússia, Alemanha, Israel, Estados Unidos e Jordânia, em um método semelhante ao de como o sódio era produzido no final do século 1800 e início de 1900. Também pode ser produzido a partir da água do mar. No entanto, esses métodos são problemáticos porque o metal de potássio tende a se dissolver em seu cloreto fundido e vaporiza significativamente nas temperaturas de operação, formando potencialmente o superóxido explosivo. Como resultado, o potássio metálico puro agora é produzido pela redução de cloreto de potássio fundido com sódio metálico a 850°C.
- Na (g) + KCl (l)
Embora o sódio seja menos reativo que o potássio, esse processo funciona porque em temperaturas tão altas o potássio é mais volátil que o sódio e pode ser facilmente destilado, de modo que o equilíbrio se desloca para a direita para produzir mais gás de potássio e prossegue quase até a conclusão .
Metais como o sódio são obtidos por eletrólise de sais fundidos. Rb & Cs obtidos principalmente como produtos do processamento de Li. Para produzir césio puro, os minérios de césio e rubídio são triturados e aquecidos a 650 °C com sódio metálico, gerando uma liga que pode ser separada por meio de uma técnica de destilação fracionada. Como o césio metálico é muito reativo para ser manuseado, normalmente é oferecido como azida de césio (CsN3). O hidróxido de césio é formado quando o césio interage agressivamente com água e gelo (CsOH).
O rubídio é o 16º elemento mais prevalente na crosta terrestre, porém é bastante raro. Alguns minerais encontrados na América do Norte, África do Sul, Rússia e Canadá contêm rubídio. Alguns minerais de potássio (lepidolitas, biotitas, feldspato, carnalita) o contêm, juntamente com o césio. Polucita, carnalita, leucita e lepidolita são todos minerais que contêm rubídio. Como subproduto da extração do lítio, é obtido comercialmente da lepidolita. O rubídio também é encontrado em rochas e salmouras de potássio, que é um suprimento comercial. A maior parte do rubídio é agora obtida como subproduto do refino do lítio. O rubídio é usado em tubos de vácuo como um getter, um material que se combina e remove os gases residuais dos tubos de vácuo.
Por vários anos, nas décadas de 1950 e 1960, um subproduto da produção de potássio chamado Alkarb foi a principal fonte de rubídio. Alkarb continha 21% de rubídio, enquanto o restante era potássio e uma pequena fração de césio. Hoje, os maiores produtores de césio, por exemplo, a Tanco Mine em Manitoba, Canadá, produzem rubídio como subproduto da polucita. Hoje, um método comum para separar o rubídio do potássio e do césio é a cristalização fracionada de um alúmen de rubídio e césio (Cs, Rb)Al(SO4)2·12H2O, que produz alúmen de rubídio puro após aproximadamente 30 recristalizações. As aplicações limitadas e a falta de um mineral rico em rubídio limitam a produção de compostos de rubídio a 2 a 4 toneladas por ano. O césio, no entanto, não é produzido a partir da reação acima. Em vez disso, a mineração de minério de polucita é o principal método de obtenção de césio puro, extraído do minério principalmente por três métodos: digestão ácida, decomposição alcalina e redução direta. Ambos os metais são produzidos como subprodutos da produção de lítio: depois de 1958, quando o interesse nas propriedades termonucleares do lítio aumentou acentuadamente, a produção de rubídio e césio também aumentou proporcionalmente. Os metais puros de rubídio e césio são produzidos reduzindo seus cloretos com cálcio metálico a 750°C e baixa pressão.
Como resultado de sua extrema raridade na natureza, a maior parte do frâncio é sintetizada na reação nuclear 197Au + 18O → 210Fr + 5 n, produzindo frâncio-209, frâncio-210 e frâncio-211. A maior quantidade de frâncio já reunida até hoje é de cerca de 300.000 átomos neutros, que foram sintetizados usando a reação nuclear dada acima. Quando o único isótopo natural frâncio-223 é especificamente necessário, ele é produzido como o filho alfa do actínio-227, ele próprio produzido sinteticamente a partir da irradiação de nêutrons do rádio-226 natural, um dos filhos do urânio-238 natural.
Aplicativos
O lítio, o sódio e o potássio têm muitas aplicações, enquanto o rubídio e o césio são muito úteis em contextos académicos, mas ainda não têm muitas aplicações. O lítio é frequentemente usado em baterias de íon-lítio, e o óxido de lítio pode ajudar a processar a sílica. O estearato de lítio é um espessante e pode ser usado para fazer graxas lubrificantes; é produzido a partir de hidróxido de lítio, que também é usado para absorver dióxido de carbono em cápsulas espaciais e submarinos. O cloreto de lítio é usado como uma liga de brasagem para peças de alumínio. O lítio metálico é usado em ligas com magnésio e alumínio para dar ligas muito resistentes e leves.
Os compostos de sódio têm muitas aplicações, sendo a mais conhecida o cloreto de sódio como sal de mesa. Sais de sódio de ácidos graxos são usados como sabão. O metal de sódio puro também tem muitas aplicações, incluindo o uso em lâmpadas de vapor de sódio, que produzem luz muito eficiente em comparação com outros tipos de iluminação e podem ajudar a suavizar a superfície de outros metais. Sendo um forte agente redutor, é freqüentemente usado para reduzir muitos outros metais, como titânio e zircônio, de seus cloretos. Além disso, é muito útil como líquido de troca de calor em reatores nucleares de regeneração rápida devido ao seu baixo ponto de fusão, viscosidade e seção transversal para absorção de nêutrons.
Compostos de potássio são frequentemente usados como fertilizantes, pois o potássio é um elemento importante para a nutrição das plantas. O hidróxido de potássio é uma base muito forte e é usado para controlar o pH de várias substâncias. O nitrato de potássio e o permanganato de potássio são freqüentemente usados como poderosos agentes oxidantes. O superóxido de potássio é usado em máscaras respiratórias, pois reage com o dióxido de carbono para dar carbonato de potássio e gás oxigênio. Potássio metálico puro não é usado com frequência, mas suas ligas com sódio podem substituir o sódio puro em reatores nucleares de regeneração rápida.
O rubídio e o césio são frequentemente usados em relógios atômicos. Relógios atômicos de césio são extraordinariamente precisos; se um relógio tivesse sido feito na época dos dinossauros, estaria atrasado em menos de quatro segundos (depois de 80 milhões de anos). Por essa razão, os átomos de césio são usados como a definição do segundo. Os íons de rubídio são frequentemente usados em fogos de artifício roxos, e o césio é frequentemente usado em fluidos de perfuração na indústria do petróleo.
O frâncio não tem aplicações comerciais, mas devido à estrutura atômica relativamente simples do frâncio, entre outras coisas, tem sido usado em experimentos de espectroscopia, levando a mais informações sobre os níveis de energia e as constantes de acoplamento entre as partículas subatômicas. Estudos sobre a luz emitida por íons de frâncio-210 capturados por laser forneceram dados precisos sobre as transições entre os níveis de energia atômica, semelhantes aos previstos pela teoria quântica.
Papel biológico e precauções
Metais
Metais alcalinos puros são perigosamente reativos com ar e água e devem ser mantidos longe do calor, fogo, agentes oxidantes, ácidos, a maioria dos compostos orgânicos, halocarbonos, plásticos e umidade. Eles também reagem com dióxido de carbono e tetracloreto de carbono, de modo que os extintores de incêndio normais são contraproducentes quando usados em incêndios de metais alcalinos. Alguns extintores de pó seco Classe D projetados para incêndios de metal são eficazes, privando o fogo de oxigênio e resfriando o metal alcalino.
Os experimentos geralmente são conduzidos usando apenas pequenas quantidades de alguns gramas em uma capela. Pequenas quantidades de lítio podem ser eliminadas pela reação com água fria, mas os metais alcalinos mais pesados devem ser dissolvidos no isopropanol menos reativo. Os metais alcalinos devem ser armazenados sob óleo mineral ou atmosfera inerte. A atmosfera inerte utilizada pode ser argônio ou gás nitrogênio, exceto o lítio, que reage com o nitrogênio. O rubídio e o césio devem ser mantidos afastados do ar, mesmo sob o óleo, porque mesmo uma pequena quantidade de ar difundida no óleo pode desencadear a formação do peróxido perigosamente explosivo; pela mesma razão, o potássio não deve ser armazenado em óleo em uma atmosfera contendo oxigênio por mais de 6 meses.
Íons
A química bioinorgânica dos íons de metais alcalinos foi amplamente revisada. Estruturas cristalinas no estado sólido foram determinadas para muitos complexos de íons de metais alcalinos em pequenos peptídeos, constituintes de ácidos nucléicos, carboidratos e complexos de ionóforos.
O lítio ocorre naturalmente apenas em vestígios em sistemas biológicos e não tem função biológica conhecida, mas tem efeitos no corpo quando ingerido. O carbonato de lítio é usado como estabilizador do humor em psiquiatria para tratar o transtorno bipolar (maníaco-depressivo) em doses diárias de cerca de 0,5 a 2 gramas, embora haja efeitos colaterais. A ingestão excessiva de lítio causa sonolência, fala arrastada e vômitos, entre outros sintomas, e envenena o sistema nervoso central, o que é perigoso, pois a dosagem necessária de lítio para tratar o transtorno bipolar é apenas ligeiramente menor do que a dosagem tóxica. A sua bioquímica, a forma como é tratado pelo corpo humano e os estudos com ratos e cabras sugerem que se trata de um oligoelemento essencial, embora a função biológica natural do lítio nos seres humanos ainda não tenha sido identificada.
O sódio e o potássio ocorrem em todos os sistemas biológicos conhecidos, geralmente funcionando como eletrólitos dentro e fora das células. O sódio é um nutriente essencial que regula o volume sanguíneo, a pressão sanguínea, o equilíbrio osmótico e o pH; o requisito fisiológico mínimo de sódio é de 500 miligramas por dia. O cloreto de sódio (também conhecido como sal comum) é a principal fonte de sódio na dieta, sendo usado como tempero e conservante, como em conservas e carne seca; a maior parte vem de alimentos processados. A ingestão dietética de referência para sódio é de 1,5 gramas por dia, mas a maioria das pessoas nos Estados Unidos consome mais de 2,3 gramas por dia, a quantidade mínima que promove a hipertensão; isso, por sua vez, causa 7,6 milhões de mortes prematuras em todo o mundo.
O potássio é o principal cátion (íon positivo) dentro das células animais, enquanto o sódio é o principal cátion fora das células animais. As diferenças de concentração dessas partículas carregadas causam uma diferença de potencial elétrico entre o interior e o exterior das células, conhecido como potencial de membrana. O equilíbrio entre potássio e sódio é mantido por proteínas transportadoras de íons na membrana celular. O potencial da membrana celular criado pelos íons potássio e sódio permite que a célula gere um potencial de ação - um "pico" de descarga elétrica. A capacidade das células de produzir descarga elétrica é crítica para as funções do corpo, como neurotransmissão, contração muscular e função cardíaca. A perturbação deste equilíbrio pode, portanto, ser fatal: por exemplo, a ingestão de grandes quantidades de compostos de potássio pode levar à hipercalemia influenciando fortemente o sistema cardiovascular. Cloreto de potássio é usado nos Estados Unidos para execuções de injeção letal.

Devido aos seus raios atômicos semelhantes, o rubídio e o césio no corpo imitam o potássio e são absorvidos de maneira semelhante. O rubídio não tem função biológica conhecida, mas pode ajudar a estimular o metabolismo e, da mesma forma que o césio, repor o potássio no corpo, causando deficiência de potássio. A substituição parcial é bem possível e não tóxica: uma pessoa de 70 kg contém em média 0,36 g de rubídio, e um aumento desse valor em 50 a 100 vezes não apresentou efeitos negativos nas pessoas testadas. Os ratos podem sobreviver até 50% de substituição de potássio por rubídio. O rubídio (e, em menor grau, o césio) pode funcionar como uma cura temporária para a hipocalemia; enquanto o rubídio pode substituir fisiologicamente adequadamente o potássio em alguns sistemas, o césio nunca é capaz de fazê-lo. Há apenas evidências muito limitadas na forma de sintomas de deficiência de rubídio sendo possivelmente essencial em caprinos; mesmo que isso seja verdade, os vestígios geralmente presentes nos alimentos são mais do que suficientes.
Compostos de césio raramente são encontrados pela maioria das pessoas, mas a maioria dos compostos de césio são levemente tóxicos. Como o rubídio, o césio tende a substituir o potássio no corpo, mas é significativamente maior e, portanto, um substituto mais pobre. O excesso de césio pode levar a hipocalemia, arritmia e parada cardíaca aguda, mas tais quantidades normalmente não seriam encontradas em fontes naturais. Como tal, o césio não é um importante poluente químico ambiental. O valor médio da dose letal (LD50) para cloreto de césio em camundongos é de 2,3 g por quilograma, o que é comparável aos valores LD50 de cloreto de potássio e cloreto de sódio. O cloreto de césio foi promovido como uma terapia alternativa contra o câncer, mas foi associado à morte de mais de 50 pacientes, nos quais foi usado como parte de um tratamento contra o câncer cientificamente não validado.
Radioisótopos de césio requerem cuidados especiais: o manuseio inadequado de fontes de raios gama de césio-137 pode levar à liberação desse radioisótopo e lesões por radiação. Talvez o caso mais conhecido seja o acidente de Goiânia em 1987, no qual um sistema de radioterapia descartado indevidamente de uma clínica abandonada na cidade de Goiânia, Brasil, foi retirado de um ferro-velho e o sal de césio brilhante vendido a curiosos. , compradores sem instrução. Isso levou a quatro mortes e ferimentos graves devido à exposição à radiação. Juntamente com o césio-134, iodo-131 e estrôncio-90, o césio-137 estava entre os isótopos distribuídos pelo desastre de Chernobyl que constituem o maior risco para a saúde. Radioisótopos de frâncio presumivelmente também seriam perigosos devido à sua alta energia de decaimento e meia-vida curta, mas nenhum foi produzido em quantidades grandes o suficiente para representar um risco sério.
Contenido relacionado
Nitrito de amila
Antoine Lavoisier
Allenes