Liga
Uma liga é uma mistura de elementos químicos dos quais pelo menos um é um metal. Ao contrário dos compostos químicos com bases metálicas, uma liga retém todas as propriedades de um metal no material resultante, como condutividade elétrica, ductilidade, opacidade e brilho, mas pode ter propriedades diferentes das dos metais puros, como maior força ou dureza. Em alguns casos, uma liga pode reduzir o custo total do material enquanto preserva propriedades importantes. Em outros casos, a mistura confere propriedades sinérgicas aos elementos metálicos constituintes, como resistência à corrosão ou resistência mecânica.
As ligas são definidas por um caráter de ligação metálica. Os constituintes da liga são geralmente medidos em porcentagem de massa para aplicações práticas e em fração atômica para estudos científicos básicos. As ligas são geralmente classificadas como ligas substitucionais ou intersticiais, dependendo do arranjo atômico que forma a liga. Eles podem ainda ser classificados como homogêneos (consistindo de uma única fase), ou heterogêneos (consistindo de duas ou mais fases) ou intermetálicos. Uma liga pode ser uma solução sólida de elementos metálicos (uma única fase, onde todos os grãos metálicos (cristais) são da mesma composição) ou uma mistura de fases metálicas (duas ou mais soluções, formando uma microestrutura de diferentes cristais dentro do metal)..
Exemplos de ligas incluem ouro vermelho (ouro e cobre), ouro branco (ouro e prata), prata de lei (prata e cobre), aço ou aço silício (ferro com carbono não metálico ou silício, respectivamente), solda, latão, estanho, duralumínio, bronze e amálgamas.
As ligas são usadas em uma ampla variedade de aplicações, desde ligas de aço, usadas em tudo, desde edifícios a automóveis e ferramentas cirúrgicas, a ligas de titânio exóticas usadas na indústria aeroespacial, a ligas de cobre-berílio para ferramentas anti-faíscas.
Características
Uma liga é uma mistura de elementos químicos, que forma uma substância impura (mistura) que retém as características de um metal. Uma liga é diferente de um metal impuro porque, com uma liga, os elementos adicionados são bem controlados para produzir propriedades desejáveis, enquanto metais impuros, como ferro forjado, são menos controlados, mas geralmente são considerados úteis. As ligas são feitas misturando dois ou mais elementos, pelo menos um dos quais é um metal. Isso geralmente é chamado de metal primário ou metal base, e o nome desse metal também pode ser o nome da liga. Os outros constituintes podem ou não ser metais, mas, quando misturados com a base fundida, eles serão solúveis e se dissolverão na mistura. As propriedades mecânicas das ligas geralmente são bem diferentes daquelas de seus constituintes individuais. Um metal normalmente muito macio (maleável), como o alumínio, pode ser alterado ligando-o a outro metal macio, como o cobre. Embora ambos os metais sejam muito macios e dúcteis, a liga de alumínio resultante terá uma resistência muito maior. Adicionar uma pequena quantidade de carbono não metálico ao ferro troca sua grande ductilidade pela maior resistência de uma liga chamada aço. Devido à sua resistência muito alta, mas tenacidade ainda substancial, e sua capacidade de ser muito alterada pelo tratamento térmico, o aço é uma das ligas mais úteis e comuns no uso moderno. Ao adicionar cromo ao aço, sua resistência à corrosão pode ser aumentada, criando aço inoxidável, enquanto a adição de silício alterará suas características elétricas, produzindo aço silício.
Como o óleo e a água, um metal fundido nem sempre pode se misturar com outro elemento. Por exemplo, o ferro puro é quase completamente insolúvel com cobre. Mesmo quando os constituintes são solúveis, cada um geralmente terá um ponto de saturação, além do qual não pode ser adicionado mais constituinte. O ferro, por exemplo, pode conter no máximo 6,67% de carbono. Embora os elementos de uma liga geralmente devam ser solúveis no estado líquido, eles nem sempre podem ser solúveis no estado sólido. Se os metais permanecerem solúveis quando sólidos, a liga forma uma solução sólida, tornando-se uma estrutura homogênea composta por cristais idênticos, chamada de fase. Se, à medida que a mistura esfria, os constituintes se tornam insolúveis, eles podem se separar para formar dois ou mais tipos diferentes de cristais, criando uma microestrutura heterogênea de diferentes fases, algumas com mais de um constituinte do que o outro. No entanto, em outras ligas, os elementos insolúveis podem não se separar até que ocorra a cristalização. Se resfriados muito rapidamente, eles primeiro cristalizam como uma fase homogênea, mas ficam supersaturados com os constituintes secundários. Com o passar do tempo, os átomos dessas ligas supersaturadas podem se separar da rede cristalina, tornando-se mais estáveis e formando uma segunda fase que serve para reforçar os cristais internamente.
Algumas ligas, como o electrum - uma liga de prata e ouro - ocorrem naturalmente. Às vezes, os meteoritos são feitos de ligas naturais de ferro e níquel, mas não são nativos da Terra. Uma das primeiras ligas feitas pelo homem foi o bronze, que é uma mistura dos metais estanho e cobre. O bronze era uma liga extremamente útil para os antigos, porque é muito mais forte e duro do que qualquer um de seus componentes. O aço era outra liga comum. No entanto, nos tempos antigos, ele só poderia ser criado como um subproduto acidental do aquecimento do minério de ferro em incêndios (fundição) durante a fabricação do ferro. Outras ligas antigas incluem estanho, latão e ferro-gusa. Na era moderna, o aço pode ser criado de várias formas. O aço carbono pode ser feito variando apenas o teor de carbono, produzindo ligas macias como o aço macio ou ligas duras como o aço para molas. As ligas de aço podem ser feitas pela adição de outros elementos, como cromo, molibdênio, vanádio ou níquel, resultando em ligas como aço rápido ou aço ferramenta. Pequenas quantidades de manganês geralmente são ligadas à maioria dos aços modernos devido à sua capacidade de remover impurezas indesejadas, como fósforo, enxofre e oxigênio, que podem ter efeitos prejudiciais na liga. No entanto, a maioria das ligas não foi criada até 1900, como várias ligas de alumínio, titânio, níquel e magnésio. Algumas superligas modernas, como incoloy, inconel e hastelloy, podem consistir em vários elementos diferentes.
Uma liga é tecnicamente um metal impuro, mas quando se refere a ligas, o termo impurezas geralmente denota elementos indesejáveis. Tais impurezas são introduzidas dos metais básicos e elementos de liga, mas são removidas durante o processamento. Por exemplo, o enxofre é uma impureza comum no aço. O enxofre combina facilmente com o ferro para formar sulfeto de ferro, que é muito frágil, criando pontos fracos no aço. Lítio, sódio e cálcio são impurezas comuns em ligas de alumínio, que podem ter efeitos adversos na integridade estrutural das peças fundidas. Por outro lado, metais puros que contêm impurezas indesejadas são freqüentemente chamados de "metais impuros" e geralmente não são referidos como ligas. O oxigênio, presente no ar, combina-se facilmente com a maioria dos metais para formar óxidos metálicos; especialmente em temperaturas mais altas encontradas durante a liga. Grande cuidado é tomado durante o processo de liga para remover o excesso de impurezas, usando fundentes, aditivos químicos ou outros métodos de metalurgia extrativa.
Teoria
A liga de um metal é feita combinando-o com um ou mais outros elementos. O processo de liga mais comum e mais antigo é realizado aquecendo o metal base além de seu ponto de fusão e, em seguida, dissolvendo os solutos no líquido fundido, o que pode ser possível mesmo se o ponto de fusão do soluto for muito maior que o da base. Por exemplo, em seu estado líquido, o titânio é um solvente muito forte capaz de dissolver a maioria dos metais e elementos. Além disso, absorve prontamente gases como o oxigênio e queima na presença de nitrogênio. Isso aumenta a chance de contaminação de qualquer superfície de contato e, portanto, deve ser derretido em aquecimento por indução a vácuo e cadinhos de cobre especiais resfriados a água. No entanto, alguns metais e solutos, como ferro e carbono, têm pontos de fusão muito altos e eram impossíveis de serem fundidos pelos povos antigos. Assim, a liga (em particular, a liga intersticial) também pode ser realizada com um ou mais constituintes em estado gasoso, como os encontrados em um alto-forno para fazer ferro-gusa (líquido-gás), nitretação, carbonitretação ou outras formas de endurecimento (sólido-gás), ou o processo de cimentação usado para fazer blister de aço (sólido-gás). Também pode ser feito com um, mais ou todos os constituintes no estado sólido, como encontrado em métodos antigos de soldagem padrão (sólido-sólido), aço de cisalhamento (sólido-sólido) ou produção de aço cadinho (sólido-sólido). líquido), misturando os elementos via difusão em estado sólido.
Ao adicionar outro elemento a um metal, as diferenças no tamanho dos átomos criam tensões internas na rede dos cristais metálicos; tensões que muitas vezes melhoram suas propriedades. Por exemplo, a combinação de carbono com ferro produz aço, que é mais forte que o ferro, seu elemento primário. A condutividade elétrica e térmica das ligas é geralmente menor do que a dos metais puros. As propriedades físicas, como densidade, reatividade, módulo de Young de uma liga podem não diferir muito daquelas de seu elemento base, mas propriedades de engenharia como resistência à tração, ductilidade e resistência ao cisalhamento podem ser substancialmente diferentes daquelas de os materiais constituintes. Às vezes, isso é resultado do tamanho dos átomos na liga, porque os átomos maiores exercem uma força compressiva nos átomos vizinhos e os átomos menores exercem uma força de tração nos vizinhos, ajudando a liga a resistir à deformação. Às vezes, as ligas podem exibir diferenças marcantes no comportamento, mesmo quando pequenas quantidades de um elemento estão presentes. Por exemplo, as impurezas em ligas ferromagnéticas semicondutoras levam a propriedades diferentes, conforme previsto pela primeira vez por White, Hogan, Suhl, Tian Abrie e Nakamura.
Ao contrário dos metais puros, a maioria das ligas não tem um único ponto de fusão, mas uma faixa de fusão durante a qual o material é uma mistura de fases sólidas e líquidas (uma lama). A temperatura na qual a fusão começa é chamada de solidus, e a temperatura quando a fusão está completa é chamada de liquidus. Para muitas ligas existe uma proporção de liga particular (em alguns casos mais de uma), chamada de mistura eutética ou composição peritética, que dá à liga um ponto de fusão único e baixo, e nenhuma transição líquido/sólido lama.
Tratamento térmico

Elementos de liga são adicionados a um metal base, para induzir dureza, tenacidade, ductilidade ou outras propriedades desejadas. A maioria dos metais e ligas pode ser encruada criando defeitos em sua estrutura cristalina. Esses defeitos são criados durante a deformação plástica por martelamento, dobra, extrusão, etc., e são permanentes, a menos que o metal seja recristalizado. Caso contrário, algumas ligas também podem ter suas propriedades alteradas pelo tratamento térmico. Quase todos os metais podem ser amolecidos por recozimento, que recristaliza a liga e repara os defeitos, mas poucos podem ser endurecidos por aquecimento e resfriamento controlados. Muitas ligas de alumínio, cobre, magnésio, titânio e níquel podem ser reforçadas até certo ponto por algum método de tratamento térmico, mas poucas respondem a isso no mesmo grau que o aço.
O ferro do metal base da liga ferro-carbono conhecido como aço, sofre uma alteração no arranjo (alotropia) dos átomos de sua matriz cristalina a uma determinada temperatura (geralmente entre 1.500 °F (820 °C) e 1.600 °C °F (870 °C), dependendo do teor de carbono). Isso permite que os átomos de carbono menores entrem nos interstícios do cristal de ferro. Quando essa difusão acontece, diz-se que os átomos de carbono estão em solução no ferro, formando uma fase cristalina única, homogênea e particular chamada austenita. Se o aço for resfriado lentamente, o carbono pode se difundir para fora do ferro e gradualmente voltará ao seu alótropo de baixa temperatura. Durante o resfriamento lento, os átomos de carbono não serão mais tão solúveis com o ferro e serão forçados a precipitar da solução, nucleando em uma forma mais concentrada de carboneto de ferro (Fe3C) no espaços entre os cristais de ferro puro. O aço torna-se então heterogêneo, pois é formado por duas fases, a fase ferro-carbono chamada de cementita (ou carboneto), e a ferrita de ferro puro. Esse tratamento térmico produz um aço bastante macio. Se o aço for resfriado rapidamente, no entanto, os átomos de carbono não terão tempo de se difundir e precipitar como carboneto, mas ficarão presos dentro dos cristais de ferro. Quando resfriado rapidamente, ocorre uma transformação sem difusão (martensita), na qual os átomos de carbono ficam presos na solução. Isso faz com que os cristais de ferro se deformem à medida que a estrutura do cristal tenta mudar para seu estado de baixa temperatura, deixando esses cristais muito duros, mas muito menos dúcteis (mais quebradiços).
Embora a alta resistência do aço resulte quando a difusão e a precipitação são evitadas (formando martensita), a maioria das ligas tratáveis termicamente são ligas de endurecimento por precipitação, que dependem da difusão de elementos de liga para atingir sua resistência. Quando aquecidas para formar uma solução e depois resfriadas rapidamente, essas ligas tornam-se muito mais macias do que o normal, durante a transformação sem difusão, mas endurecem à medida que envelhecem. Os solutos nessas ligas irão precipitar com o tempo, formando fases intermetálicas, que são difíceis de distinguir do metal base. Ao contrário do aço, em que a solução sólida se separa em diferentes fases cristalinas (carboneto e ferrita), as ligas endurecidas por precipitação formam diferentes fases dentro do mesmo cristal. Essas ligas intermetálicas parecem homogêneas na estrutura cristalina, mas tendem a se comportar de maneira heterogênea, tornando-se duras e um tanto quebradiças.
Em 1906, as ligas de endurecimento por precipitação foram descobertas por Alfred Wilm. As ligas de endurecimento por precipitação, como certas ligas de alumínio, titânio e cobre, são ligas tratáveis termicamente que amolecem quando resfriadas (resfriadas rapidamente) e depois endurecem com o tempo. Wilm estava procurando uma maneira de endurecer ligas de alumínio para uso em cartuchos de metralhadoras. Sabendo que as ligas de alumínio-cobre eram tratáveis termicamente até certo ponto, Wilm tentou resfriar uma liga ternária de alumínio, cobre e a adição de magnésio, mas inicialmente ficou desapontado com os resultados. No entanto, quando Wilm a testou novamente no dia seguinte, ele descobriu que a liga aumentava em dureza quando deixada para envelhecer em temperatura ambiente e superava em muito suas expectativas. Embora uma explicação para o fenômeno não tenha sido fornecida até 1919, o duralumínio foi um dos primeiros "endurecimento por idade" ligas usadas, tornando-se o principal material de construção para os primeiros zepelins, e logo foi seguido por muitos outros. Como geralmente exibem uma combinação de alta resistência e baixo peso, essas ligas tornaram-se amplamente utilizadas em muitas formas de indústria, incluindo a construção de aeronaves modernas.
Mecanismos
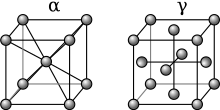
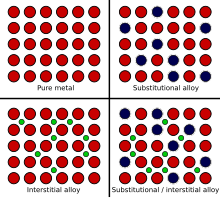
Quando um metal fundido é misturado com outra substância, existem dois mecanismos que podem causar a formação de uma liga, chamados de troca de átomos e o mecanismo intersticial. O tamanho relativo de cada elemento na mistura desempenha um papel primordial na determinação de qual mecanismo ocorrerá. Quando os átomos são relativamente semelhantes em tamanho, geralmente acontece o método de troca de átomos, onde alguns dos átomos que compõem os cristais metálicos são substituídos por átomos do outro constituinte. Isso é chamado de liga de substituição. Exemplos de ligas substitutivas incluem bronze e latão, nos quais alguns dos átomos de cobre são substituídos por átomos de estanho ou zinco, respectivamente.
No caso do mecanismo intersticial, um átomo é geralmente muito menor que o outro e não pode substituir com sucesso o outro tipo de átomo nos cristais do metal base. Em vez disso, os átomos menores ficam presos nos locais intersticiais entre os átomos da matriz cristalina. Isso é chamado de liga intersticial. O aço é um exemplo de liga intersticial, porque os átomos de carbono muito pequenos se encaixam nos interstícios da matriz de ferro.
O aço inoxidável é um exemplo de combinação de ligas intersticiais e substitucionais, porque os átomos de carbono se encaixam nos interstícios, mas alguns dos átomos de ferro são substituídos por átomos de níquel e cromo.
História e exemplos
Ferro meteórico
O uso de ligas por humanos começou com o uso de ferro meteórico, uma liga natural de níquel e ferro. É o principal constituinte dos meteoritos de ferro. Como não foram usados processos metalúrgicos para separar o ferro do níquel, a liga foi usada como estava. O ferro meteórico pode ser forjado a partir de um calor vermelho para fazer objetos como ferramentas, armas e pregos. Em muitas culturas, foi moldado por martelo frio em facas e pontas de flecha. Eles eram frequentemente usados como bigornas. O ferro meteórico era muito raro e valioso, e difícil para os povos antigos trabalharem.
Bronze e latão
O ferro é geralmente encontrado como minério de ferro na Terra, exceto por um depósito de ferro nativo na Groenlândia, que foi usado pelos Inuit. Cobre nativo, no entanto, foi encontrado em todo o mundo, juntamente com prata, ouro e platina, que também foram usados para fazer ferramentas, joias e outros objetos desde os tempos neolíticos. O cobre era o mais duro desses metais e o mais amplamente distribuído. Tornou-se um dos metais mais importantes para os antigos. Cerca de 10.000 anos atrás, nas terras altas da Anatólia (Turquia), os humanos aprenderam a fundir metais como cobre e estanho a partir do minério. Por volta de 2500 aC, as pessoas começaram a ligar os dois metais para formar o bronze, que era muito mais duro do que seus ingredientes. O estanho era raro, no entanto, sendo encontrado principalmente na Grã-Bretanha. No Oriente Médio, as pessoas começaram a ligar o cobre com o zinco para formar o latão. As civilizações antigas levaram em consideração a mistura e as diversas propriedades que ela produzia, como dureza, tenacidade e ponto de fusão, sob diversas condições de temperatura e encruamento, desenvolvendo grande parte das informações contidas nos modernos diagramas de fases das ligas. Por exemplo, pontas de flechas da dinastia chinesa Qin (cerca de 200 aC) eram frequentemente construídas com uma cabeça de bronze duro, mas uma espiga de bronze mais macia, combinando as ligas para evitar o embotamento e a quebra durante o uso.
Amálgamas
O mercúrio foi fundido a partir do cinábrio por milhares de anos. O mercúrio dissolve muitos metais, como ouro, prata e estanho, para formar amálgamas (uma liga em pasta mole ou forma líquida à temperatura ambiente). Os amálgamas são usados desde 200 aC na China para dourar objetos como armaduras e espelhos com metais preciosos. Os antigos romanos costumavam usar amálgamas de estanho e mercúrio para dourar suas armaduras. O amálgama era aplicado como uma pasta e depois aquecido até que o mercúrio vaporizasse, deixando para trás o ouro, a prata ou o estanho. O mercúrio era frequentemente usado na mineração, para extrair metais preciosos como ouro e prata de seus minérios.
Metais preciosos
Muitas civilizações antigas ligavam metais para fins puramente estéticos. No antigo Egito e em Micenas, o ouro era frequentemente misturado com cobre para produzir ouro vermelho, ou ferro para produzir um ouro bordô brilhante. O ouro era freqüentemente encontrado misturado com prata ou outros metais para produzir vários tipos de ouro colorido. Esses metais também foram usados para fortalecer uns aos outros, para fins mais práticos. O cobre era frequentemente adicionado à prata para fazer prata de lei, aumentando sua força para uso em pratos, talheres e outros itens práticos. Muitas vezes, os metais preciosos eram misturados com substâncias menos valiosas como forma de enganar os compradores. Por volta de 250 aC, Arquimedes foi contratado pelo rei de Siracusa para encontrar uma maneira de verificar a pureza do ouro em uma coroa, levando ao famoso grito de "Eureka!" após a descoberta de Arquimedes' princípio.
Estanho
O termo estanho abrange uma variedade de ligas que consistem principalmente de estanho. Como metal puro, o estanho é macio demais para ser usado na maioria dos propósitos práticos. No entanto, durante a Idade do Bronze, o estanho era um metal raro em muitas partes da Europa e do Mediterrâneo, por isso era frequentemente mais valorizado do que o ouro. Para fazer joias, talheres ou outros objetos de estanho, os trabalhadores geralmente o misturavam com outros metais para aumentar a resistência e a dureza. Esses metais eram tipicamente chumbo, antimônio, bismuto ou cobre. Às vezes, esses solutos eram adicionados individualmente em quantidades variadas ou combinados, formando uma grande variedade de objetos, desde itens práticos, como pratos, instrumentos cirúrgicos, castiçais ou funis, até itens decorativos, como brincos e grampos de cabelo.
Os primeiros exemplos de estanho vêm do antigo Egito, por volta de 1450 aC. O uso de estanho foi generalizado em toda a Europa, da França à Noruega e Grã-Bretanha (onde a maior parte do estanho antigo foi extraído) para o Oriente Próximo. A liga também foi usada na China e no Extremo Oriente, chegando ao Japão por volta de 800 dC, onde foi usada para fazer objetos como vasos cerimoniais, latas de chá ou cálices usados em santuários xintoístas.
Ferro

A primeira fundição conhecida de ferro começou na Anatólia, por volta de 1800 AC. Chamado de processo bloomery, produzia ferro forjado muito macio, mas dúctil. Por volta de 800 aC, a tecnologia de fabricação de ferro se espalhou para a Europa, chegando ao Japão por volta de 700 dC. O ferro-gusa, uma liga de ferro e carbono muito dura, mas frágil, era produzido na China já em 1200 aC, mas não chegou à Europa até a Idade Média. O ferro gusa tem um ponto de fusão mais baixo que o ferro e foi usado para fazer ferro fundido. No entanto, esses metais encontraram pouco uso prático até a introdução do aço cadinho por volta de 300 aC. Esses aços eram de baixa qualidade, e a introdução da soldagem padrão, por volta do século I dC, procurou equilibrar as propriedades extremas das ligas, laminando-as, para criar um metal mais resistente. Por volta de 700 dC, os japoneses começaram a dobrar aço e ferro fundido em camadas alternadas para aumentar a resistência de suas espadas, usando fundentes de argila para remover escória e impurezas. Este método de forjar espadas japonês produziu uma das mais puras ligas de aço do mundo antigo.
Embora o uso do ferro tenha começado a se espalhar por volta de 1200 aC, principalmente por causa das interrupções nas rotas comerciais de estanho, o metal era muito mais macio que o bronze. No entanto, quantidades muito pequenas de aço (uma liga de ferro e cerca de 1% de carbono) sempre foram um subproduto do processo de bloomery. A capacidade de modificar a dureza do aço por tratamento térmico era conhecida desde 1100 aC, e o material raro era valorizado para a fabricação de ferramentas e armas. Como os antigos não conseguiam produzir temperaturas altas o suficiente para derreter totalmente o ferro, a produção de aço em quantidades decentes não ocorreu até a introdução do aço blister durante a Idade Média. Este método introduziu carbono aquecendo ferro forjado em carvão por longos períodos de tempo, mas a absorção de carbono dessa maneira é extremamente lenta, portanto a penetração não foi muito profunda, portanto a liga não era homogênea. Em 1740, Benjamin Huntsman começou a derreter o aço blister em um cadinho para nivelar o teor de carbono, criando o primeiro processo para a produção em massa de aço para ferramentas. O processo da Huntsman foi usado para fabricar aço para ferramentas até o início do século XX.
A introdução do alto-forno na Europa na Idade Média permitiu que as pessoas produzissem ferro-gusa em volumes muito maiores do que o ferro forjado. Como o ferro-gusa podia ser derretido, as pessoas começaram a desenvolver processos para reduzir o carbono no ferro-gusa líquido para criar aço. A poça era usada na China desde o primeiro século e foi introduzida na Europa durante os anos 1700, onde o ferro-gusa fundido era agitado enquanto exposto ao ar, para remover o carbono por oxidação. Em 1858, Henry Bessemer desenvolveu um processo de fabricação de aço soprando ar quente através de ferro-gusa líquido para reduzir o teor de carbono. O processo Bessemer levou à primeira fabricação de aço em larga escala.
Aço é uma liga de ferro e carbono, mas o termo liga de aço geralmente se refere apenas a aços que contêm outros elementos - como vanádio, molibdênio ou cobalto - em quantidades suficientes para alterar as propriedades de o aço básico. Desde os tempos antigos, quando o aço era usado principalmente para ferramentas e armas, os métodos de produção e trabalho do metal eram frequentemente segredos bem guardados. Mesmo muito depois da Era da Razão, a indústria siderúrgica era muito competitiva e os fabricantes faziam grandes esforços para manter seus processos confidenciais, resistindo a qualquer tentativa de analisar cientificamente o material por medo de revelar seus métodos. Por exemplo, o povo de Sheffield, um centro de produção de aço na Inglaterra, era conhecido por proibir rotineiramente visitantes e turistas de entrar na cidade para impedir a espionagem industrial. Assim, quase nenhuma informação metalúrgica existia sobre o aço até 1860. Devido a essa falta de compreensão, o aço não era geralmente considerado uma liga até as décadas entre 1930 e 1970 (principalmente devido ao trabalho de cientistas como William Chandler Roberts-Austen, Adolf Martens, e Edgar Bain), então "liga de aço" tornou-se o termo popular para ligas de aço ternárias e quaternárias.
Depois que Benjamin Huntsman desenvolveu seu cadinho de aço em 1740, ele começou a fazer experiências com a adição de elementos como manganês (na forma de um ferro-gusa com alto teor de manganês chamado spiegeleisen), que ajudava a remover as impurezas como fósforo e oxigênio; um processo adotado por Bessemer e ainda usado em aços modernos (embora em concentrações baixas o suficiente para ainda ser considerado aço carbono). Posteriormente, muitas pessoas começaram a experimentar várias ligas de aço sem muito sucesso. Porém, em 1882, Robert Hadfield, sendo um pioneiro na metalurgia do aço, interessou-se e produziu uma liga de aço contendo cerca de 12% de manganês. Chamado mangaliga, exibiu extrema dureza e tenacidade, tornando-se o primeiro aço-liga comercialmente viável. Depois, criou o aço silício, iniciando a busca por outras possíveis ligas de aço.
Robert Forester Mushet descobriu que, ao adicionar tungstênio ao aço, ele poderia produzir uma borda muito dura que resistiria à perda de dureza em altas temperaturas. "R. Aço especial Mushet's' (RMS) tornou-se o primeiro aço rápido. O aço de Mushet foi rapidamente substituído pelo aço de carboneto de tungstênio, desenvolvido por Taylor e White em 1900, no qual dobraram o teor de tungstênio e adicionaram pequenas quantidades de cromo e vanádio, produzindo um aço superior para uso em tornos e ferramentas de usinagem. Em 1903, os irmãos Wright usaram um aço cromo-níquel para fazer o virabrequim do motor de seu avião, enquanto em 1908 Henry Ford começou a usar aços vanádio para peças como virabrequins e válvulas em seu Modelo T Ford, devido à sua maior força e resistência a temperaturas altas. Em 1912, a Krupp Ironworks na Alemanha desenvolveu um aço resistente à ferrugem adicionando 21% de cromo e 7% de níquel, produzindo o primeiro aço inoxidável.
Outros
Devido à sua alta reatividade, a maioria dos metais não foi descoberta até o século XIX. Um método para extrair alumínio da bauxita foi proposto por Humphry Davy em 1807, usando um arco elétrico. Embora suas tentativas não tivessem sucesso, em 1855 as primeiras vendas de alumínio puro chegaram ao mercado. No entanto, como a metalurgia extrativa ainda estava em sua infância, a maioria dos processos de extração de alumínio produzia ligas não intencionais contaminadas com outros elementos encontrados no minério; o mais abundante deles era o cobre. Essas ligas de alumínio-cobre (na época denominadas "bronze de alumínio") precediam o alumínio puro, oferecendo maior resistência e dureza em relação ao metal puro e macio e, até certo ponto, eram tratáveis termicamente. No entanto, devido à sua maciez e endurecimento limitado, essas ligas tiveram pouco uso prático e eram mais uma novidade, até que os irmãos Wright usaram uma liga de alumínio para construir o primeiro motor de avião em 1903. Durante o período entre 1865 e 1910, os processos para extraindo muitos outros metais foram descobertos, como cromo, vanádio, tungstênio, irídio, cobalto e molibdênio, e várias ligas foram desenvolvidas.
Antes de 1910, a pesquisa consistia principalmente em indivíduos particulares trabalhando em seus próprios laboratórios. No entanto, à medida que as indústrias aeronáutica e automotiva começaram a crescer, a pesquisa de ligas tornou-se um esforço industrial nos anos seguintes a 1910, quando novas ligas de magnésio foram desenvolvidas para pistões e rodas de carros, e potes de metal para alavancas e maçanetas, e ligas de alumínio desenvolvidas para fuselagens e revestimentos de aeronaves foram colocados em uso.
Contenido relacionado
Biotecnologia
Dava Sobel
Dissolver