Lactase
Lactase é uma enzima produzida por muitos organismos. Está localizado na borda em escova do intestino delgado de humanos e outros mamíferos. A lactase é essencial para a digestão completa do leite integral; decompõe a lactose, um açúcar que confere doçura ao leite. As pessoas que têm deficiência de lactase e consomem laticínios podem apresentar sintomas de intolerância à lactose. A lactase pode ser comprada como suplemento alimentar e adicionada ao leite para produzir leite "sem lactose" derivados do leite.
Lactase (também conhecida como lactase-florizina hidrolase, ou LPH), uma parte da família de enzimas β-galactosidase, é uma glicosídeo hidrolase envolvida na hidrólise do dissacarídeo lactose em monômeros constituintes de galactose e glicose. A lactase está presente predominantemente ao longo da membrana da borda em escova dos enterócitos diferenciados que revestem as vilosidades do intestino delgado. Em humanos, a lactase é codificada pelo gene LCT no cromossomo 2.
Usos
Uso alimentar
A lactase é uma enzima que algumas pessoas não conseguem produzir no intestino delgado. A tecnologia para produzir leite, sorvete e iogurte sem lactose foi desenvolvida pelo USDA Agricultural Research Service em 1985. Essa tecnologia é usada para adicionar lactase ao leite, hidrolisando a lactose naturalmente encontrada no leite, deixando-o levemente doce, mas digerível por todos. Sem lactase, as pessoas intolerantes à lactose passam a lactose não digerida para o cólon, onde as bactérias a decompõem, criando dióxido de carbono e isso leva a inchaço e flatulência.
Uso medicinal
Os suplementos de lactase às vezes são usados para tratar a intolerância à lactose.
Uso industrial
A lactase produzida comercialmente pode ser extraída tanto de leveduras como Kluyveromyces fragilis e Kluyveromyces lactis quanto de bolores, como Aspergillus niger e Aspergillus oryzae. Seu principal uso comercial, em suplementos e produtos como os de Lacteeze e Lactaid, é quebrar a lactose no leite para torná-lo adequado para pessoas com intolerância à lactose. A Food and Drug Administration dos EUA não avaliou independentemente esses produtos.
A lactase (ou uma forma semelhante de beta-galactosidase) também é usada para rastrear colônias brancas azuis nos vários locais de clonagem de vários vetores plasmídeos em Escherichia coli ou outras bactérias.
Mecanismo
A temperatura ideal para a lactase humana é de cerca de 37°C e o pH ideal é 6.
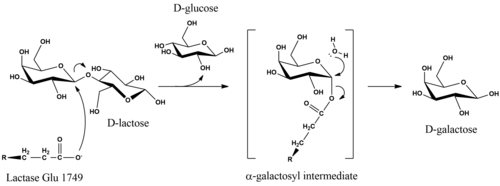
No metabolismo, a ligação β-glicosídica na D-lactose é hidrolisada para formar D-galactose e D-glicose, que podem ser absorvido através das paredes intestinais e na corrente sanguínea. A reação global que a lactase catalisa é C12H22O11 + H2O → C 6H12O6 + C6H12O6 + calor.
O mecanismo catalítico da hidrólise da D-lactose retém a configuração anomérica do substrato nos produtos. Embora os detalhes do mecanismo sejam incertos, a retenção estereoquímica é obtida por meio de uma reação de duplo deslocamento. Estudos de E. coli lactase propuseram que a hidrólise é iniciada quando um glutamato nucleófilo na enzima ataca do lado axial do carbono galactosil na ligação β-glicosídica. A remoção do grupo de saída D-glicose pode ser facilitada pela catálise ácida dependente de Mg. A enzima é liberada da porção α-galactosil após o ataque nucleofílico equatorial pela água, que produz D-galactose.
Estudos de modificação de substrato demonstraram que as porções 3'-OH e 2'-OH no anel de galactopiranose são essenciais para o reconhecimento enzimático e a hidrólise. O grupo 3'-hidroxi está envolvido na ligação inicial ao substrato, enquanto o grupo 2'- não é necessário para o reconhecimento, mas necessário nas etapas subsequentes. Isso é demonstrado pelo fato de que um análogo 2-desoxi é um inibidor competitivo eficaz (Ki = 10mM). A eliminação de grupos hidroxila específicos na porção glucopiranose não elimina a catálise.
A lactase também catalisa a conversão de florizina em floretina e glicose.
Estrutura e biossíntese
A pré-prolactase, o produto primário da tradução, tem uma única estrutura primária polipeptídica que consiste em 1927 aminoácidos. Ele pode ser dividido em cinco domínios: (i) uma sequência de sinal clivada de 19 aminoácidos; (ii) um grande domínio de prosequência que não está presente na lactase madura; (iii) o segmento da lactase madura; (iv) uma âncora hidrofóbica que atravessa a membrana; e (v) um terminal carboxílico hidrofílico curto. A sequência sinal é clivada no retículo endoplasmático e o pró-LPH de 215 kDa resultante é enviado para o aparelho de Golgi, onde é fortemente glicosilado e processado proteoliticamente até sua forma madura. Foi demonstrado que o pró-domínio atua como uma chaperona intramolecular no RE, impedindo a clivagem da tripsina e permitindo que o LPH adote a estrutura 3-D necessária para ser transportado para o aparelho de Golgi.
A lactase humana madura consiste em uma única cadeia polipeptídica de 160 kDa que se localiza na membrana da borda em escova das células epiteliais intestinais. É orientado com o N-terminal fora da célula e o C-terminal no citosol. O LPH contém dois sítios catalíticos de ácido glutâmico. Na enzima humana, a atividade da lactase foi ligada ao Glu-1749, enquanto o Glu-1273 é o local da função da florizina hidrolase.
Expressão e regulação genética
A lactase é codificada por um único locus genético no cromossomo 2. É expressa exclusivamente por enterócitos do intestino delgado de mamíferos e em níveis muito baixos no cólon durante o desenvolvimento fetal. Os seres humanos nascem com altos níveis de expressão de lactase. Na maior parte da população mundial, a transcrição da lactase é diminuída após o desmame, resultando em diminuição da expressão da lactase no intestino delgado, o que causa os sintomas comuns de hipolactasia do tipo adulto ou intolerância à lactose.
Alguns segmentos populacionais exibem persistência de lactase resultante de uma mutação que se postula ter ocorrido há 5.000 a 10.000 anos, coincidindo com o surgimento da domesticação do gado. Essa mutação permitiu que quase metade da população mundial metabolizasse a lactose sem sintomas. Estudos associaram a ocorrência de persistência da lactase a dois diferentes polimorfismos de nucleotídeo único cerca de 14 e 22 quilobases a montante da extremidade 5' do gene LPH. Ambas as mutações, C→T na posição -13910 e G→A na posição -22018, foram ligadas independentemente à persistência da lactase.
O promotor da lactase tem 150 pares de bases de comprimento e está localizado a montante do local de iniciação da transcrição. A sequência é altamente conservada em mamíferos, sugerindo que reguladores cis-transcricionais críticos estão localizados nas proximidades. Cdx-2, HNF-1α e GATA foram identificados como fatores de transcrição. Estudos do início da hipolactasia demonstraram que, apesar dos polimorfismos, existe pouca diferença na expressão da lactase em lactentes, mostrando que as mutações tornam-se cada vez mais relevantes durante o desenvolvimento. As proteínas de ligação ao DNA reguladas pelo desenvolvimento podem diminuir a transcrição ou desestabilizar os transcritos do mRNA, causando diminuição da expressão de LPH após o desmame.
Contenido relacionado
Felidae
Índice de massa corporal
Método do muco cervical