Hexano
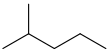
hexano () ou n -hexano é um composto orgânico, um alcano de cadeia reta com seis átomos de carbono e a fórmula molecular C C C. 6 H 14 .
hexano é um líquido incolor, inodoro quando puro e com um ponto de ebulição de aproximadamente 69 ° C (156 ° F). É amplamente utilizado como um solvente não polar, relativamente seguro, amplamente não reativo e evaporado, e as misturas de gasolina modernas contêm cerca de 3% de hexano.
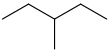
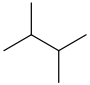
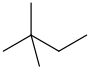
O termo hexanos refere-se a uma mistura, composta em grande parte (& gt; 60%) de n -hexano, com quantidades variadas dos compostos isoméricos 2-metilpentano e 3 -metilpentano e, possivelmente, quantidades menores de C
Isombrosos
Usos
Na indústria, os hexanos são usados na formulação de colas para sapatos, produtos de couro e coberturas. Eles também são usados para extrair óleos de cozinha (como óleo de canola ou óleo de soja) a partir de sementes, para limpeza e degradação de uma variedade de itens e na fabricação têxtil.
Um uso laboratorial típico de hexanos é extrair petróleo e graxa contaminantes da água e do solo para análise. Como o hexano não pode ser facilmente desprotonado, ele é usado em laboratório para reações que envolvem bases muito fortes, como a preparação de organolitios. Por exemplo, os butilithiums geralmente são fornecidos como uma solução hexana.
hexanos são comumente usados na cromatografia como solvente não polar. Alcanes mais altos presentes como impurezas nos hexanos têm tempos de retenção semelhantes ao solvente, o que significa que as frações que contêm hexano também conterão essas impurezas. Na cromatografia preparativa, a concentração de um grande volume de hexanos pode resultar em uma amostra que é consideravelmente contaminada por alcanos. Isso pode resultar em um composto sólido sendo obtido como um petróleo e os alcanos podem interferir na análise.
Produção
O hexano é obtido principalmente refinando o petróleo bruto. A composição exata da fração depende em grande parte da fonte do petróleo (petróleo ou reformado) e das restrições do refino. O produto industrial (geralmente cerca de 50% em peso do isômero de cadeia reta) é a fração que ferve a 65 a 70 ° C (149-158 ° F).
Propriedades físicas
Todos os alcaneos são incolores. Os pontos de ebulição dos vários hexanos são um pouco semelhantes e, como para outros alcanes, geralmente são mais baixos para as formas mais ramificadas. Os pontos de fusão são bem diferentes e a tendência não é aparente.
| Isomer | M.P. (°C) | M.P. (°F) | B.P. (°C) | B.P. (°F) |
|---|---|---|---|---|
| n- Hexane. | -95.3 | -139.5 | 68.7 | 155.7 |
| 3-metilpentane | -118.0 | -180.4 | 63.3 | 145.9 |
| 2-metilpentano (isohexano) | -153.7 | -244.7 | 60.3 | 14,5 |
| 2,3-dimetilbutano | -128.6 | -199.5 | 58.0 | 136.4 |
| 2,2-dimetilbutano (neoexano) | -99.8 | -147.6 | 49.7 | 121.5 |
Hexane tem pressão de vapor considerável à temperatura ambiente:
| Temperatura (°C) | Temperatura (°F) | Pressão de vapor (mmHg) | Pressão de vapor (kPa) |
|---|---|---|---|
| - 40. | - 40. | 3.36 | 0,48 |
| - Não. | - 22. | 7.12 | 0,949 |
| -20. | -4 | 14.01 | 1,681 |
| - Sim. | 14 | 25.91 | 3.454 |
| 0 | 32 | 45.37 | 6.049 |
| 10. | 50 | 75.74 | 10.098 |
| 20. | 68 | 121.2. | 16.167 |
| 25 | 77 | 151.28 | 20.169 |
| 30 | 86 | 187.11 | 24.946 |
| 40 | 104 | 279.42 | 37.253 |
| 50 | 122 | 405.31 | 54.037 |
| 60. | 140 | 572.76 | 76.362 |
Reatividade
Como a maioria dos alcanes, os hexanos exibem baixa reatividade e são solventes adequados para compostos reativos. Amostras comerciais de n-hexano, no entanto, geralmente contêm metilciclopentano, que apresenta ligações C-H terciárias, que são incompatíveis com algumas reações radicais.
Segurança
A inalação de n-hexano a 5000 ppm por 10 minutos produz vertigem marcada; 2500-1000 ppm por 12 horas produz sonolência, fadiga, perda de apetite e parestesia nas extremidades distais; 2500–5000 ppm produz fraqueza muscular, pulsação fria nas extremidades, visão borrada, dor de cabeça e anorexia. Demonstrou-se que a exposição ocupacional crônica a níveis elevados de n -Hexano está associada à neuropatia periférica na mecânica de automóveis nos EUA e na neurotoxicidade em trabalhadores em prensas, e calçados e móveis fábricas na Ásia, Europa e América do Norte.
O Instituto Nacional de Segurança e Saúde Ocupacional dos EUA (NIOSH) estabeleceu um limite recomendado de exposição (REL) para isômeros de hexano (não n -hexano) de 100 ppm (350 mg/m
hexano e outros hidrocarbonetos voláteis (éter de petróleo) apresentam um risco de aspiração. O hexano n às vezes é usado como desnaturante para o álcool e como um agente de limpeza nas indústrias de têxteis, móveis e couro. Está sendo substituído lentamente por outros solventes.
Como a gasolina, o hexano é altamente volátil e é um risco de explosão. As explosões de esgoto de Louisville de 1981, que destruíram mais de 13 km (21 km) de linhas de esgoto e ruas em Kentucky, foram causadas pela ignição de vapores hexanos que foram dispensados ilegalmente de uma planta de processamento de soja pertencente à Ralston-Purina. O hexano foi atribuído como a causa de uma explosão que ocorreu na Universidade Nacional de Rio Cuarto, Argentina, em 5 de dezembro de 2007, devido a um derramamento de hexano perto de uma máquina de produzir calor que explodiu, produzindo um incêndio que matou um aluno e ferido mais 24 .
Incidentes
O envenenamento por hexano ocupacional ocorreu com trabalhadores de sandálias japoneses, trabalhadores italianos de calçados, trabalhadores à prova de imprensa de Taiwan e outros. A análise dos trabalhadores de Taiwan mostrou exposição ocupacional a substâncias, incluindo o hexano n . Em 2010-2011, os trabalhadores chineses que fabricam iPhones foram relatados como sofrendo envenenamento por hexano.
Biotransformação
n -Hexano é biotransformado em 2-hexanol e ainda mais para 2,5-hexanodiol no corpo. A conversão é catalisada pelo citocromo p450 da enzima, utilizando oxigênio do ar. O 2,5-hexanodiol pode ser oxidado ainda em 2,5-hexanediona, que é neurotóxico e produz uma polineuropatia. Em vista desse comportamento, a substituição do n -Hexano como solvente foi discutida. O n-heptano é uma alternativa possível.
Ver também
- Ciclo-exano
- Perfluorohexano
Referências
- ^ Hofmann, August Wilhelm Von (1 de janeiro de 1867). «I. On the action of trichloride of phosphorus on the salts of the aromatic monamines» (em inglês). Proceedings of the Royal Society of London. 15.: 54–62. doi:10.1098/rspl.1866.0018. S2CID 98496840.
- ^ «n-hexane – Compound Summary» (em inglês). Composto por PubChem. EUA: Centro Nacional de Informação em Biotecnologia. 16 de Setembro de 2004. Identificação e Registros Relacionados. Arquivado do original em 8 de março de 2012. Retrieved 31 de Dezembro 2011.
- ^ William M. Haynes (2016). Manual de Química e Física CRC (97a ed.). Boca Raton: CRC Press. pp. 3-298. ISBN 978-1-4987-5429-3.
- ^ Classificação GHS em [PubChem]
- ↑ a b c NIOSH Pocket Guide to Chemical Hazards (em inglês). «#0322». Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ↑ a b "n-Hexane". Imediatamente Perigoso para Concentrações de Vida ou Saúde (IDLH). Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ "N-HEXANE". O que é isso?. Retrieved 3 de Novembro 2023.
- ^ «n-Hexane - Hazardous Agents» (em inglês). Mapa de perigo. Retrieved 7 de Julho 2022.
- ^ Uso de substâncias de descarte de ozônio em laboratórios. ISBN 92-893-0884-2. OCLC 474188215. Arquivado do original em 16 de julho de 2012.
- ^ Schwindeman, James A.; Woltermann, Chris J.; Letchford, Robert J. (1 de maio de 2002). «Safe handling of organolithium compostos in the Laboratory» (em inglês). Saúde Química e Segurança. 9 (3): 6–11. doi:10.1016/s1074-9098(02)00295-2. ISSN 1074-9098.
- ^ Le Van Mao, R.; Melancon, S.; Gauthier-Campbell, C.; Kletnieks, P. (1 de maio de 2001). "Processo de cracking catalítico profundo seletivo (SDCC) de matérias-primas de petróleo para a produção de olefins leves. I. O efeito Catlever obtido com um sistema de duas zonas de reação sobre a conversão de n-hexane". Cartas de catálise. 73 (2): 181–186. doi:10.1023/A:1016685523095. ISSN 1572-879X. S2CID 98167823.
- ^ "Química orgânica-I" (PDF). Nsdl.niscair.res.in. Arquivado do original (PDF) em 29 de outubro de 2013. Retrieved 17 de Fevereiro 2014.
- ^ «13. Hydrocarbons | Textbooks» (em inglês). Textbook.s-anand.net. Arquivado do original em 6 de outubro de 2014. Retrieved 17 de Fevereiro 2014.
- ^ William D. McCain (1990). As propriedades dos fluidos de petróleo. PennWell. ISBN 978-0-87814-335-1.
- ^ Koch, H.; Haaf, W. (1973). «1-Adamantanecarboxylic Acid» (em inglês). Sínteses orgânicas; Volumes recolhidosvol. 5, p. 20.
- ^ "N-HEXANE". Toxicologia rede de dados Substâncias perigosas Banco de dados. Biblioteca Nacional de Medicina. Arquivado do original em 4 de setembro de 2015.
- ^ Centro de Controle e Prevenção de Doenças (CDC) (16 de novembro de 2001). «n-Hexane-related periférica neuropathy among Automotive Technicals--California, 1999-2000» (em inglês). MMWR. Morbidade e Mortalidade Relatório Semanal. 50 (45): 1011–1013. ISSN 0149-2195. PMID 11724159.
- ^ «CDC – NIOSH Pocket Guide to Chemical Hazards – Hexane isomers (excluindo n-Hexane)» (em inglês). Cdc.gov. Arquivado do original em 31 de outubro de 2015. Retrieved 3 de Novembro 2015.
- ↑ a b CDC (28 de março de 2018). "n-Hexane". Centros de Controle e Prevenção de Doenças. Retrieved 3 de Maio 2020.
- ^ «Appendix G: 1989 Air Contaminants Update Project - Exposure Limits NOT in Effect» (em inglês). www.cdc20 de Fevereiro de 2020. Retrieved 3 de Maio 2020.
- ^ Gad, Shayne C (2005), "Petroleum Hydrocarbons", Enciclopédia da Toxicologia, vol. 3 (2nd ed.), Elsevier, pp. 377–379
- ↑ a b Clough, Stephen R; Mulholland, Leyna (2005). "Hexane". Enciclopédia da Toxicologia. Vol. 2 (2a ed.). Elsevier. pp. 522–525.
- ^ Rizzuto, N; De Grandis, D; Di Trapani, G; Pasinato, E (1980). "N-hexano polineuropatia. Uma doença ocupacional de sapateiros". Neurologia Europeia. 19 (5): 308–15. doi:10.1159/000115166. PMID 6249607.
- ^ n-Hexane, Critérios de Saúde Ambiental, Organização Mundial da Saúde, 1991, arquivado do original em 19 de março de 2014
- ^ Liu, C. H.; Huang, C. Y.; Huang, C. C. (2012). «Occupational Neurotoxic Diseases in Taiwan» (em inglês). Segurança e Saúde no Trabalho. 3 (4): 257–67. doi:10.5491/SHAW.2012.3.4.257. PMC 3521924. PMID 23251841.
- ^ «Workers envenened while making iPhones – ABC News (Australian Broadcasting Corporation)» (em inglês). Australian Broadcasting Corporation (em inglês). 26 de outubro de 2010. Arquivado do original em 8 de abril de 2011. Retrieved 17 de Março 2015.
- ^ David Barboza (22 de fevereiro de 2011). «Workers Sickened at Apple Fornecedor in China» (em inglês). The New York Times. Arquivado do original em 7 de abril de 2015. Retrieved 17 de Março 2015.
- ^ Filser JG, Csanády GA, Dietz W, Kessler W, Kreuzer PE, Richter M, Störmer A (1996). «Comparative Estimation of the Neurotoxic Risks of N-Hexane and N-Heptane in Rats and Humans Based on the Formation of the Metabolites 2,5-Hexanedione and 2,5-Heptanedione» (em inglês). Intermediários Reativos Biológicos V. Avanços em Medicina Experimental e Biologia. Vol. 387. pp. 411–427. doi:10.1007/978-1-4757-9480-9_50. ISBN 978-1-4757-9482-3. PMID 8794236.
Ligações externas
- Cartão de Segurança Química Internacional 1262 (2-metilpentane)
- Segurança dos materiais Folha de dados para Hexane
- Poluente Nacional Inventário – folha de fatos n-hexane
- Entrada de banco de dados Phytochemica l
- Centro de Controle e Prevenção de Doenças
- Aviso do Conselho Nacional de Segurança "AFFECTOS QUÍMICOS COMUNS AUTO MECHANICS"
- Australian National Pollutant Inventory (NPI) page
- "A EPA não considera n-hexane classificável como um cancerígeno humano." Registo Federal / Vol. 66, No. 71 / Quinta-feira, 12 Abril 2001 / Regras e Regulamentos