Glicina
Glicina (símbolo Gly ou G;) é um aminoácido que possui um único átomo de hidrogênio como sua cadeia lateral. É o aminoácido estável mais simples (o ácido carbâmico é instável), com a fórmula química NH2-CH2-COOH. A glicina é um dos aminoácidos proteinogênicos. É codificado por todos os códons começando com GG (GGU, GGC, GGA, GGG). A glicina é essencial para a formação de alfa-hélices na estrutura da proteína secundária devido à sua forma compacta. Pela mesma razão, é o aminoácido mais abundante nas triplas hélices do colágeno. A glicina também é um neurotransmissor inibitório – a interferência em sua liberação dentro da medula espinhal (como durante uma infecção por Clostridium tetani) pode causar paralisia espástica devido à contração muscular desinibida.
É o único aminoácido proteinogênico aquiral. Ele pode se encaixar em ambientes hidrofílicos ou hidrofóbicos, devido à sua cadeia lateral mínima de apenas um átomo de hidrogênio.
História e etimologia
A glicina foi descoberta em 1820 pelo químico francês Henri Braconnot quando ele hidrolisou a gelatina fervendo-a com ácido sulfúrico. Ele originalmente o chamou de "açúcar de gelatina", mas o químico francês Jean-Baptiste Boussingault mostrou em 1838 que continha nitrogênio. Em 1847, o cientista americano Eben Norton Horsford, então aluno do químico alemão Justus von Liebig, propôs o nome "glicocolo"; no entanto, o químico sueco Berzelius sugeriu o nome atual mais simples um ano depois. O nome vem da palavra grega γλυκύς "sabor doce" (que também está relacionado aos prefixos glico- e glico-, como em glicoproteína e glicose). Em 1858, o químico francês Auguste Cahours determinou que a glicina era uma amina do ácido acético.
Produção
Embora a glicina possa ser isolada da proteína hidrolisada, esta rota não é usada para produção industrial, pois pode ser fabricada de forma mais conveniente por síntese química. Os dois processos principais são a aminação do ácido cloroacético com amônia, dando glicina e cloreto de amônio, e a síntese de aminoácidos de Strecker, que é o principal método sintético nos Estados Unidos e no Japão. Cerca de 15 mil toneladas são produzidas anualmente dessa forma.
A glicina também é cogerada como uma impureza na síntese de EDTA, decorrente de reações do coproduto amônia.
Reações químicas
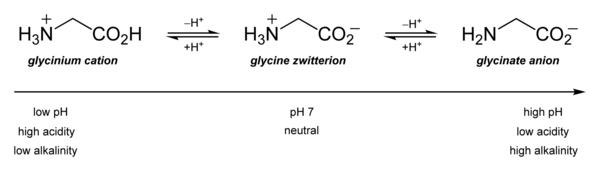
Suas propriedades ácido-base são as mais importantes. Em solução aquosa, a glicina é anfotérica: abaixo de pH = 2,4, ela se converte no cátion amônio chamado glicínio. Acima de cerca de 9,6, converte-se em glicinato.
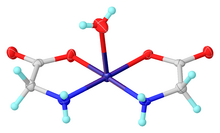
A glicina funciona como um ligante bidentado para muitos íons metálicos, formando complexos de aminoácidos. Um complexo típico é Cu(glicinato)2, ou seja, Cu(H2NCH2CO2)2, que existe nos isômeros cis e trans.
Com cloretos ácidos, a glicina se converte em ácido amidocarboxílico, como ácido hipúrico e acetilglicina. Com o ácido nitroso, obtém-se o ácido glicólico (determinação de van Slyke). Com iodeto de metila, a amina torna-se quaternizada para dar trimetilglicina, um produto natural:
- H. H. H.
3N+
CH
2COO- Sim.
+ 3 CH3I → (CH)
3)
3N+
CH
2COO- Sim.
+ 3 HI
A glicina condensa consigo mesma para dar peptídeos, começando com a formação de glicilglicina:
- 2 H. H. H.
3N+
CH
2COO- Sim.
→ H. H. H.
3N+
CH
2CONH
2COO- Sim.
+ H2O
A pirólise de glicina ou glicilglicina dá 2,5-dicetopiperazina, a diamida cíclica.
Forma ésteres com álcoois. Eles são frequentemente isolados como seu cloridrato, por exemplo, cloridrato de éster metílico de glicina. Caso contrário, o éster livre tende a se converter em dicetopiperazina.
Como uma molécula bifuncional, a glicina reage com muitos reagentes. Estas podem ser classificadas em reacções centradas em N e centradas em carboxilato.
Metabolismo
Biossíntese
A glicina não é essencial para a dieta humana, pois é biossintetizada no corpo a partir do aminoácido serina, que por sua vez é derivado do 3-fosfoglicerato, mas uma publicação feita por vendedores de suplementos parece mostrar que a capacidade metabólica para a biossíntese de glicina não satisfaz a necessidade de síntese de colágeno. Na maioria dos organismos, a enzima serina hidroximetiltransferase catalisa essa transformação através do cofator piridoxal fosfato:
- serina + tetrahidrofola → glicina + N5,N10-metileno tetrahidrofolato + H2O
No fígado de vertebrados, a síntese de glicina é catalisada pela glicina sintase (também chamada de enzima de clivagem da glicina). Esta conversão é facilmente reversível:
- CO2 + NH+
4 + N5,N10.-metileno tetrahidrofolato + NADH + H+ Glycine + tetrahidrofolato + NAD+
Além de ser sintetizada a partir da serina, a glicina também pode ser derivada da treonina, colina ou hidroxiprolina através do metabolismo entre órgãos do fígado e rins.
Degradação
A glicina é degradada por três vias. A via predominante em animais e plantas é o inverso da via da glicina sintase mencionada acima. Nesse contexto, o sistema enzimático envolvido costuma ser chamado de sistema de clivagem da glicina:
- Glycine + tetrahidrofolato + NAD+ ⇌2 + NH+
4 + N5,N10.-metileno tetrahidrofolato + NADH + H+
Na segunda via, a glicina é degradada em duas etapas. A primeira etapa é o inverso da biossíntese de glicina a partir de serina com serina hidroximetil transferase. A serina é então convertida em piruvato pela serina desidratase.
Na terceira via de sua degradação, a glicina é convertida em glioxilato pela D-aminoácido oxidase. O glioxilato é então oxidado pela lactato desidrogenase hepática a oxalato em uma reação dependente de NAD+.
A meia-vida da glicina e sua eliminação do corpo variam significativamente com base na dose. Em um estudo, a meia-vida variou entre 0,5 e 4,0 horas.
A glicina é extremamente sensível a antibióticos que visam o folato, e os níveis de glicina no sangue caem drasticamente dentro de um minuto após as injeções de antibióticos. Alguns antibióticos podem esgotar mais de 90% da glicina em poucos minutos após a administração.
Função fisiológica
A principal função da glicina é atuar como precursora de proteínas. A maioria das proteínas incorpora apenas pequenas quantidades de glicina, sendo uma exceção notável o colágeno, que contém cerca de 35% de glicina devido ao seu papel periodicamente repetido na formação da estrutura da hélice do colágeno em conjunto com a hidroxiprolina. No código genético, a glicina é codificada por todos os códons que começam com GG, ou seja, GGU, GGC, GGA e GGG.
Como intermediário biossintético
Em eucariotos superiores, o ácido δ-aminolevulínico, o principal precursor das porfirinas, é biossintetizado a partir de glicina e succinil-CoA pela enzima ALA sintase. A glicina fornece a subunidade central C2N de todas as purinas.
Como um neurotransmissor
A glicina é um neurotransmissor inibitório no sistema nervoso central, especialmente na medula espinhal, tronco cerebral e retina. Quando os receptores de glicina são ativados, o cloreto entra no neurônio via receptores ionotrópicos, causando um potencial pós-sináptico inibitório (IPSP). A estricnina é um forte antagonista dos receptores ionotrópicos da glicina, enquanto a bicuculina é um antagonista fraco. A glicina é um co-agonista necessário junto com o glutamato para os receptores NMDA. Em contraste com o papel inibitório da glicina na medula espinhal, esse comportamento é facilitado nos receptores glutamatérgicos (NMDA) que são excitatórios. A LD50 da glicina é de 7930 mg/kg em ratos (oral) e geralmente causa morte por hiperexcitabilidade.
Usos
Nos EUA, a glicina é normalmente vendida em dois graus: United States Pharmacopeia (“USP”) e grau técnico. As vendas de grau USP respondem por aproximadamente 80 a 85 por cento do mercado dos EUA para glicina. Se for necessária uma pureza maior do que o padrão USP, por exemplo, para injeções intravenosas, uma glicina de grau farmacêutico mais cara pode ser usada. A glicina de grau técnico, que pode ou não atender aos padrões de grau da USP, é vendida a um preço mais baixo para uso em aplicações industriais, por exemplo, como agente de complexação e acabamento de metais.
Alimentos de origem animal e humana
A glicina não é amplamente utilizada em alimentos por seu valor nutricional, exceto em infusões. Em vez disso, o papel da glicina na química dos alimentos é como um aromatizante. É levemente doce e contraria o sabor residual da sacarina. Também possui propriedades conservantes, talvez devido à sua complexação com íons metálicos. Complexos de glicinato metálico, e. glicinato de cobre(II) são usados como suplementos para ração animal.
A "Food and Drug Administration dos EUA não considera mais a glicina e seus sais como geralmente reconhecidos como seguros para uso em alimentos humanos".
Matéria-prima química
A glicina é um intermediário na síntese de uma variedade de produtos químicos. É usado na fabricação dos herbicidas glifosato, iprodiona, glifosina, imiprotrina e eglinazina. É usado como intermediário de medicamentos como o tianfenicol.
Pesquisa de laboratório
A glicina é um componente significativo de algumas soluções usadas no método SDS-PAGE de análise de proteínas. Ele serve como agente tampão, mantendo o pH e evitando danos à amostra durante a eletroforese. A glicina também é usada para remover anticorpos de marcação de proteínas de membranas de Western blot para permitir a sondagem de numerosas proteínas de interesse do gel SDS-PAGE. Isso permite que mais dados sejam extraídos do mesmo espécime, aumentando a confiabilidade dos dados, reduzindo a quantidade de processamento de amostras e o número de amostras necessárias. Este processo é conhecido como decapagem.
Presença no espaço
A presença de glicina fora da Terra foi confirmada em 2009, com base na análise de amostras que foram coletadas em 2004 pela espaçonave Stardust da NASA do cometa Wild 2 e posteriormente retornaram à Terra. A glicina já havia sido identificada no meteorito Murchison em 1970. A descoberta de glicina no espaço sideral reforçou a hipótese da chamada panspermia branda, que afirma que os "blocos de construção" da vida estão espalhados por todo o universo. Em 2016, foi anunciada a detecção de glicina dentro do cometa 67P/Churyumov–Gerasimenko pela espaçonave Rosetta.
A detecção de glicina fora do Sistema Solar no meio interestelar tem sido debatida. Em 2008, o Instituto Max Planck de Radioastronomia descobriu as linhas espectrais de um precursor de glicina (aminoacetonitrila) na Grande Molécula Heimat, uma gigantesca nuvem de gás perto do centro galáctico na constelação de Sagitário.
Evolução
Propõe-se que a glicina seja definida por códigos genéticos iniciais. Por exemplo, regiões de baixa complexidade (em proteínas), que podem se assemelhar aos protopeptídeos do código genético inicial, são altamente enriquecidas em glicina.
Presença nos alimentos
| Alimentos | g/100g |
|---|---|
| Snacks, peles de porco | 11.04 |
| Farinha de sementes de gergelim (baixa gordura) | 3.43 |
| Bebidas, pó de proteína (baseado na soja) | 2.37 |
| Sementes, farinha de semente de gergelim, parcialmente difamada | 2.2.2. |
| Carne, bisão, carne e outros (várias partes) | 1.5-2.0 |
| sobremesas de gelatina | 1.96 |
| Sementes, grãos de sementes de abóbora e squash | 1.82 |
| Turquia, todas as classes, costas, carne e pele | 1.79 |
| Frango, frangos de corte ou fritadeiras, carne e pele | 1.74 |
| Carne de porco, terreno, 96% magra / 4% de gordura, cozida, desmorona | 1.71 |
| Bacon e varas de carne | 1.6.4 |
| Amendoim | 1.6.3 |
| Crustáceos, lagosta espinhal | 1.59 |
| Temperos, sementes de mostarda, terra | 1.59 |
| Salami | 1.55 |
| Nozes, nozes, secos | 1.51 |
| Peixe, salmão, rosa, sólidos enlatados, drenados | 1.42 |
| Amêndoas | 1.42 |
| Peixe, cavala | 0,93 |
| Cereais prontos a comer, granola, caseiro | 0,801 |
| Leeks, (bulb e porção de folha inferior), congelado | 0 |
| Queijo, parmesão (e outros), ralado | 0,56 |
| Sojas, verdes, cozidos, cozidos, drenados, sem sal | 0,51 |
| Pão, proteína (inclui glúten) | 0 |
| Ovo, todo, cozido, frito | 0 |
| Feijões, sementes brancas, maduras, cozinhadas, fervidas, com sal | 0,38 |
| Lentilhas, sementes maduras, cozinhadas, fervidas, com sal | 0,38 |
Contenido relacionado
Kittiwake
Bicarbonato
Acácia sensu lato