Fulereno
Um fulereno é um alótropo de carbono cuja molécula consiste em átomos de carbono ligados por ligações simples e duplas de modo a formar uma malha fechada ou parcialmente fechada, com anéis fundidos de cinco a sete átomos. A molécula pode ser uma esfera oca, elipsóide, tubo ou muitas outras formas e tamanhos. O grafeno (camadas atômicas isoladas de grafite), que é uma malha plana de anéis hexagonais regulares, pode ser visto como um membro extremo da família.
Os fulerenos com uma topologia de malha fechada são informalmente denotados por sua fórmula empírica Cn, muitas vezes escrita Cn, onde n é o número de átomos de carbono. No entanto, para alguns valores de n pode haver mais de um isômero.
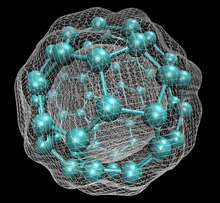
A família recebeu o nome de buckminsterfulereno (C60), o membro mais famoso, que por sua vez recebeu o nome de Buckminster Fuller. Os fulerenos fechados, especialmente C60, também são informalmente chamados de buckyballs por sua semelhança com a bola padrão do futebol americano ("futebol"). Os fulerenos fechados aninhados foram denominados cebolas bucky. Fulerenos cilíndricos também são chamados de nanotubos de carbono ou buckytubes. A forma sólida a granel de fulerenos puros ou mistos é chamada de fulerita.
Os fulerenos já eram previstos há algum tempo, mas somente após sua síntese acidental em 1985 eles foram detectados na natureza e no espaço sideral. A descoberta de fulerenos expandiu enormemente o número de alótropos conhecidos de carbono, que anteriormente se limitavam a grafite, diamante e carbono amorfo, como fuligem e carvão. Eles têm sido objeto de intensa pesquisa, tanto por sua química quanto por suas aplicações tecnológicas, especialmente em ciência de materiais, eletrônica e nanotecnologia.
História
Previsões e observações limitadas
O icosaédrico C
60H
60 gaiola foi mencionado em 1965 como uma possível estrutura topológica. Eiji Osawa previu a existência de C
60 em 1970. Ele notou que a estrutura de uma molécula de coranuleno era um subconjunto da forma de uma bola de futebol, e levantou a hipótese de que também poderia existir uma forma de bola completa. Jornais científicos japoneses relataram sua ideia, mas nem ela nem nenhuma tradução dela chegaram à Europa ou às Américas.
Também em 1970, R. W. Henson (então do UK Atomic Energy Research Establishment) propôs o C
60 estrutura e feito um modelo dela. Infelizmente, as evidências para essa nova forma de carbono eram muito fracas na época, então a proposta foi recebida com ceticismo e nunca foi publicada. Foi reconhecido apenas em 1999.
Em 1973, independentemente de Henson, um grupo de cientistas da URSS fez uma análise químico-quântica da estabilidade de C
60 e calculou sua estrutura eletrônica. O artigo foi publicado em 1973, mas a comunidade científica não deu muita importância a essa previsão teórica.
Por volta de 1980, Sumio Iijima identificou a molécula de C
60 de uma imagem de microscópio eletrônico de negro de fumo, onde se formou o núcleo de uma partícula com a estrutura de uma "cebola bucky".
Também na década de 1980 no MIT, Mildred Dresselhaus e Morinobu Endo, em colaboração com T. Venkatesan, dirigiram estudos explodindo grafite com lasers, produzindo aglomerados de átomos de carbono, que mais tarde seriam identificados como "fulerenos."
Descoberta do C60
Em 1985, Harold Kroto da Universidade de Sussex, trabalhando com James R. Heath, Sean O'Brien, Robert Curl e Richard Smalley da Rice University, descobriu fulerenos no resíduo fuliginoso criado pela vaporização de carbono em hélio atmosfera. No espectro de massa do produto, apareceram picos discretos correspondentes a moléculas com a massa exata de sessenta ou setenta ou mais átomos de carbono, ou seja, C
60 e C
70. A equipe identificou sua estrutura como as agora familiares "buckyballs".
O nome "buckminsterfulereno" acabou sendo escolhido para C
60 pelos descobridores como uma homenagem ao arquiteto americano Buckminster Fuller pela vaga semelhança da estrutura com o cúpulas geodésicas que ele popularizou; que, se fossem estendidos a uma esfera completa, também teriam o grupo de simetria icosaédrico. O "ene" O final foi escolhido para indicar que os carbonos são insaturados, estando ligados a apenas três outros átomos em vez dos quatro normais. O nome abreviado "fulereno" acabou por ser aplicado a toda a família.
Kroto, Curl e Smalley receberam o Prêmio Nobel de Química de 1996 por seus papéis na descoberta dessa classe de moléculas.
Outros desenvolvimentos
Kroto e a equipe de Rice já descobriram outros fulerenos além do C60, e a lista foi muito ampliada nos anos seguintes. Os nanotubos de carbono foram descobertos e sintetizados pela primeira vez em 1991.
Após sua descoberta, quantidades mínimas de fulerenos foram encontradas em chamas fuliginosas e por descargas elétricas na atmosfera. Em 1992, fulerenos foram encontrados em uma família de mineraloides conhecida como shungitas na Carélia, na Rússia.
As técnicas de produção foram aprimoradas por muitos cientistas, incluindo Donald Huffman, Wolfgang Krätschmer, Lowell D. Lamb e Konstantinos Fostiropoulos. Graças aos seus esforços, em 1990 era relativamente fácil produzir amostras do tamanho de gramas de pó de fulereno. A purificação do fulereno continua sendo um desafio para os químicos e, em grande parte, determina os preços do fulereno.
Em 2010, as assinaturas espectrais de C60 e C70 foram observadas pelo telescópio infravermelho Spitzer da NASA em uma nuvem de poeira cósmica em torno de uma estrela 6500 anos luz de distância. Kroto comentou: "Esta descoberta muito emocionante fornece evidências convincentes de que a fulereca, como eu suspeitava há muito tempo, existe desde tempos imemoriais nos recessos escuros de nossa galáxia." De acordo com a astrônoma Letizia Stanghellini, "É possível que fulerenos do espaço tenham fornecido sementes para a vida na Terra." Em 2019, moléculas C60 ionizadas foram detectadas com o Telescópio Espacial Hubble no espaço entre essas estrelas.
Tipos
Existem duas famílias principais de fulerenos, com propriedades e aplicações bastante distintas: as buckyballs fechadas e os nanotubos de carbono cilíndricos abertos. No entanto, existem estruturas híbridas entre essas duas classes, como nanobotões de carbono - nanotubos cobertos por malhas hemisféricas ou "buckybuds" maiores.
Buckyballs
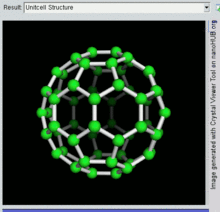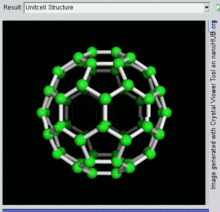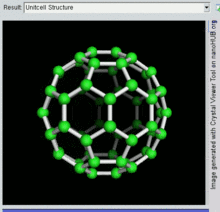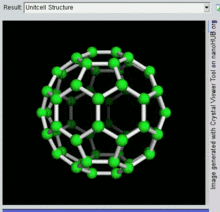
Buckminsterfulereno
Buckminsterfulereno é a menor molécula de fulereno contendo anéis pentagonais e hexagonais nos quais não há dois pentágonos compartilhando uma borda (o que pode ser desestabilizador, como no pentaleno). Também é mais comum em termos de ocorrência natural, pois muitas vezes pode ser encontrado na fuligem.
A fórmula empírica do buckminsterfulereno é C
60 e sua estrutura é um icosaedro truncado, que se assemelha a uma bola de futebol americano de o tipo feito de vinte hexágonos e doze pentágonos, com um átomo de carbono nos vértices de cada polígono e uma ligação ao longo de cada aresta do polígono.
O diâmetro de van der Waals de uma molécula de buckminsterfulereno é de cerca de 1,1 nanômetros (nm). O diâmetro núcleo a núcleo de uma molécula de buckminsterfulereno é de cerca de 0,71 nm.
A molécula de buckminsterfulereno tem dois comprimentos de ligação. As ligações do anel 6:6 (entre dois hexágonos) podem ser consideradas "ligações duplas" e são mais curtos que as ligações 6:5 (entre um hexágono e um pentágono). Seu comprimento médio de ligação é de 1,4 Å.
Outros fulerenos
Outro fulereno bastante comum tem fórmula empírica C
70, mas fulerenos com 72, 76, 84 e até 100 átomos de carbono são comumente obtidos.
O menor fulereno possível é o dodecaédrico C
20. Não há fulerenos com 22 vértices. O número de diferentes fulerenos C2n cresce com o aumento de n = 12, 13, 14,..., aproximadamente na proporção de n9 (sequência A007894 no OEIS). Por exemplo, existem 1812 fulerenos não isomórficos C
60. Observe que apenas uma forma de C
60, buckminsterfulereno, não tem nenhum par de pentágonos adjacentes (o menor desses fulerenos). Para ilustrar ainda mais o crescimento, existem 214.127.713 fulerenos não isomórficos C
200, 15.655.672 dos quais não possuem pentágonos adjacentes. Estruturas otimizadas de muitos isômeros de fulereno são publicadas e listadas na web.
Os heterofulerenos têm heteroátomos substituindo carbonos em estruturas em forma de gaiola ou tubo. Eles foram descobertos em 1993 e expandem muito a classe geral de compostos do fulereno e podem ter ligações pendentes em suas superfícies. Exemplos notáveis incluem derivados de boro, nitrogênio (azafulereno), oxigênio e fósforo.
Nanotubos de carbono
Nanotubos de carbono são fulerenos cilíndricos. Esses tubos de carbono geralmente têm apenas alguns nanômetros de largura, mas podem variar de menos de um micrômetro a vários milímetros de comprimento. Eles geralmente têm pontas fechadas, mas também podem ser abertas. Há também casos em que o tubo diminui de diâmetro antes de fechar. Sua estrutura molecular única resulta em propriedades macroscópicas extraordinárias, incluindo alta resistência à tração, alta condutividade elétrica, alta ductilidade, alta condutividade térmica e relativa inatividade química (por ser cilíndrica e "planar" - isto é, tem sem átomos "expostos" que podem ser facilmente deslocados). Um uso proposto de nanotubos de carbono é em baterias de papel, desenvolvidas em 2007 por pesquisadores do Rensselaer Polytechnic Institute. Outra proposta de uso altamente especulativa no campo das tecnologias espaciais é a produção de cabos de carbono de alta resistência necessários para um elevador espacial.
Derivados
Buckyballs e nanotubos de carbono têm sido usados como blocos de construção para uma grande variedade de derivados e estruturas maiores, como
- Buckyballs aninhados (" nano-onions de carbono" ou "buckyonions") propostos para lubrificantes;
- nanotubos de carbono aninhados ("mítulos de carbono")
- Dimers "bola e cadeia" (dois bolas ligadas por uma cadeia de carbono)
- Anéis de bolas ligadas.
Heterofulerenos e fulerenos sem carbono
Após a descoberta do C60, muitos fulerenos foram sintetizados (ou estudados teoricamente por métodos de modelagem molecular) nos quais alguns ou todos os átomos de carbono são substituídos por outros elementos. Nanotubos não-carbono, em particular, têm atraído muita atenção.
Boro
Um tipo de buckyball que usa átomos de boro, em vez do carbono usual, foi previsto e descrito em 2007. O B
80, com cada átomo formando 5 ou 6 ligações, foi previsto para ser mais estável do que o C
60 buckyball. No entanto, análises subsequentes descobriram que a estrutura simétrica Ih prevista era vibracionalmente instável e a gaiola resultante sofreria uma quebra espontânea de simetria, produzindo uma gaiola enrugada com rara simetria Th (simetria de uma bola de vôlei). O número de anéis de seis membros nesta molécula é 20 e o número de anéis de cinco membros é 12. Há um átomo adicional no centro de cada anel de seis membros, ligado a cada átomo ao seu redor. Empregando um algoritmo sistemático de busca global, descobriu-se mais tarde que o b
80 fulereno não é um máximo global para 80 - aglomerados de átomos de boro e, portanto, não podem ser encontrados na natureza; as configurações mais estáveis são complexas. O mesmo artigo concluiu que a paisagem energética do boro, ao contrário de outras, tem muitas estruturas desordenadas de baixa energia, portanto, é improvável que fulerenos puros de boro existam na natureza.
No entanto, um B
40 complexo apelidado de borospherene foi preparado em 2014. Este complexo tem duas faces hexagonais e quatro heptagonais faces com simetria em D2d intercaladas com uma rede de 48 triângulos.
Outros elementos
Estruturas inorgânicas (sem carbono) do tipo fulereno foram construídas com sulfeto de molibdênio(IV) (MoS2), há muito usado como lubrificante tipo grafite, tungstênio (WS2), titânio (TiS2) e nióbio (NbS2). Esses materiais mostraram-se estáveis até pelo menos 350 toneladas/cm2 (34,3 GPa).
Os complexos icosaédricos ou icosaédricos distorcidos do tipo fulereno também foram preparados para germânio, estanho e chumbo; alguns desses complexos são suficientemente espaçosos para conter a maioria dos átomos de metais de transição.
Principais fulerenos
Abaixo está uma tabela dos principais fulerenos de carbono fechados sintetizados e caracterizados até agora, com seu número CAS quando conhecido. Fulerenos com menos de 60 átomos de carbono foram chamados de "fulerenos inferiores", e aqueles com mais de 70 átomos de "fulerenos superiores".
| Fórmula | Num. Isom.[1] | Mol. Symm. | Cryst. Symm. | Grupo de espaço | Não. | Pearson símbolo | um (nm) | b) (nm) | c (nm) | β | Z. | ? (g / cm)3) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C 20. | 1 | Eu...h | ||||||||||
| C 60 | 1 | Eu...h | ||||||||||
| C 70 | 1 | D5h | ||||||||||
| C 72 | 1 | D6h | ||||||||||
| C 74 | 1 | D3h | ||||||||||
| C 76 | 2 | D2* | Monoclínico | P21 | 4 | MP2 | 1.102 | 1.108 | 1.768 | 108.10 | 2 | 1.48 |
| Cubic | F m3m | 225 | CF4 | 1.5475 | 1.5475 | 1.5475 | 90 | 4 | 1.6.4 | |||
| C 78 | 5 | D2 | ||||||||||
| C 80 | 7 | |||||||||||
| C 82 | 9 | C 2C2C3 | Monoclínico | P21 | 4 | MP2 | 1.141 | 1.1355 | 1,753 | 108.07 | 2 | |
| C 84 | 24. | D2*, D2d | Cubic | F m3m | 1.5817 | 1.5817 | 1.5817 | 90 | ||||
| C 86 | 19 | |||||||||||
| C 88 | 35 | |||||||||||
| C 90 | 46. | |||||||||||
| C 3996 |
Na tabela, "Num.Isom." é o número de possíveis isômeros dentro da "regra do pentágono isolado", que afirma que dois pentágonos em um fulereno não devem compartilhar arestas. "Mol.Symm." é a simetria da molécula, enquanto "Cryst.Symm." é o da estrutura cristalina no estado sólido. Ambos são especificados para a(s) forma(s) mais abundante(s) experimentalmente. O asterisco * marca simetrias com mais de uma forma quiral.
Quando C
76 ou C
82 cristais são cultivados a partir de uma solução de tolueno, eles têm uma simetria monoclínica. A estrutura cristalina contém moléculas de tolueno compactadas entre as esferas do fulereno. No entanto, a evaporação do solvente de C
76 o transforma em uma forma cúbica centrada na face. As fases monoclínica e cúbica de face centrada (FCC) são conhecidas por fulerenos C60 e C70 melhor caracterizados.
Propriedades
Topologia
Os diagramas de Schlegel são frequentemente usados para esclarecer a estrutura 3D de fulerenos de casca fechada, pois as projeções 2D geralmente não são ideais nesse sentido.
Em termos matemáticos, a topologia combinatória (ou seja, os átomos de carbono e as ligações entre eles, ignorando suas posições e distâncias) de um fulereno de casca fechada com uma superfície média simples semelhante a uma esfera (orientável, gênero zero) pode ser representado como um poliedro convexo; mais precisamente, seu esqueleto unidimensional, formado por seus vértices e arestas. O diagrama de Schlegel é uma projeção desse esqueleto em uma das faces do poliedro, através de um ponto fora dessa face; para que todos os outros vértices se projetem dentro dessa face.
- diagramas de Schlegel de alguns fullerenes
O diagrama de Schlegel de um fulereno fechado é um gráfico planar e 3-regular (ou "cúbico", significando que todos os vértices têm grau 3).
Um fulereno fechado com casca esférica deve ter pelo menos alguns ciclos que são pentágonos ou heptágonos. Mais precisamente, se todas as faces tiverem 5 ou 6 lados, segue-se da fórmula do poliedro de Euler, V−E+F =2 (onde V, E, F são os números de vértices, arestas e faces), que V deve ser par e deve haver exatamente 12 pentágonos e V/2−10 hexágonos. Restrições semelhantes existem se o fulereno tiver ciclos heptagonais (sete átomos).
Fulerenos abertos, como nanotubos de carbono e grafeno, podem consistir inteiramente de anéis hexagonais. Em teoria, um longo nanotubo com extremidades unidas para formar uma folha fechada semelhante a um toro também poderia consistir inteiramente de hexágonos.
Vínculo
Como cada átomo de carbono está conectado a apenas três vizinhos, em vez dos quatro habituais, costuma-se descrever essas ligações como sendo uma mistura de ligações covalentes simples e duplas. A hibridização do carbono em C60 foi relatada como sp2.01. O estado de ligação pode ser analisado por espectroscopia Raman, espectroscopia de IV e espectroscopia de fotoelétrons de raios-X.
Encapsulação
Átomos adicionais, íons, aglomerados ou pequenas moléculas podem ser aprisionados dentro dos fulerenos para formar compostos de inclusão conhecidos como fulerenos endoédricos. Um exemplo incomum é o fulereno em forma de ovo Tb3N@C
84, que viola o regra do pentágono isolado. A evidência de um impacto de meteoro no final do período Permiano foi encontrada analisando gases nobres preservados por serem aprisionados em fulerenos.
Pesquisa
No início dos anos 2000, as propriedades químicas e físicas dos fulerenos eram um tema importante no campo de pesquisa e desenvolvimento. A Popular Science discutiu possíveis usos de fulerenos (grafeno) em armaduras.
No campo da nanotecnologia, a resistência ao calor e a supercondutividade são algumas das propriedades mais estudadas.
Existem muitos cálculos que foram feitos usando métodos quânticos ab-initio aplicados a fulerenos. Pelos métodos DFT e TD-DFT pode-se obter espectros de IR, Raman e UV. Os resultados de tais cálculos podem ser comparados com resultados experimentais.
O fulereno é um reagente incomum em muitas reações orgânicas, como a reação de Bingel descoberta em 1993.
Aromaticidade
Os pesquisadores conseguiram aumentar a reatividade dos fulerenos anexando grupos ativos às suas superfícies. Buckminsterfulereno não exibe "superaromaticidade": ou seja, os elétrons nos anéis hexagonais não se deslocam sobre toda a molécula.
Um fulereno esférico de n átomos de carbono tem n elétrons de ligação pi, livres para deslocalizar. Estes devem tentar se deslocalizar sobre toda a molécula. A mecânica quântica de tal arranjo deve ser como apenas uma camada da conhecida estrutura da mecânica quântica de um único átomo, com uma camada preenchida estável para n = 2, 8, 18, 32, 50, 72, 98, 128, etc. (ou seja, duas vezes um número quadrado perfeito), mas esta série não inclui 60. Esta regra 2(N + 1)2 (com N inteiro) para aromaticidade esférica é o análogo tridimensional da regra de Hückel. O cátion 10+ satisfaria esta regra e deveria ser aromático. Este foi o caso usando modelagem química quântica, que mostrou a existência de fortes correntes de esfera diamagnética no cátion.
Como resultado, C
60 na água tende a pegar mais dois elétrons e se tornar um ânion. O nC
60 descrito abaixo pode ser o resultado de C
60 tentando formar uma ligação metálica solta.
Reações
Polimerização
Sob alta pressão e temperatura, os fulerenos colapsam para formar várias estruturas de carbono uni, bi ou tridimensionais. Polímeros de cadeia simples são formados usando a rota de polimerização por adição radical por transferência atômica (ATRAP).
"Ultrahard fullerite" é um termo cunhado freqüentemente usado para descrever o material produzido pelo processamento de fullerita de alta pressão e alta temperatura (HPHT). Tal tratamento converte a fulerita em uma forma nanocristalina de diamante, que foi relatada por exibir propriedades mecânicas notáveis.
Química
Os fulerenos são estáveis, mas não totalmente inativos. Os átomos de carbono sp2 hibridizados, que estão em seu mínimo de energia em grafite planar, devem ser dobrados para formar a esfera ou tubo fechado, que produz tensão angular. A reação característica dos fulerenos é a adição eletrofílica em ligações duplas 6,6, que reduz a tensão angular ao transformar carbonos hibridizados sp2 em hibridizados sp3. A mudança nos orbitais hibridizados faz com que os ângulos de ligação diminuam de cerca de 120° nos orbitais sp2 para cerca de 109,5° nos orbitais sp3. Essa diminuição nos ângulos de ligação permite que as ligações se dobrem menos ao fechar a esfera ou tubo e, assim, a molécula se torna mais estável.
Solubilidade
Os fulerenos são solúveis em muitos solventes orgânicos, como tolueno, clorobenzeno e 1,2,3-tricloropropano. As solubilidades são geralmente bastante baixas, como 8 g/L para C60 em dissulfeto de carbono. Ainda assim, os fulerenos são o único alótropo conhecido de carbono que pode ser dissolvido em solventes comuns à temperatura ambiente. Entre os melhores solventes está o 1-cloronaftaleno, que dissolverá 51 g/L de C60.
Soluções de buckminsterfulereno puro têm uma cor púrpura profunda. Soluções de C
70 são castanhos avermelhados. Os fulerenos superiores C
76 para C
84 têm uma variedade de cores.
Cristais milimétricos de C
60 e C
70, puro e solvatado, pode ser cultivado a partir de solução de benzeno. Cristalização de C
60 da solução de benzeno abaixo de 30 °C (quando a solubilidade é máxima) produz um solvato sólido triclínico C
60·4C
6estilo H
6. Acima de 30 °C obtém-se fcc livre de solvato C
60.
Mecânica quântica
Em 1999, pesquisadores da Universidade de Viena demonstraram que a dualidade onda-partícula se aplicava a moléculas como o fulereno.
Supercondutividade
Os fulerenos são normalmente isolantes elétricos, mas quando cristalizados com metais alcalinos, o composto resultante pode ser condutor ou mesmo supercondutor.
Quiralidade
Alguns fulerenos (por exemplo, C
76, C
78, C
80 e C
84) são inerentemente quirais porque são D2-simétricos e foram resolvidos com sucesso. Esforços de pesquisa estão em andamento para desenvolver sensores específicos para seus enantiômeros.
Estabilidade
Duas teorias foram propostas para descrever os mecanismos moleculares que produzem os fulerenos. A antiga teoria “de baixo para cima” propõe que eles são construídos átomo por átomo. A abordagem alternativa “de cima para baixo” afirma que os fulerenos se formam quando estruturas muito maiores se quebram em partes constituintes.
Em 2013, pesquisadores descobriram que fulerenos assimétricos formados a partir de estruturas maiores se transformam em fulerenos estáveis. A substância sintetizada era um metalofulereno específico, consistindo de 84 átomos de carbono com dois átomos de carbono adicionais e dois átomos de ítrio dentro da gaiola. O processo produziu aproximadamente 100 microgramas.
No entanto, eles descobriram que a molécula assimétrica poderia teoricamente entrar em colapso para formar quase todos os fulerenos e metalofulerenos conhecidos. Pequenas perturbações envolvendo a quebra de algumas ligações moleculares fazem com que a gaiola se torne altamente simétrica e estável. Essa percepção apóia a teoria de que os fulerenos podem ser formados a partir do grafeno quando as ligações moleculares apropriadas são rompidas.
Nomenclatura sistemática
De acordo com a IUPAC, para nomear um fulereno, deve-se citar o número de átomos membros para os anéis que compõem o fulereno, seu grupo de pontos de simetria na notação de Schoenflies e o número total de átomos. Por exemplo, buckminsterfulereno C60 é nomeado sistematicamente (C
60-Ih)[5,6]fulereno. O nome do grupo pontual deve ser mantido em qualquer derivada do referido fulereno, mesmo que essa simetria seja perdida pela derivação.
Para indicar a posição de elementos substituídos ou ligados, os átomos de fulereno são geralmente numerados em um caminho espiral, geralmente começando com o anel em um dos eixos principais. Se a estrutura do fulereno não permitir tal numeração, outro átomo de partida foi escolhido para ainda alcançar uma sequência de caminho espiral.
O último é o caso de C70, que é (C
70-D5h(6))[5,6]fulereno na notação IUPAC. A simetria D5h(6) significa que este é o isômero onde o eixo C5 passa por um pentágono cercado por hexágonos em vez de pentágonos.
Na nomenclatura da IUPAC, análogos totalmente saturados de fulerenos são chamados de fuleranos. Se a malha tiver outro(s) elemento(s) substituído(s) por um ou mais carbonos, o composto é denominado heterofulereno. Se uma ligação dupla for substituída por uma ponte de metileno −CH2−, a estrutura resultante é um homofulereno. Se um átomo estiver totalmente deletado e faltando valências saturadas com átomos de hidrogênio, é um norfulereno. Quando as ligações são removidas (tanto sigma quanto pi), o composto se torna secofulereno; se algumas novas ligações forem adicionadas em uma ordem não convencional, é um ciclofulereno.
Produção
A produção de fulereno geralmente começa com a produção de fuligem rica em fulereno. O método original (e ainda atual) era enviar uma grande corrente elétrica entre dois eletrodos de grafite próximos em uma atmosfera inerte. O arco elétrico resultante vaporiza o carbono em um plasma que então esfria em um resíduo fuliginoso. Alternativamente, a fuligem é produzida por ablação a laser de grafite ou pirólise de hidrocarbonetos aromáticos. A combustão de benzeno é o processo mais eficiente, desenvolvido no MIT.
Esses processos produzem uma mistura de vários fulerenos e outras formas de carbono. Os fulerenos são então extraídos da fuligem usando solventes orgânicos apropriados e separados por cromatografia. Pode-se obter quantidades em miligramas de fulerenos com 80 átomos ou mais. C76, C78 e C84 estão disponíveis comercialmente.
Aplicativos
Os fulerenos têm sido extensivamente usados para várias aplicações biomédicas, incluindo o design de agentes de contraste de ressonância magnética de alto desempenho, agentes de contraste de imagem de raios-X, terapia fotodinâmica e entrega de drogas e genes, resumidos em várias revisões abrangentes.
Pesquisa de tumores
Embora pesquisas anteriores sobre o câncer tenham envolvido radioterapia, é importante estudar a terapia fotodinâmica porque os avanços nos tratamentos para células tumorais darão mais opções a pacientes com diferentes condições. Experimentos recentes usando células HeLa na pesquisa do câncer envolvem o desenvolvimento de novos fotossensibilizadores com maior capacidade de serem absorvidos pelas células cancerígenas e ainda desencadear a morte celular. Também é importante que um novo fotossensibilizador não permaneça no corpo por muito tempo para evitar danos celulares indesejados.
Os fulerenos podem ser produzidos para serem absorvidos pelas células HeLa. O C
60 derivados podem ser entregues às células usando os grupos funcionais L-fenilalanina, ácido fólico e L-arginina entre outros.
A funcionalização dos fulerenos visa aumentar a solubilidade da molécula pelas células cancerígenas. As células cancerígenas absorvem essas moléculas em uma taxa aumentada devido a uma regulação positiva dos transportadores na célula cancerígena; neste caso, os transportadores de aminoácidos trarão os grupos funcionais L-arginina e L-fenilalanina dos fulerenos.
Uma vez absorvido pelas células, o C
60 derivados reagiriam à radiação luminosa transformando o oxigênio molecular em oxigênio reativo que desencadeia apoptose nas células HeLa e outras células cancerígenas que podem absorver a molécula de fulereno. Esta pesquisa mostra que uma substância reativa pode atingir as células cancerígenas e, em seguida, ser acionada pela radiação luminosa, minimizando os danos aos tecidos circundantes durante o tratamento.
Quando absorvida pelas células cancerígenas e exposta à radiação luminosa, a reação que cria o oxigênio reativo danifica o DNA, as proteínas e os lipídios que compõem a célula cancerígena. Esse dano celular força a célula cancerosa a entrar em apoptose, o que pode levar à redução do tamanho de um tumor. Assim que o tratamento de radiação de luz terminar, o fulereno reabsorverá os radicais livres para evitar danos a outros tecidos. Como esse tratamento se concentra nas células cancerígenas, é uma boa opção para pacientes cujas células cancerígenas estão ao alcance da radiação luminosa. À medida que esta pesquisa continua, o tratamento pode penetrar mais profundamente no corpo e ser absorvido pelas células cancerígenas de forma mais eficaz.
Segurança e toxicidade
Em 2013, uma revisão abrangente sobre a toxicidade do fulereno foi publicada, revisando o trabalho que começou no início dos anos 1990 e concluiu que muito poucas evidências coletadas desde a descoberta dos fulerenos indicam que C
60 é tóxico. A toxicidade dessas nanopartículas de carbono não depende apenas da dose e do tempo, mas também de vários outros fatores, como:
- tipo (por exemplo: C
60, C
70, M@C
60, M@C
82) - grupos funcionais usados para resolver a água estas nanopartículas (por exemplo: OH, COOH)
- método de administração (por exemplo: intravenoso, intraperitoneal)
Foi recomendado avaliar a farmacologia de cada novo complexo à base de fulereno ou metalofulereno individualmente como um composto diferente.
Cultura popular
Exemplos de fulerenos aparecem com frequência na cultura popular. Os fulerenos apareceram na ficção bem antes de os cientistas se interessarem seriamente por eles. Em uma coluna humoristicamente especulativa de 1966 para New Scientist, David Jones sugeriu a possibilidade de fazer moléculas de carbono ocas gigantes distorcendo uma rede plana hexagonal com a adição de átomos de impureza.
Contenido relacionado
Lantânio
Ácido benzóico
Boro










![(C 60-Ih)[5,6]fullerene Carbon numbering.](https://upload.wikimedia.org/wikipedia/commons/thumb/c/c8/Buckminsterfullerene-2D-skeletal_numbered.svg/200px-Buckminsterfullerene-2D-skeletal_numbered.svg.png)
![(C 70-D5h(6))[5,6]fullerene Carbon numbering.](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/C70fullerene-2D-skeletal_numbered.svg/187px-C70fullerene-2D-skeletal_numbered.svg.png)
![(C 70-D5h(6))[5,6]fullerene Non-equivalent bonds shown by different colours.](https://upload.wikimedia.org/wikipedia/commons/thumb/9/99/C70fullerene-2D-skeletal_numbered_isobonds.svg/187px-C70fullerene-2D-skeletal_numbered_isobonds.svg.png)
)[5,6]fullerene.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d7/Cyclopropa12_C70fullerene-2D-skeletal_renumbered.svg/198px-Cyclopropa12_C70fullerene-2D-skeletal_renumbered.svg.png)
)[5,6]fullerene.](https://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Cyclopropa212_C70fullerene-2D-skeletal_renumbered.svg/198px-Cyclopropa212_C70fullerene-2D-skeletal_renumbered.svg.png)
![C 71-PCBM, [1,2]-isomer. IUPAC name is methyl 4-(3’-phenyl-3’H-cyclopropa[1,2](C 70-D5h(6))[5,6]fullerene-3’-yl)butyrate.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/PC71BM.svg/200px-PC71BM.svg.png)