Espectroscopia de infravermelho
Espectroscopia infravermelha (espectroscopia IR ou espectroscopia vibracional) é a medição da interação da radiação infravermelha com a matéria por absorção, emissão ou reflexão. É usado para estudar e identificar substâncias químicas ou grupos funcionais nas formas sólida, líquida ou gasosa. Pode ser usado para caracterizar novos materiais ou identificar e verificar amostras conhecidas e desconhecidas. O método ou técnica de espectroscopia infravermelha é conduzido com um instrumento chamado espectrômetro infravermelho (ou espectrofotômetro) que produz um espectro infravermelho. Um espectro de infravermelho pode ser visualizado em um gráfico de absorção de luz infravermelha (ou transmitância) no eixo vertical versus frequência, número de onda ou comprimento de onda no eixo horizontal. Unidades típicas de número de onda usadas em espectros de infravermelho são centímetros recíprocos, com o símbolo cm−1. Unidades de comprimento de onda IR são comumente dadas em micrômetros (anteriormente chamados de "mícrons"), símbolo μm, que estão relacionados ao número de onda de forma recíproca. Um instrumento de laboratório comum que usa essa técnica é um espectrômetro de infravermelho por transformada de Fourier (FTIR). IR bidimensional também é possível conforme discutido abaixo.
A porção infravermelha do espectro eletromagnético é geralmente dividida em três regiões; o infravermelho próximo, médio e distante, nomeados por sua relação com o espectro visível. O infravermelho próximo de maior energia, aproximadamente 14.000–4.000 cm−1 (comprimento de onda de 0,7–2,5 μm) pode excitar modos harmônicos ou combinados de vibrações moleculares. O infravermelho médio, aproximadamente 4.000–400 cm−1 (2,5–25 μm) é geralmente usado para estudar as vibrações fundamentais e a estrutura rotacional-vibratória associada. O infravermelho distante, aproximadamente 400–10 cm−1 (25–1.000 μm) tem baixa energia e pode ser usado para espectroscopia rotacional e vibrações de baixa frequência. A região de 2–130 cm−1, na fronteira com a região de micro-ondas, é considerada a região terahertz e pode sondar vibrações intermoleculares. Os nomes e classificações dessas sub-regiões são convenções e são apenas vagamente baseados nas propriedades moleculares ou eletromagnéticas relativas.
Teoria
A espectroscopia infravermelha explora o fato de que as moléculas absorvem frequências que são características de sua estrutura. Essas absorções ocorrem em frequências ressonantes, ou seja, a frequência da radiação absorvida corresponde à frequência vibracional. As energias são afetadas pela forma das superfícies de energia potencial molecular, as massas dos átomos e o acoplamento vibrônico associado.
Em particular, nas aproximações de Born-Oppenheimer e harmônicas (ou seja, quando o hamiltoniano molecular correspondente ao estado fundamental eletrônico pode ser aproximado por um oscilador harmônico na vizinhança da geometria molecular de equilíbrio), as frequências ressonantes são associadas com o modos normais de vibração correspondentes à superfície de energia potencial do estado fundamental eletrônico molecular.
As frequências ressonantes também estão relacionadas à força da ligação e à massa dos átomos em cada extremidade dela. Assim, a frequência das vibrações está associada a um determinado modo normal de movimento e a um determinado tipo de ligação.
Número de modos vibracionais
Para que um modo vibracional em uma amostra seja "IR ativo", ele deve estar associado a mudanças no momento de dipolo da ligação. Um dipolo permanente não é necessário, pois a regra exige apenas uma mudança no momento do dipolo.
Uma molécula pode vibrar de várias maneiras, e cada maneira é chamada de modo vibracional. Para moléculas com N número de átomos, moléculas geometricamente lineares têm 3N – 5 graus de modos vibracionais, enquanto moléculas não lineares têm 3N – 6 graus de modos vibracionais (também chamados graus de liberdade vibracionais). Como exemplos, o dióxido de carbono linear (CO2) tem 3 × 3 – 5 = 4, enquanto a água não linear (H2O) tem apenas 3 × 3 – 6 = 3.
Moléculas diatômicas simples têm apenas uma ligação e apenas uma banda vibracional. Se a molécula for simétrica, e. N2, a banda não é observada no espectro IR, mas apenas no espectro Raman. Moléculas diatômicas assimétricas, por ex. monóxido de carbono (CO), absorvem no espectro IR. Moléculas mais complexas têm muitas ligações e seus espectros vibracionais são correspondentemente mais complexos, ou seja, moléculas grandes têm muitos picos em seus espectros de infravermelho.
Os átomos de um grupo CH2X2, comumente encontrados em compostos orgânicos e onde X pode representar qualquer outro átomo, podem vibrar de nove maneiras diferentes. Seis dessas vibrações envolvem apenas a porção CH2: dois modos de alongamento (ν): simétrico (νs) e antisimétrico (νcomo); e quatro modos de flexão: tesoura (δ), balançar (ρ), abanar (ω) e torcendo (τ), como mostrado abaixo. As estruturas que não possuem os dois grupos X adicionais anexados têm menos modos porque alguns modos são definidos por relacionamentos específicos com esses outros grupos anexados. Por exemplo, na água, os modos de balanço, balanço e torção não existem porque esses tipos de movimentos dos átomos de H representam a rotação simples de toda a molécula, em vez de vibrações dentro dela. No caso de moléculas mais complexas, modos vibracionais fora do plano (γ) também podem estar presentes.
Simetria Direcção | Symmetric | Antisymmetric |
|---|---|---|
| Radial |  Esticamento simétrico (νS) |  Esticamento antissimétrico (νcomo) |
| Latitudinal |  Tesoura (δ) |  Rocking (em inglês) |
| Longitudinal |  Wagging (ω) |  Torção (τ) |
Estes números não representam o "recuo" dos átomos de C, que, embora necessariamente presentes para equilibrar os movimentos gerais da molécula, são muito menores que os movimentos dos átomos de H mais leves.
As bandas IR mais simples e importantes ou fundamentais surgem das excitações dos modos normais, das distorções mais simples da molécula, do estado fundamental com número quântico vibracional v = 0 ao primeiro estado excitado com número quântico vibracional v = 1. Em alguns casos, bandas harmônicas são observadas. Uma banda harmônica surge da absorção de um fóton levando a uma transição direta do estado fundamental para o segundo estado vibracional excitado (v = 2). Essa banda aparece com aproximadamente o dobro da energia da banda fundamental para o mesmo modo normal. Algumas excitações, chamadas de modos de combinação, envolvem a excitação simultânea de mais de um modo normal. O fenômeno da ressonância de Fermi pode surgir quando dois modos são similares em energia; A ressonância de Fermi resulta em uma mudança inesperada na energia e intensidade das bandas, etc.
Espectroscopia infravermelha prática
O espectro infravermelho de uma amostra é registrado passando um feixe de luz infravermelha através da amostra. Quando a frequência do IR é a mesma que a frequência vibracional de uma ligação ou coleção de ligações, ocorre a absorção. O exame da luz transmitida revela quanta energia foi absorvida em cada frequência (ou comprimento de onda). Essa medição pode ser obtida por meio da varredura da faixa de comprimento de onda usando um monocromador. Alternativamente, toda a faixa de comprimento de onda é medida usando um instrumento de transformada de Fourier e, em seguida, um espectro de transmitância ou absorção é gerado usando um procedimento dedicado.
Esta técnica é comumente usada para analisar amostras com ligações covalentes. Espectros simples são obtidos de amostras com poucas ligações ativas de IR e altos níveis de pureza. Estruturas moleculares mais complexas levam a mais bandas de absorção e espectros mais complexos.
Preparação da amostra
Amostras de gás
Amostras gasosas requerem uma cubeta de amostra com um comprimento de caminho longo para compensar a diluição. O comprimento do caminho da célula de amostra depende da concentração do composto de interesse. Um tubo de vidro simples com comprimento de 5 a 10 cm equipado com janelas transparentes de infravermelho em ambas as extremidades do tubo pode ser usado para concentrações de até várias centenas de ppm. Concentrações de gás de amostra bem abaixo de ppm podem ser medidas com uma célula de White na qual a luz infravermelha é guiada com espelhos para viajar através do gás. As células de White estão disponíveis com caminho óptico de 0,5 m até cem metros.
Amostras líquidas
Amostras líquidas podem ser colocadas entre duas placas de um sal (geralmente cloreto de sódio ou sal comum, embora também sejam usados vários outros sais, como brometo de potássio ou fluoreto de cálcio). As placas são transparentes à luz infravermelha e não introduzem nenhuma linha no espectro.
Amostras sólidas
Amostras sólidas podem ser preparadas de várias maneiras. Um método comum é esmagar a amostra com um agente de mistura oleoso (geralmente óleo mineral Nujol). Uma película fina do mull é aplicada em placas de sal e medida. O segundo método é moer uma quantidade da amostra com um sal especialmente purificado (geralmente brometo de potássio) finamente (para remover os efeitos de dispersão de grandes cristais). Esta mistura de pó é então prensada em uma prensa mecânica para formar um pellet translúcido através do qual o feixe do espectrômetro pode passar. Uma terceira técnica é o "filme do elenco" técnica, que é usada principalmente para materiais poliméricos. A amostra é primeiro dissolvida em um solvente não higroscópico adequado. Uma gota desta solução é depositada na superfície da célula KBr ou NaCl. A solução é então evaporada até a secura e o filme formado na célula é analisado diretamente. É importante ter cuidado para garantir que o filme não seja muito espesso, caso contrário, a luz não poderá passar. Esta técnica é adequada para análises qualitativas. O método final é usar a microtomia para cortar um filme fino (20–100 μm) de uma amostra sólida. Esta é uma das formas mais importantes de analisar produtos plásticos com defeito, por exemplo, porque a integridade do sólido é preservada.
Na espectroscopia fotoacústica, a necessidade de tratamento da amostra é mínima. A amostra, líquida ou sólida, é colocada no copo de amostra que é inserido na célula fotoacústica que é selada para a medição. A amostra pode ser uma peça sólida, pó ou basicamente em qualquer forma para a medição. Por exemplo, um pedaço de rocha pode ser inserido no copo de amostra e o espectro medido a partir dele.
Comparando com uma referência
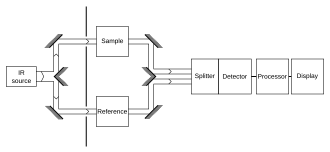
É típico registrar o espectro da amostra e uma "referência". Esta etapa controla uma série de variáveis, por ex. detector infravermelho, que pode afetar o espectro. A medição de referência permite eliminar a influência do instrumento.
A "referência" depende da medição e seu objetivo. A medição de referência mais simples é simplesmente remover a amostra (substituindo-a por ar). No entanto, às vezes uma referência diferente é mais útil. Por exemplo, se a amostra for um soluto diluído dissolvido em água em um béquer, uma boa medida de referência pode ser medir água pura no mesmo béquer. Em seguida, a medição de referência cancelaria não apenas todas as propriedades instrumentais (como a fonte de luz usada), mas também as propriedades de absorção e reflexão de luz da água e do béquer, e o resultado final mostraria apenas as propriedades do soluto (pelo menos aproximadamente).
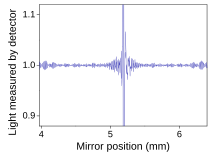
Uma maneira comum de comparar com uma referência é sequencialmente: primeiro meça a referência, depois substitua a referência pela amostra e meça a amostra. Essa técnica não é perfeitamente confiável; se a lâmpada infravermelha for um pouco mais brilhante durante a medição de referência, então um pouco mais fraca durante a medição da amostra, a medição será distorcida. Métodos mais elaborados, como um feixe de "dois feixes" configuração (veja a figura), pode corrigir esses tipos de efeitos para dar resultados muito precisos. O método de adição padrão pode ser usado para cancelar estatisticamente esses erros.
No entanto, entre as diferentes técnicas baseadas em absorção que são usadas para a detecção de espécies gasosas, a espectroscopia anelar de cavidade (CRDS) pode ser usada como um método livre de calibração. O fato de o CRDS ser baseado nas medições dos tempos de vida dos fótons (e não na intensidade do laser) torna desnecessário qualquer calibração e comparação com uma referência
FTIR
Espectroscopia de infravermelho por transformada de Fourier (FTIR) é uma técnica de medição que permite registrar espectros de infravermelho. A luz infravermelha é guiada através de um interferômetro e depois através da amostra (ou vice-versa). Um espelho móvel dentro do aparelho altera a distribuição da luz infravermelha que passa pelo interferômetro. O sinal registrado diretamente, chamado de "interferograma", representa a saída de luz em função da posição do espelho. Uma técnica de processamento de dados chamada transformada de Fourier transforma esses dados brutos no resultado desejado (o espectro da amostra): saída de luz em função do comprimento de onda infravermelho (ou equivalente, número de onda). Conforme descrito acima, o espectro da amostra é sempre comparado a uma referência.
Um método alternativo para adquirir espectros é o método "dispersivo" ou "monocromador de varredura" método. Nesta abordagem, a amostra é irradiada sequencialmente com vários comprimentos de onda únicos. O método dispersivo é mais comum na espectroscopia UV-Vis, mas é menos prático no infravermelho do que o método FTIR. Uma razão pela qual o FTIR é favorecido é chamada de "vantagem de Fellgett" ou a "vantagem multiplex": as informações em todas as frequências são coletadas simultaneamente, melhorando a velocidade e a relação sinal-ruído. Outro é chamado de "Jacquinot's Throughput Advantage": Uma medição dispersiva requer a detecção de níveis de luz muito mais baixos do que uma medição FTIR. Existem outras vantagens, bem como algumas desvantagens, mas praticamente todos os espectrômetros infravermelhos modernos são instrumentos FTIR.
Microscopia infravermelha
Existem várias formas de microscopia infravermelha. Isso inclui versões IR de microscopia de subdifração, como IR NSOM, microespectroscopia fototérmica, Nano-FTIR e espectroscopia infravermelha baseada em microscópio de força atômica (AFM-IR).
Outros métodos em espectroscopia vibracional molecular
A espectroscopia infravermelha não é o único método de estudar espectros vibracionais moleculares. A espectroscopia Raman envolve um processo de espalhamento inelástico no qual apenas parte da energia de um fóton incidente é absorvida pela molécula, e a parte restante é espalhada e detectada. A diferença de energia corresponde à energia vibracional absorvida.
As regras de seleção para infravermelho e espectroscopia Raman são diferentes pelo menos para algumas simetrias moleculares, de modo que os dois métodos são complementares na medida em que observam vibrações de diferentes simetrias.
Outro método é a espectroscopia de perda de energia eletrônica (EELS), na qual a energia absorvida é fornecida por um elétron espalhado inelasticamente em vez de um fóton. Este método é útil para estudar vibrações de moléculas adsorvidas em uma superfície sólida.
Recentemente, EELS de alta resolução (HREELS) surgiu como uma técnica para realizar espectroscopia vibracional em um microscópio eletrônico de transmissão (TEM). Em combinação com a alta resolução espacial do TEM, experimentos sem precedentes foram realizados, como medições de temperatura em nanoescala, mapeamento de moléculas marcadas isotopicamente, mapeamento de modos de fônon em espaço de posição e momento, superfície vibracional e mapeamento de modo de massa em nanocubos e investigações de modos de polariton em cristais de van der Waals. A análise de modos vibracionais que são inativos no infravermelho, mas aparecem na dispersão inelástica de nêutrons, também é possível em alta resolução espacial usando EELS. Embora a resolução espacial dos HREELs seja muito alta, as bandas são extremamente amplas em comparação com outras técnicas.
Microscopia infravermelha computacional
Usando simulações de computador e análise de modo normal, é possível calcular frequências teóricas de moléculas.
Bandas de absorção
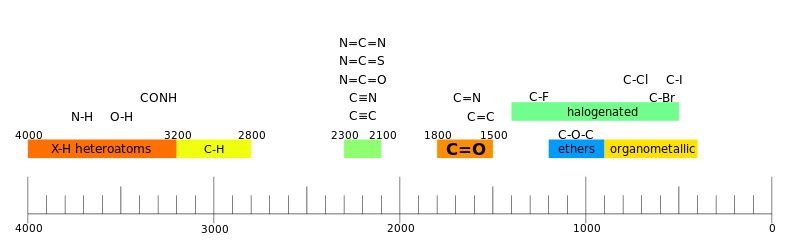
A espectroscopia de IV é frequentemente utilizada para identificar estruturas porque os grupos funcionais dão origem a bandas características tanto em termos de intensidade como de posição (frequência). As posições dessas bandas são resumidas em tabelas de correlação conforme mostrado abaixo.
Regiões
Um espectrógrafo é frequentemente interpretado como tendo duas regiões.
- região do grupo funcional ≥ ≥ 1,500.cm- Sim. - Sim. 1{displaystyle geq 1,500{text{ cm}}^{-1}}}}
Na região funcional, há um ou alguns vales por grupo funcional.
- região de impressão digital <math alttext="{displaystyle <1,500.cm- Sim. - Sim. 1{displaystyle <1,500{text{ cm}}^{-1}}}}<img alt="{displaystyle
Na região da impressão digital existem muitas cavidades que formam um padrão intrincado que pode ser usado como uma impressão digital para determinar o composto.
Regra do texugo
Para muitos tipos de amostras, as atribuições são conhecidas, ou seja, quais deformações de ligação estão associadas a qual frequência. Nesses casos, mais informações podem ser obtidas sobre a força de uma ligação, com base na diretriz empírica chamada Regra do texugo. Originalmente publicada por Richard McLean Badger em 1934, esta regra afirma que a força de uma ligação (em termos de constante de força) se correlaciona com o comprimento da ligação. Ou seja, o aumento na força de ligação leva ao correspondente encurtamento da ligação e vice-versa.
Usos e aplicações
A espectroscopia de infravermelho é uma técnica simples e confiável amplamente utilizada tanto na química orgânica quanto na inorgânica, na pesquisa e na indústria. Na pesquisa de catálise é uma ferramenta muito útil para caracterizar o catalisador, bem como para detectar intermediários e produtos durante a reação catalítica. Ele é usado em aplicações de controle de qualidade, medição dinâmica e monitoramento, como a medição autônoma de longo prazo de concentrações de CO2 em estufas e câmaras de crescimento por analisadores de gás infravermelho.
Também é usado em análises forenses em casos criminais e civis, por exemplo, na identificação de degradação de polímeros. Ele pode ser usado para determinar o teor de álcool no sangue de um suspeito de dirigir embriagado.
A espectroscopia de infravermelho tem sido usada com sucesso na análise e identificação de pigmentos em pinturas e outros objetos de arte, como manuscritos iluminados.
Uma maneira útil de analisar amostras sólidas sem a necessidade de cortar amostras usa ATR ou espectroscopia de refletância total atenuada. Usando esta abordagem, as amostras são pressionadas contra a face de um único cristal. A radiação infravermelha passa pelo cristal e só interage com a amostra na interface entre os dois materiais.
Com o aumento da tecnologia de filtragem de computador e manipulação dos resultados, as amostras em solução agora podem ser medidas com precisão (a água produz uma ampla absorção em todo o intervalo de interesse e, portanto, torna os espectros ilegíveis sem esse tratamento de computador).
Alguns instrumentos também identificam automaticamente a substância sendo medida a partir de um armazenamento de milhares de espectros de referência armazenados.
A espectroscopia infravermelha também é útil para medir o grau de polimerização na fabricação de polímeros. Mudanças no caráter ou quantidade de um título específico são avaliadas medindo-se em uma frequência específica ao longo do tempo. Instrumentos de pesquisa modernos podem fazer medições de infravermelho em toda a faixa de interesse com frequência de até 32 vezes por segundo. Isso pode ser feito enquanto medições simultâneas são feitas usando outras técnicas. Isso torna as observações de reações químicas e processos mais rápidos e precisos.
A espectroscopia infravermelha também foi utilizada com sucesso no campo da microeletrônica de semicondutores: por exemplo, a espectroscopia infravermelha pode ser aplicada a semicondutores como silício, arseneto de gálio, nitreto de gálio, seleneto de zinco, silício amorfo, nitreto de silício, etc.
Outra aplicação importante da espectroscopia infravermelha é na indústria de alimentos para medir a concentração de vários compostos em diferentes produtos alimentícios.
Os instrumentos agora são pequenos e podem ser transportados, mesmo para uso em testes de campo.
A espectroscopia de infravermelho também é usada em dispositivos de detecção de vazamento de gás, como DP-IR e EyeCGAs. Esses dispositivos detectam vazamentos de gás de hidrocarbonetos no transporte de gás natural e petróleo bruto.
Em fevereiro de 2014, a NASA anunciou um banco de dados bastante atualizado, baseado em espectroscopia de infravermelho, para rastrear hidrocarbonetos aromáticos policíclicos (PAHs) no universo. Segundo os cientistas, mais de 20% do carbono do universo pode estar associado aos PAHs, possíveis matérias-primas para a formação da vida. Os PAHs parecem ter sido formados logo após o Big Bang, estão espalhados por todo o universo e estão associados a novas estrelas e exoplanetas. A espectroscopia infravermelha é um importante método de análise no processo de reciclagem de resíduos plásticos domésticos, e um conveniente método isolador para separar plásticos de diferentes polímeros (PET, HDPE,...).
Outros desenvolvimentos incluem um espectrômetro infravermelho em miniatura que está vinculado a um banco de dados baseado em nuvem e adequado para uso diário pessoal, e chips espectroscópicos NIR que podem ser incorporados em smartphones e vários dispositivos.
Efeitos isotópicos
Os diferentes isótopos em uma espécie particular podem exibir diferentes detalhes finos na espectroscopia de infravermelho. Por exemplo, a frequência de alongamento O–O (em centímetros recíprocos) da oxihemocianina é determinada experimentalmente como 832 e 788 cm−1 para ν(16O– 16O) e ν(18O–18O), respectivamente.
Ao considerar a ligação O–O como uma mola, a frequência de absorção pode ser calculada como um número de onda [= frequência/(velocidade da luz)]
- Processo Processo ~ ~ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =12D D ckμ μ {displaystyle } - Sim. Não. c}} Não. Sim.
onde k é a constante elástica da ligação, c é a velocidade da luz e μ é a massa reduzida do A -Sistema B:
- μ μ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =mAmBmA+mB{displaystyle mu ={frac Não. (A) }m_{mathrm {B} }}{m_{mathrm - Sim.
(mEu...Não. m_{i}} é a massa do átomo Eu...Não.).
As massas reduzidas para 16O–16O e 18O–18O podem ser aproximadas como 8 e 9 respectivamente. Por isso
- Processo Processo ~ ~ (16.O)Processo Processo ~ ~ (18.O)= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =98? ? 832788.{displaystyle {frac {{tilde {nu }}(^{16}mathrm {O})}{{tilde {nu }}(^{18}mathrm {O})}}={sqrt {frac {9}{8}}}approx {frac {832}{788}}}.}
O efeito dos isótopos, tanto na vibração quanto na dinâmica de decaimento, é mais forte do que se pensava anteriormente. Em alguns sistemas, como o silício e o germânio, o decaimento do modo de estiramento anti-simétrico do oxigênio intersticial envolve o modo de estiramento simétrico com forte dependência isotópica. Por exemplo, foi mostrado que, para uma amostra de silício natural, o tempo de vida da vibração anti-simétrica é de 11,4 ps. Quando o isótopo de um dos átomos de silício é aumentado para 29Si, o tempo de vida aumenta para 19 ps. De maneira semelhante, quando o átomo de silício é alterado para 30Si, o tempo de vida torna-se 27 ps.
IV bidimensional
Análise de espectroscopia de correlação infravermelha bidimensional combina várias amostras de espectros infravermelhos para revelar propriedades mais complexas. Ao estender as informações espectrais de uma amostra perturbada, a análise espectral é simplificada e a resolução é aprimorada. Os espectros 2D síncronos e 2D assíncronos representam uma visão geral gráfica das mudanças espectrais devido a uma perturbação (como uma mudança de concentração ou mudança de temperatura), bem como a relação entre as mudanças espectrais em dois números de onda diferentes.

Espectroscopia infravermelha bidimensional não linear é a versão infravermelha da espectroscopia de correlação. A espectroscopia infravermelha bidimensional não linear é uma técnica que se tornou disponível com o desenvolvimento de pulsos de laser infravermelho de femtossegundos. Neste experimento, primeiro um conjunto de pulsos de bomba é aplicado à amostra. Isto é seguido por um tempo de espera durante o qual o sistema pode relaxar. O tempo de espera típico dura de zero a vários picossegundos, e a duração pode ser controlada com uma resolução de dezenas de femtossegundos. Um pulso de sonda é então aplicado, resultando na emissão de um sinal da amostra. O espectro infravermelho bidimensional não linear é um gráfico de correlação bidimensional da frequência ω1 que foi excitada pelos pulsos iniciais da bomba e a frequência ω3 excitada pela sonda pulso após o tempo de espera. Isso permite a observação do acoplamento entre diferentes modos vibracionais; por causa de sua resolução de tempo extremamente fina, ele pode ser usado para monitorar a dinâmica molecular em uma escala de tempo de picossegundos. Ainda é uma técnica amplamente inexplorada e está se tornando cada vez mais popular para pesquisas fundamentais.
Assim como a espectroscopia de ressonância magnética nuclear bidimensional (2DNMR), esta técnica espalha o espectro em duas dimensões e permite a observação de picos cruzados que contêm informações sobre o acoplamento entre diferentes modos. Em contraste com 2DNMR, a espectroscopia infravermelha bidimensional não linear também envolve a excitação de harmônicos. Essas excitações resultam em picos de absorção do estado excitado localizados abaixo dos picos diagonais e cruzados. Em 2DNMR, duas técnicas distintas, COSY e NOESY, são freqüentemente usadas. Os picos cruzados no primeiro estão relacionados ao acoplamento escalar, enquanto no segundo estão relacionados à transferência de spin entre diferentes núcleos. Na espectroscopia infravermelha bidimensional não linear, análogos foram desenhados para essas técnicas de 2DNMR. A espectroscopia infravermelha bidimensional não linear com tempo de espera zero corresponde a COSY, e a espectroscopia infravermelha bidimensional não linear com tempo de espera finito permitindo a transferência de população vibracional corresponde a NOESY. A variante COSY da espectroscopia infravermelha bidimensional não linear tem sido usada para a determinação do conteúdo da estrutura secundária das proteínas.
Contenido relacionado
Microscopia
Ligase
Filtro