Engenharia Biomédica
Engenharia biomédica (BME) ou engenharia médica é a aplicação de princípios de engenharia e conceitos de design à medicina e biologia para fins de saúde (por exemplo,, diagnóstico ou terapêutico). A BME também é uma ciência tradicionalmente lógica para promover o tratamento de saúde, incluindo diagnóstico, monitoramento e terapia. Também incluído no escopo de um engenheiro biomédico está o gerenciamento de equipamentos médicos atuais em hospitais, aderindo aos padrões relevantes da indústria. Isso envolve aquisição, testes de rotina, manutenção preventiva e recomendações de equipamentos, uma função também conhecida como Técnico de Equipamentos Biomédicos (BMET) ou como engenharia clínica.
A engenharia biomédica surgiu recentemente como um estudo próprio, em comparação com muitos outros campos da engenharia. Tal evolução é comum como uma nova transição de campo de uma especialização interdisciplinar entre campos já estabelecidos para ser considerado um campo em si. Grande parte do trabalho em engenharia biomédica consiste em pesquisa e desenvolvimento, abrangendo uma ampla gama de subcampos (veja abaixo). As aplicações proeminentes da engenharia biomédica incluem o desenvolvimento de próteses biocompatíveis, vários dispositivos médicos diagnósticos e terapêuticos, desde equipamentos clínicos a micro-implantes, equipamentos de imagem comuns, como ressonâncias magnéticas e EKG/ECGs, crescimento regenerativo de tecidos, medicamentos farmacêuticos e biológicos terapêuticos.
Bioinformática
Bioinformática é um campo interdisciplinar que desenvolve métodos e ferramentas de software para entender dados biológicos. Como um campo interdisciplinar da ciência, a bioinformática combina ciência da computação, estatística, matemática e engenharia para analisar e interpretar dados biológicos.
Bioinformática é considerada tanto um termo abrangente para o corpo de estudos biológicos que usam a programação de computadores como parte de sua metodologia, quanto uma referência a "pipelines" que são repetidamente usados, particularmente no campo da genômica. Os usos comuns da bioinformática incluem a identificação de genes e nucleotídeos candidatos (SNPs). Freqüentemente, essa identificação é feita com o objetivo de entender melhor a base genética da doença, adaptações únicas, propriedades desejáveis (especialmente em espécies agrícolas) ou diferenças entre populações. De uma forma menos formal, a bioinformática também tenta entender os princípios organizacionais nas sequências de ácidos nucléicos e proteínas.
Biomecânica
A biomecânica é o estudo da estrutura e função dos aspectos mecânicos dos sistemas biológicos, em qualquer nível, desde organismos inteiros até órgãos, células e organelas celulares, usando os métodos da mecânica.
Biomaterial
Um biomaterial é qualquer matéria, superfície ou construção que interage com sistemas vivos. Como ciência, biomateriais tem cerca de cinquenta anos. O estudo dos biomateriais é chamado ciência dos biomateriais ou engenharia dos biomateriais. Ele experimentou um crescimento constante e forte ao longo de sua história, com muitas empresas investindo grandes quantias de dinheiro no desenvolvimento de novos produtos. A ciência dos biomateriais abrange elementos da medicina, biologia, química, engenharia de tecidos e ciência dos materiais.
Óptica biomédica
A óptica biomédica refere-se à interação do tecido biológico e da luz, e como isso pode ser explorado para detecção, geração de imagens e tratamento.
Engenharia de tecidos
A engenharia de tecidos, como a engenharia genética (veja abaixo), é um segmento importante da biotecnologia – que se sobrepõe significativamente ao BME.
Um dos objetivos da engenharia de tecidos é criar órgãos artificiais (via material biológico) para pacientes que precisam de transplantes de órgãos. Engenheiros biomédicos estão atualmente pesquisando métodos para criar tais órgãos. Os pesquisadores desenvolveram mandíbulas e traquéias sólidas a partir de células-tronco humanas para esse fim. Várias bexigas urinárias artificiais foram cultivadas em laboratórios e transplantadas com sucesso em pacientes humanos. Órgãos bioartificiais, que usam componentes sintéticos e biológicos, também são uma área de foco em pesquisa, como dispositivos de assistência hepática que usam células hepáticas dentro de uma construção de biorreator artificial.
Engenharia genética
Engenharia genética, tecnologia de DNA recombinante, modificação/manipulação genética (GM) e splicing de genes são termos que se aplicam à manipulação direta dos genes de um organismo. Ao contrário da reprodução tradicional, um método indireto de manipulação genética, a engenharia genética utiliza ferramentas modernas, como clonagem e transformação molecular, para alterar diretamente a estrutura e as características dos genes-alvo. As técnicas de engenharia genética tiveram sucesso em inúmeras aplicações. Alguns exemplos incluem a melhoria da tecnologia agrícola (não é uma aplicação médica, mas veja a engenharia de sistemas biológicos), a fabricação de insulina humana sintética por meio do uso de bactérias modificadas, a fabricação de eritropoetina em células de ovário de hamster, e a produção de novos tipos de camundongos experimentais, como o oncomouse (camundongo canceroso), para pesquisa.
Engenharia neural
A engenharia neural (também conhecida como neuroengenharia) é uma disciplina que usa técnicas de engenharia para entender, reparar, substituir ou aprimorar sistemas neurais. Engenheiros neurais são exclusivamente qualificados para resolver problemas de design na interface de tecido neural vivo e construções não vivas.
Engenharia farmacêutica
A engenharia farmacêutica é uma ciência interdisciplinar que inclui engenharia de medicamentos, administração e direcionamento de novos medicamentos, tecnologia farmacêutica, operações unitárias de engenharia química e análise farmacêutica. Pode ser considerada como parte da farmácia devido ao seu foco no uso da tecnologia de agentes químicos para o melhor tratamento medicamentoso.
Dispositivos hospitalares e médicos
Esta é uma categoria extremamente ampla — abrangendo essencialmente todos os produtos de saúde que não atingem os resultados pretendidos por meios predominantemente químicos (por exemplo, produtos farmacêuticos) ou biológicos (por exemplo, vacinas) e não envolvem o metabolismo.
Um dispositivo médico destina-se a ser utilizado em:
- o diagnóstico de doença ou outras condições
- na cura, mitigação, tratamento ou prevenção da doença.
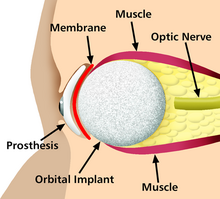
Alguns exemplos incluem marca-passos, bombas de infusão, máquina coração-pulmão, máquinas de diálise, órgãos artificiais, implantes, membros artificiais, lentes corretivas, implantes cocleares, próteses oculares, próteses faciais, próteses somáticas e implantes dentários.
A estereolitografia é um exemplo prático de modelagem médica sendo usada para criar objetos físicos. Além da modelagem de órgãos e do corpo humano, as técnicas emergentes de engenharia também são utilizadas atualmente na pesquisa e desenvolvimento de novos dispositivos para terapias inovadoras, tratamentos, monitoramento de pacientes, de doenças complexas.
Os dispositivos médicos são regulamentados e classificados (nos EUA) da seguinte forma (consulte também Regulamento):
- Os dispositivos de classe I apresentam um potencial mínimo para danos ao usuário e são muitas vezes mais simples em design do que dispositivos de classe II ou classe III. Os dispositivos desta categoria incluem depressores de língua, colchões, bandagens elásticas, luvas de exame e instrumentos cirúrgicos portáteis, e outros tipos semelhantes de equipamentos comuns.
- Os dispositivos Classe II estão sujeitos a controles especiais, além dos controles gerais dos dispositivos Classe I. Os controles especiais podem incluir requisitos especiais de rotulagem, padrões de desempenho obrigatórios e vigilância pós-mercado. Os dispositivos nesta classe são tipicamente não invasivos e incluem máquinas de raio-X, PACS, cadeiras de rodas elétricas, bombas de infusão e cortinas cirúrgicas.
- Os dispositivos de classe III geralmente requerem aprovação do pré-mercado (PMA) ou notificação pré-mercado (510k), uma revisão científica para garantir a segurança e eficácia do dispositivo, além dos controles gerais da classe I. Exemplos incluem válvulas cardíacas de substituição, implantes articulares de quadril e joelho, implantes mamários de silicone, estimuladores cerebelares implantados, geradores de pulso de pacemaker implantáveis e implantes endossssssssssss e endosssssas.
Imagiologia médica
As imagens médicas/biomédicas são um importante segmento de dispositivos médicos. Esta área trata de permitir que os médicos, direta ou indiretamente, "visualizem" coisas não visíveis à vista (como devido ao seu tamanho e/ou localização). Isso pode envolver a utilização de ultrassom, magnetismo, UV, radiologia e outros meios.
Como alternativa, o equipamento guiado por navegação utiliza tecnologia de rastreamento eletromagnético, como a colocação de cateteres no cérebro ou sistemas de colocação de tubos de alimentação. Por exemplo, o ENvue da ENvizion Medical, um sistema de navegação eletromagnética para colocação de tubos de alimentação enteral. O sistema usa um gerador de campo externo e vários sensores EM passivos que permitem o dimensionamento da exibição para o contorno corporal do paciente e uma visualização em tempo real da localização e direção da ponta do tubo de alimentação, o que ajuda a equipe médica a garantir a correta colocação no trato GI.
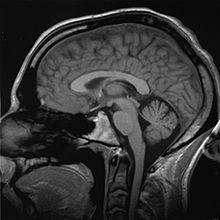
As tecnologias de imagem são muitas vezes essenciais para o diagnóstico médico e são normalmente o equipamento mais complexo encontrado em um hospital, incluindo: fluoroscopia, ressonância magnética (MRI), medicina nuclear, tomografia por emissão de pósitrons (PET), PET-CT, projeção radiografia, como raios-X e tomografia computadorizada, tomografia, ultra-som, microscopia óptica e microscopia eletrônica.
Implantes
Um implante é um tipo de dispositivo médico feito para substituir e atuar como uma estrutura biológica ausente (em comparação com um transplante, que indica tecido biomédico transplantado). A superfície dos implantes que entram em contato com o corpo pode ser feita de um material biomédico como titânio, silicone ou apatita, dependendo do que for mais funcional. Em alguns casos, os implantes contêm componentes eletrônicos, por exemplo. marca-passos artificiais e implantes cocleares. Alguns implantes são bioativos, como dispositivos subcutâneos de administração de medicamentos na forma de pílulas implantáveis ou stents farmacológicos.
Biônica
As substituições artificiais de partes do corpo são uma das muitas aplicações da biônica. Preocupada com o estudo intrincado e completo das propriedades e funções dos sistemas do corpo humano, a biônica pode ser aplicada para resolver alguns problemas de engenharia. O estudo cuidadoso das diferentes funções e processos dos olhos, ouvidos e outros órgãos abriu caminho para câmeras, televisões, transmissores e receptores de rádio aprimorados e muitas outras ferramentas.
Sensores biomédicos
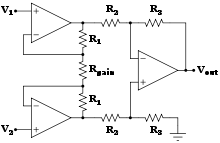
Nos últimos anos, os sensores biomédicos baseados na tecnologia de micro-ondas ganharam mais atenção. Diferentes sensores podem ser fabricados para usos específicos tanto no diagnóstico quanto no monitoramento de condições de doenças, por exemplo, sensores de micro-ondas podem ser usados como uma técnica complementar ao raio-X para monitorar traumas nas extremidades inferiores. O sensor monitora as propriedades dielétricas e pode, assim, perceber mudanças no tecido (osso, músculo, gordura, etc.) sob a pele, portanto, ao medir em momentos diferentes durante o processo de cicatrização, a resposta do sensor mudará conforme o trauma cicatriza.
Engenharia clínica
A engenharia clínica é o ramo da engenharia biomédica que lida com a implementação real de equipamentos e tecnologias médicas em hospitais ou outros ambientes clínicos. As principais funções dos engenheiros clínicos incluem treinar e supervisionar técnicos de equipamentos biomédicos (BMETs), selecionar produtos/serviços tecnológicos e gerenciar logisticamente sua implementação, trabalhar com reguladores governamentais em inspeções/auditorias e atuar como consultores tecnológicos para outros funcionários do hospital (por exemplo, médicos, administradores, T.I., etc.). Os engenheiros clínicos também aconselham e colaboram com os produtores de dispositivos médicos em relação a possíveis melhorias de design com base em experiências clínicas, bem como monitoram a progressão do estado da arte para redirecionar os padrões de aquisição de acordo.
Seu foco inerente na implementação prática da tecnologia tendeu a mantê-los mais orientados para redesenhos e reconfigurações de nível incremental, em oposição à pesquisa e pesquisa revolucionárias; desenvolvimento ou ideias que levariam muitos anos para serem adotadas clinicamente; no entanto, há um esforço crescente para expandir esse horizonte de tempo sobre o qual os engenheiros clínicos podem influenciar a trajetória da inovação biomédica. Em seus vários papéis, eles formam uma "ponte" entre os projetistas primários e os usuários finais, combinando as perspectivas de estarem ambos próximos ao ponto de uso, ao mesmo tempo em que são treinados em engenharia de produto e processo. Às vezes, os departamentos de engenharia clínica contratam não apenas engenheiros biomédicos, mas também engenheiros industriais/de sistemas para ajudar na pesquisa/otimização de operações, fatores humanos, análise de custos, etc. Além disso, consulte engenharia de segurança para uma discussão sobre os procedimentos usados para projetar sistemas seguros. O departamento de engenharia clínica é construído com um gerente, supervisor, engenheiro e técnico. Um engenheiro para cada oitenta leitos no hospital é a proporção. Os engenheiros clínicos também estão autorizados a auditar as lojas farmacêuticas e associadas para monitorar os recalls da FDA de itens invasivos.
Engenharia de reabilitação
Engenharia de reabilitação é a aplicação sistemática das ciências da engenharia para projetar, desenvolver, adaptar, testar, avaliar, aplicar e distribuir soluções tecnológicas para problemas enfrentados por pessoas com deficiência. As áreas funcionais abordadas pela engenharia de reabilitação podem incluir mobilidade, comunicação, audição, visão e cognição e atividades associadas ao emprego, vida independente, educação e integração na comunidade.
Embora alguns engenheiros de reabilitação tenham mestrado em engenharia de reabilitação, geralmente uma subespecialidade da engenharia biomédica, a maioria dos engenheiros de reabilitação possui graduação ou pós-graduação em engenharia biomédica, engenharia mecânica ou engenharia elétrica. Uma universidade portuguesa oferece uma licenciatura e um mestrado em Engenharia de Reabilitação e Acessibilidade. Qualificação para se tornar um Rehab' Engenheiro no Reino Unido é Instituto de Tecnologia, Universidade de Coventry.
O processo de reabilitação para pessoas com deficiência geralmente envolve o design de dispositivos auxiliares, como auxiliares de marcha, destinados a promover a inclusão de seus usuários na sociedade, no comércio e na recreação.
Problemas regulatórios
As questões regulatórias têm aumentado constantemente nas últimas décadas para responder aos muitos incidentes causados por dispositivos aos pacientes. Por exemplo, de 2008 a 2011, nos EUA, houve 119 recalls da FDA de dispositivos médicos classificados como classe I. De acordo com a Food and Drug Administration (FDA) dos EUA, o recall de Classe I está associado a "uma situação em é uma probabilidade razoável de que o uso ou a exposição a um produto cause consequências adversas graves à saúde ou morte"
Independente da legislação específica de cada país, os principais objetivos regulatórios coincidem mundialmente. Por exemplo, nos regulamentos de dispositivos médicos, um produto deve ser: 1) seguro e 2) eficaz e 3) para todos os dispositivos fabricados (por que esta parte foi excluída?)
Um produto é seguro se pacientes, usuários e terceiros não correm riscos inaceitáveis de perigos físicos (morte, lesões,...) em seu uso pretendido. Medidas de proteção devem ser introduzidas nos dispositivos para reduzir os riscos residuais a um nível aceitável se comparado com o benefício derivado do uso do mesmo.
Um produto é eficaz se funcionar conforme especificado pelo fabricante no uso pretendido. A eficácia é alcançada por meio de avaliação clínica, conformidade com padrões de desempenho ou demonstrações de equivalência substancial com um dispositivo já comercializado.
As características anteriores devem ser asseguradas para todos os itens fabricados do dispositivo médico. Isso exige que um sistema de qualidade esteja em vigor para todas as entidades e processos relevantes que possam afetar a segurança e a eficácia ao longo de todo o ciclo de vida do dispositivo médico.
A área de engenharia de dispositivos médicos está entre os campos de engenharia mais fortemente regulamentados, e os engenheiros biomédicos devem consultar e cooperar rotineiramente com advogados de leis regulatórias e outros especialistas. A Food and Drug Administration (FDA) é a principal autoridade reguladora da saúde nos Estados Unidos, com jurisdição sobre dispositivos médicos, medicamentos, produtos biológicos e produtos combinados. Os objetivos primordiais que orientam as decisões políticas do FDA são a segurança e a eficácia dos produtos de saúde que devem ser assegurados por meio de um sistema de qualidade em vigor, conforme especificado no regulamento 21 CFR 829. Além disso, como os engenheiros biomédicos geralmente desenvolvem dispositivos e tecnologias para "consumidores" uso, como dispositivos de fisioterapia (que também são dispositivos "médicos"), eles também podem ser regidos em alguns aspectos pela Consumer Product Safety Commission. Os maiores obstáculos tendem a ser 510K "clearance" (normalmente para dispositivos de Classe 2) ou "aprovação" (normalmente para drogas e dispositivos de classe 3).
No contexto europeu, a eficácia e a qualidade da segurança são garantidas através da "Avaliação da Conformidade" que é definido como "o método pelo qual um fabricante demonstra que seu dispositivo está em conformidade com os requisitos da Diretiva Europeia de Dispositivos Médicos". A diretiva especifica diferentes procedimentos de acordo com a classe do dispositivo, desde a simples Declaração de Conformidade (Anexo VII) para dispositivos Classe I até a verificação CE (Anexo IV), Garantia de qualidade da produção (Anexo V), Garantia de qualidade do produto (Anexo VI) e Garantia de qualidade total (Anexo II). A Diretiva de Dispositivos Médicos especifica procedimentos detalhados para Certificação. Em linhas gerais, esses procedimentos incluem testes e verificações que devem constar em entregas específicas, como o arquivo de gerenciamento de riscos, o arquivo técnico e as entregas do sistema de qualidade. O arquivo de gerenciamento de risco é a primeira entrega que condiciona as etapas seguintes de projeto e fabricação. A etapa de gerenciamento de riscos deve conduzir o produto para que os riscos do produto sejam reduzidos a um nível aceitável em relação aos benefícios esperados para os pacientes pelo uso do dispositivo. O arquivo técnico contém todos os dados de documentação e registros que suportam a certificação do dispositivo médico. O arquivo técnico da FDA tem conteúdo semelhante, embora organizado em uma estrutura diferente. As entregas do Sistema de Qualidade geralmente incluem procedimentos que garantem a qualidade ao longo de todos os ciclos de vida do produto. O mesmo padrão (ISO EN 13485) é geralmente aplicado para sistemas de gerenciamento de qualidade nos EUA e no mundo.
Na União Europeia, existem entidades certificadoras denominadas "Organismos Notificados", acreditadas pelos Estados-membros europeus. Os Organismos Notificados devem garantir a eficácia do processo de certificação para todos os dispositivos médicos, exceto os dispositivos de classe I, em que uma declaração de conformidade produzida pelo fabricante é suficiente para comercialização. Uma vez que um produto tenha passado por todas as etapas exigidas pela Diretiva de Dispositivos Médicos, o dispositivo tem o direito de ostentar a marcação CE, indicando que o dispositivo é considerado seguro e eficaz quando usado conforme pretendido e, portanto, pode ser comercializado dentro a área da União Europeia.
Os diferentes arranjos regulatórios às vezes resultam em tecnologias específicas sendo desenvolvidas primeiro para os EUA ou para a Europa, dependendo da forma mais favorável de regulamentação. Embora as nações muitas vezes se esforcem por uma harmonia substantiva para facilitar a distribuição internacional, as diferenças filosóficas sobre a extensão ideal da regulamentação podem ser um obstáculo; regulamentos mais restritivos parecem atraentes em um nível intuitivo, mas os críticos denunciam o custo de compensação em termos de retardar o acesso a desenvolvimentos que salvam vidas.
RoHS II
A Diretiva 2011/65/UE, mais conhecida como RoHS 2, é uma reformulação da legislação originalmente introduzida em 2002. A legislação original da UE "Restrições de certas substâncias perigosas em dispositivos elétricos e eletrônicos" (Diretiva RoHS 2002/95/EC) foi substituída e substituída pela 2011/65/EU publicada em julho de 2011 e comumente conhecida como RoHS 2. A RoHS busca limitar as substâncias perigosas em circulação em produtos eletrônicos, em particular toxinas e metais pesados, que posteriormente são liberados no meio ambiente quando tais dispositivos são reciclados.
O escopo da RoHS 2 é ampliado para incluir produtos anteriormente excluídos, como dispositivos médicos e equipamentos industriais. Além disso, os fabricantes agora são obrigados a fornecer avaliações de risco de conformidade e relatórios de teste – ou explicar por que eles estão faltando. Pela primeira vez, não apenas os fabricantes, mas também os importadores e distribuidores compartilham a responsabilidade de garantir que os equipamentos elétricos e eletrônicos dentro do escopo da RoHS estejam em conformidade com os limites de substâncias perigosas e tenham uma marca CE em seus produtos.
IEC 60601
O novo padrão internacional IEC 60601 para dispositivos eletromédicos de assistência médica domiciliar que define os requisitos para dispositivos usados no ambiente de assistência médica domiciliar. A IEC 60601-1-11 (2010) agora deve ser incorporada ao projeto e verificação de uma ampla gama de dispositivos médicos de uso doméstico e de ponto de atendimento, juntamente com outras normas aplicáveis na série IEC 60601 3ª edição.
A data obrigatória para implementação da versão europeia EN do padrão é 1º de junho de 2013. O FDA dos EUA exige o uso do padrão em 30 de junho de 2013, enquanto a Health Canada recentemente estendeu a data exigida de junho de 2012 a abril 2013. As agências norte-americanas exigirão esses padrões apenas para novos envios de dispositivos, enquanto a UE adotará a abordagem mais severa de exigir que todos os dispositivos aplicáveis colocados no mercado considerem o padrão de assistência médica domiciliar.
AS/NZS 3551:2012
AS/ANS 3551:2012 é o padrão australiano e neozelandês para o gerenciamento de dispositivos médicos. A norma especifica os procedimentos necessários para manter uma ampla gama de ativos médicos em um ambiente clínico (por exemplo, Hospital). Os padrões são baseados nos padrões IEC 606101.
O padrão abrange uma ampla gama de elementos de gerenciamento de equipamentos médicos, incluindo aquisição, teste de aceitação, manutenção (teste de segurança elétrica e manutenção preventiva) e descomissionamento.
Treinamento e certificação
Educação
Os engenheiros biomédicos exigem um conhecimento considerável de engenharia e biologia e, normalmente, têm um bacharelado (B.Sc., B.S., B.Eng. ou B.S.E.) ou mestrado (M.S., M.Sc., M.S.E. ou M.Eng.) ou um doutorado (Ph.D. ou MD-PhD) em BME (Engenharia Biomédica) ou outro ramo da engenharia com potencial considerável para sobreposição de BME. À medida que o interesse no BME aumenta, muitas faculdades de engenharia agora têm um Departamento ou Programa de Engenharia Biomédica, com ofertas que vão desde a graduação (B.Sc., B.S., B.Eng. ou B.S.E.) até os níveis de doutorado. A engenharia biomédica só recentemente emergiu como uma disciplina própria, em vez de uma especialização híbrida interdisciplinar de outras disciplinas; e os programas BME em todos os níveis estão se tornando mais difundidos, incluindo o Bacharelado em Engenharia Biomédica, que inclui conteúdo de ciências biológicas suficiente para que muitos alunos o usem como um curso "pré-medicina" major em preparação para a faculdade de medicina. Espera-se que o número de engenheiros biomédicos aumente como causa e efeito das melhorias na tecnologia médica.
Nos EUA, um número crescente de programas de graduação também está sendo reconhecido pela ABET como programas credenciados de bioengenharia/engenharia biomédica. A partir de 2023, 155 programas são atualmente credenciados pela ABET.
No Canadá e na Austrália, programas de pós-graduação credenciados em engenharia biomédica são comuns. Por exemplo, a McMaster University oferece um M.A.Sc, um MD/PhD e um PhD em engenharia biomédica. O primeiro programa BME de graduação canadense foi oferecido na Ryerson University como B.Eng de quatro anos. programa. A Polytechnique em Montreal também oferece um diploma de bacharel em engenharia biomédica, assim como a Flinders University.
Como acontece com muitos diplomas, a reputação e a classificação de um programa podem influenciar a conveniência de um titular de diploma para emprego ou admissão de pós-graduação. A reputação de muitos cursos de graduação também está ligada aos programas de pós-graduação ou pesquisa da instituição, que possuem alguns fatores tangíveis para classificação, como financiamento e volume de pesquisa, publicações e citações. Especificamente com o BME, a classificação de um hospital universitário e escola de medicina também pode ser um fator significativo no prestígio percebido de seu departamento/programa de BME.
A pós-graduação é um aspecto particularmente importante no BME. Embora muitos campos de engenharia (como engenharia mecânica ou elétrica) não precisem de treinamento em nível de pós-graduação para obter um emprego básico em seu campo, a maioria dos cargos de BME os prefere ou até os exige. Como a maioria das profissões relacionadas ao BME envolve pesquisa científica, como no desenvolvimento de dispositivos médicos e farmacêuticos, a pós-graduação é quase uma exigência (já que os cursos de graduação geralmente não envolvem treinamento e experiência em pesquisa suficientes). Este pode ser um grau de mestrado ou doutorado; enquanto em certas especialidades um Ph.D. é notavelmente mais comum do que em outros, dificilmente é a maioria (exceto na academia). Na verdade, a necessidade percebida de algum tipo de credencial de pós-graduação é tão forte que alguns programas de graduação em BME desencorajam ativamente os alunos de se especializar em BME sem uma intenção expressa de também obter um mestrado ou se inscrever posteriormente na faculdade de medicina.
Os programas de pós-graduação em BME, como em outras áreas científicas, são muito variados, e programas particulares podem enfatizar certos aspectos dentro do campo. Eles também podem apresentar extensos esforços de colaboração com programas em outras áreas (como a Faculdade de Medicina da universidade ou outras divisões de engenharia), novamente devido à natureza interdisciplinar do BME. EM. e Ph.D. os programas geralmente exigem que os candidatos tenham um diploma de graduação em BME, ou outra disciplina de engenharia (mais alguns cursos de ciências da vida) ou ciências da vida (mais alguns cursos de engenharia).
A educação em BME também varia muito em todo o mundo. Em virtude de seu extenso setor de biotecnologia, suas numerosas universidades importantes e relativamente poucas barreiras internas, os EUA progrediram muito no desenvolvimento de oportunidades de educação e treinamento em BME. A Europa, que também tem um grande setor de biotecnologia e um impressionante sistema educacional, encontrou problemas para criar padrões uniformes enquanto a comunidade européia tenta suplantar algumas das barreiras jurisdicionais nacionais que ainda existem. Recentemente, surgiram iniciativas como a BIOMEDEA para desenvolver padrões educacionais e profissionais relacionados à BME. Outros países, como a Austrália, estão reconhecendo e agindo para corrigir as deficiências em sua educação BME. Além disso, como empreendimentos de alta tecnologia são geralmente marcas de nações desenvolvidas, algumas áreas do mundo são propensas a um desenvolvimento mais lento na educação, inclusive no BME.
Licenciamento/certificação
Tal como acontece com outras profissões aprendidas, cada estado tem certos requisitos (bastante semelhantes) para obter a licença como Engenheiro Profissional (PE) registrado, mas, nos EUA, na indústria, essa licença não é necessária para ser um funcionário como engenheiro na maioria das situações (devido a uma exceção conhecida como isenção industrial, que efetivamente se aplica à grande maioria dos engenheiros americanos). O modelo dos EUA geralmente exige apenas que os engenheiros praticantes que oferecem serviços de engenharia que afetam o bem-estar público, a segurança, a proteção da vida, da saúde ou da propriedade sejam licenciados, enquanto os engenheiros que trabalham no setor privado sem uma oferta direta de serviços de engenharia ao negócios públicos ou outros, educação e governo não precisam ser licenciados. Notavelmente, esse não é o caso em muitos outros países, onde uma licença é tão legalmente necessária para praticar engenharia quanto para direito ou medicina.
A engenharia biomédica é regulamentada em alguns países, como a Austrália, mas o registro normalmente é apenas recomendado e não obrigatório.
No Reino Unido, os engenheiros mecânicos que trabalham nas áreas de Engenharia Médica, Bioengenharia ou Engenharia Biomédica podem obter o status de Chartered Engineer através do Institution of Mechanical Engineers. A Instituição também mantém a Divisão de Engenharia em Medicina e Saúde. O Instituto de Física e Engenharia de Medicina (IPEM) tem um júri para a acreditação dos cursos de Mestrado em Engenharia Biomédica e o estatuto de Engenheiro Licenciado também pode ser solicitado através do IPEM.
O exame Fundamentals of Engineering – o primeiro (e mais geral) de dois exames de licenciamento para a maioria das jurisdições dos EUA – agora cobre biologia (embora tecnicamente não seja BME). Para o segundo exame, denominado Princípios e Práticas, Parte 2, ou exame de Engenharia Profissional, os candidatos podem selecionar o conteúdo de uma disciplina de engenharia específica a ser testada; atualmente não há uma opção para BME com isso, o que significa que qualquer engenheiro biomédico que busca uma licença deve se preparar para fazer esse exame em outra categoria (o que não afeta a licença real, já que a maioria das jurisdições não reconhece especialidades disciplinares de qualquer maneira). No entanto, a Biomedical Engineering Society (BMES) está, a partir de 2009, explorando a possibilidade de tentar implementar uma versão específica para BME deste exame para facilitar a obtenção de licenciamento por engenheiros biomédicos.
Além do registro governamental, certas organizações profissionais/industriais do setor privado também oferecem certificações com graus variados de proeminência. Um exemplo é a certificação Certified Clinical Engineer (CCE) para engenheiros clínicos.
Perspectivas de carreira
Em 2012, havia cerca de 19.400 engenheiros biomédicos empregados nos EUA, e a previsão era de que o campo cresceria 5% (mais rápido que a média) de 2012 a 2022. A engenharia biomédica tem a maior porcentagem de engenheiras em comparação com outras engenharias comuns profissões.
Figuras notáveis
- Julia Tutelman Apter (deceased) - Um dos primeiros especialistas em pesquisa neurofisiológica e um membro fundador da Biomedical Engineering Society
- Earl Bakken (deceased) – Inventou o primeiro pacemaker transistorised, co-fundador da Medtronic.
- Forrest Bird (deceased) – aviador e pioneiro na invenção de ventiladores mecânicos
- Y.C. Fung (deceased) – professor emérito da Universidade da Califórnia, San Diego, considerado por muitos como o fundador da biomecânica moderna
- Leslie Geddes (deceased) – professor emérito da Universidade Purdue, engenheiro elétrico, inventor e educador de mais de 2000 engenheiros biomédicos, recebeu uma Medalha Nacional de Tecnologia em 2006 do presidente George Bush por seus mais de 50 anos de contribuições que geraram inovações que vão desde tratamentos de queimaduras a desfibriladores miniaturas, reparação de ligamentos a pequenos monitores de pressão arterial para bebês prematuros, bem como um método de transplante.
- Willem Johan Kolff (deceased) – pioneiro da hemodiálise, bem como no campo dos órgãos artificiais
- Robert Langer – Professor do Instituto no MIT, dirige o maior laboratório de BME do mundo, pioneiro na entrega de drogas e engenharia de tecidos
- John Macleod (deceased) – um dos co-descobridores da insulina na Case Western Reserve University.
- Alfred E. Mann – Médico, empreendedor e filantropo. Um pioneiro no campo da Engenharia Biomédica.
- J. Thomas Mortimer – Professor emérito de engenharia biomédica na Case Western Reserve University. Pioneira em Estimulação Elétrica Funcional (FES)
- Robert M. Nerem – professor emérito do Instituto de Tecnologia da Geórgia. Pioneira em tecido regenerativo, biomecânica e autor de mais de 300 obras publicadas. Suas obras foram citadas mais de 20.000 vezes cumulativamente.
- P. Hunter Peckham – Professor Donnell de Engenharia Biomédica e Ortopédica da Case Western Reserve University. Pioneira em Estimulação Elétrica Funcional (FES)
- Nicholas A. Peppas – Professor Presidente em Engenharia da Universidade do Texas em Austin, pioneiro na entrega de drogas, biomateriais, hidrogels e nanobiotecnologia.
- Robert Plonsey – professor emérito da Universidade Duke, pioneiro da eletrofisiologia
- Otto Schmitt (deceased) – biofísico com contribuições significativas para a BME, trabalhando com biomimética
- Ascher Shapiro (deceased) – Professor do Instituto no MIT, contribuiu para o desenvolvimento do campo BME, dispositivos médicos (por exemplo, balões intra-aórticos)
- Gordana Vunjak-Novakovic – Professor Universitário da Universidade Columbia, pioneiro em engenharia de tecidos e design de biorreator
- John G. Webster – professor emérito da Universidade de Wisconsin-Madison, pioneiro no campo dos amplificadores de instrumentação para a gravação de sinais eletrofisiológicos
- Fred Weibell, coautor de Instrumentação e Medições Biomédicas
- U.A. Whitaker (deceased) - provedor da Fundação Whitaker, que apoiou a pesquisa e educação em BME, fornecendo mais de US $ 700 milhões para várias universidades, ajudando a criar 30 programas BME e ajudando a financiar a construção de 13 edifícios
Contenido relacionado
Achduart
Telecomunicações na Estônia
Ancyra (planthopper)