Elemento químico
Um elemento químico é uma substância química que não pode ser decomposta em outras substâncias. A partícula básica que constitui um elemento químico é o átomo, e os elementos químicos se distinguem entre si pelo número de prótons nos núcleos de seus átomos. Isso está em contraste com compostos e misturas químicas.
Quase toda a matéria bariônica do universo é composta por elementos químicos (entre as raras exceções estão as estrelas de nêutrons). Quando diferentes elementos sofrem reações químicas, os átomos são rearranjados em novos compostos mantidos juntos por ligações químicas. Apenas uma minoria de elementos, como prata e ouro, são encontrados não combinados como elementos minerais nativos relativamente puros. Quase todos os outros elementos naturais ocorrem na Terra como compostos ou misturas. O ar é principalmente uma mistura dos elementos nitrogênio, oxigênio e argônio, embora contenha compostos como dióxido de carbono e água.
A história da descoberta e uso dos elementos começou com sociedades humanas primitivas que descobriram minerais nativos como carbono, enxofre, cobre e ouro (embora o conceito de elemento químico ainda não fosse compreendido). As tentativas de classificar materiais como esses resultaram nos conceitos de elementos clássicos, alquimia e várias teorias semelhantes ao longo da história humana. Grande parte da compreensão moderna dos elementos desenvolveu-se a partir do trabalho de Dmitri Mendeleev, um químico russo que publicou a primeira tabela periódica reconhecível em 1869. Esta tabela organiza os elementos aumentando o número atômico em linhas ("períodos") em quais as colunas ("grupos") compartilham propriedades físicas e químicas recorrentes ("periódicas"). A tabela periódica resume várias propriedades dos elementos, permitindo aos químicos derivar relações entre eles e fazer previsões sobre compostos e potenciais novos.
Em novembro de 2016, a União Internacional de Química Pura e Aplicada reconheceu um total de 118 elementos. Os primeiros 94 ocorrem naturalmente na Terra e os 24 restantes são elementos sintéticos produzidos em reações nucleares. Com exceção dos elementos radioativos instáveis (radionuclídeos) que decaem rapidamente, quase todos os elementos estão disponíveis industrialmente em quantidades variáveis. A descoberta e síntese de outros novos elementos é uma área contínua de estudo científico.
Descrição
Os elementos químicos mais leves são o hidrogênio e o hélio, ambos criados pela nucleossíntese do Big Bang durante os primeiros 20 minutos do universo em uma proporção de cerca de 3:1 em massa (ou 12:1 em número de átomos), juntamente com minúsculos vestígios dos próximos dois elementos, lítio e berílio. Quase todos os outros elementos encontrados na natureza foram produzidos por vários métodos naturais de nucleossíntese. Na Terra, pequenas quantidades de novos átomos são produzidas naturalmente em reações nucleogênicas ou em processos cosmogênicos, como a espalação de raios cósmicos. Novos átomos também são produzidos naturalmente na Terra como isótopos filhos radiogênicos de processos de decaimento radioativo em andamento, como decaimento alfa, decaimento beta, fissão espontânea, decaimento de aglomerado e outros modos mais raros de decaimento.
Dos 94 elementos que ocorrem naturalmente, aqueles com números atômicos de 1 a 82 têm cada um pelo menos um isótopo estável (exceto tecnécio, elemento 43 e promécio, elemento 61, que não possuem isótopos estáveis). Isótopos considerados estáveis são aqueles para os quais ainda não foi observado decaimento radioativo. Elementos com números atômicos de 83 a 94 são instáveis a ponto de detectar o decaimento radioativo de todos os isótopos. Alguns desses elementos, principalmente o bismuto (número atômico 83), tório (número atômico 90) e urânio (número atômico 92), têm um ou mais isótopos com meias-vidas longas o suficiente para sobreviver como remanescentes da explosiva nucleossíntese estelar que produziu os metais pesados antes da formação do nosso Sistema Solar. Acima de 1,9×10 19 anos, mais de um bilhão de vezes mais do que a idade atual estimada do universo, o bismuto-209 (número atômico 83) tem a meia-vida de decaimento alfa mais longa conhecida de qualquer elemento natural e é quase sempre considerados a par dos 80 elementos estáveis. Os elementos mais pesados (aqueles além do plutônio, elemento 94) sofrem decaimento radioativo com meias-vidas tão curtas que não são encontrados na natureza e devem ser sintetizados.
Existem agora 118 elementos conhecidos. Neste contexto, "conhecido" meios observados suficientemente bem, mesmo a partir de apenas alguns produtos de decomposição, para serem diferenciados de outros elementos. Mais recentemente, a síntese do elemento 118 (desde então denominado oganesson) foi relatada em outubro de 2006, e a síntese do elemento 117 (tennessine) foi relatada em abril de 2010. Desses 118 elementos, 94 ocorrem naturalmente na Terra. Seis deles ocorrem em quantidades residuais extremas: tecnécio, número atômico 43; promécio, número 61; astatine, número 85; frâncio, número 87; netúnio, número 93; e plutônio, número 94. Esses 94 elementos foram detectados no universo como um todo, nos espectros de estrelas e também em supernovas, onde elementos radioativos de vida curta estão sendo produzidos. Os primeiros 94 elementos foram detectados diretamente na Terra como nuclídeos primordiais presentes na formação do Sistema Solar, ou como produtos naturais de fissão ou transmutação de urânio e tório.
Os restantes 24 elementos mais pesados, não encontrados hoje nem na Terra nem nos espectros astronômicos, foram produzidos artificialmente: são todos radioativos, com meias-vidas muito curtas; se quaisquer átomos desses elementos estiveram presentes na formação da Terra, é extremamente provável que já tenham decaído, e se presentes em novas foram em quantidades muito pequenas para serem notadas. O tecnécio foi o primeiro elemento supostamente não natural sintetizado, em 1937, embora vestígios de tecnécio tenham sido encontrados na natureza desde então (e também o elemento pode ter sido descoberto naturalmente em 1925). Este padrão de produção artificial e posterior descoberta natural foi repetido com vários outros elementos radioativos raros que ocorrem naturalmente.
A lista dos elementos está disponível por nome, número atômico, densidade, ponto de fusão, ponto de ebulição e por símbolo, bem como as energias de ionização dos elementos. Os nuclídeos de elementos estáveis e radioativos também estão disponíveis como uma lista de nuclídeos, classificados por comprimento de meia-vida para aqueles que são instáveis. Uma das formas mais convenientes e certamente a mais tradicional de apresentação dos elementos é a tabela periódica, que agrupa elementos com propriedades químicas semelhantes (e geralmente também estruturas eletrônicas semelhantes).
Número atômico
O número atômico de um elemento é igual ao número de prótons em cada átomo e define o elemento. Por exemplo, todos os átomos de carbono contêm 6 prótons em seu núcleo atômico; então o número atômico do carbono é 6. Os átomos de carbono podem ter diferentes números de nêutrons; átomos do mesmo elemento com diferentes números de nêutrons são conhecidos como isótopos do elemento.
O número de prótons no núcleo atômico também determina sua carga elétrica, que por sua vez determina o número de elétrons do átomo em seu estado não ionizado. Os elétrons são colocados em orbitais atômicos que determinam as várias propriedades químicas do átomo. O número de nêutrons em um núcleo geralmente tem muito pouco efeito nas propriedades químicas de um elemento (exceto no caso de hidrogênio e deutério). Assim, todos os isótopos de carbono têm propriedades químicas quase idênticas porque todos têm seis prótons e seis elétrons, embora os átomos de carbono possam, por exemplo, ter 6 ou 8 nêutrons. É por isso que o número atômico, em vez do número de massa ou peso atômico, é considerado a característica identificadora de um elemento químico.
O símbolo do número atômico é Z.
Isótopos
Isótopos são átomos do mesmo elemento (isto é, com o mesmo número de prótons em seu núcleo atômico), mas com números diferentes de nêutrons. Assim, por exemplo, existem três isótopos principais de carbono. Todos os átomos de carbono têm 6 prótons no núcleo, mas podem ter 6, 7 ou 8 nêutrons. Como os números de massa são 12, 13 e 14, respectivamente, os três isótopos de carbono são conhecidos como carbono-12, carbono-13 e carbono-14, geralmente abreviados para 12C, 13C e 14C. O carbono na vida cotidiana e na química é uma mistura de 12C (cerca de 98,9%), 13C (cerca de 1,1%) e cerca de 1 átomo por trilhão de 14C.
A maioria (66 de 94) dos elementos naturais tem mais de um isótopo estável. Com exceção dos isótopos de hidrogênio (que diferem muito uns dos outros em massa relativa - o suficiente para causar efeitos químicos), os isótopos de um determinado elemento são quimicamente quase indistinguíveis.
Todos os elementos possuem alguns isótopos que são radioativos (radioisótopos), embora nem todos esses radioisótopos ocorram naturalmente. Os radioisótopos normalmente decaem em outros elementos ao irradiar uma partícula alfa ou beta. Se um elemento possui isótopos que não são radioativos, eles são denominados "estáveis" isótopos. Todos os isótopos estáveis conhecidos ocorrem naturalmente (ver isótopo primordial). Os muitos radioisótopos que não são encontrados na natureza foram caracterizados após serem produzidos artificialmente. Certos elementos não possuem isótopos estáveis e são compostos apenas de isótopos radioativos: especificamente os elementos sem quaisquer isótopos estáveis são tecnécio (número atômico 43), promécio (número atômico 61) e todos os elementos observados com números atômicos superior a 82.
Dos 80 elementos com pelo menos um isótopo estável, 26 têm apenas um único isótopo estável. O número médio de isótopos estáveis para os 80 elementos estáveis é de 3,1 isótopos estáveis por elemento. O maior número de isótopos estáveis que ocorrem para um único elemento é 10 (para estanho, elemento 50).
Massa isotópica e massa atômica
O número de massa de um elemento, A, é o número de núcleons (prótons e nêutrons) no núcleo atômico. Diferentes isótopos de um determinado elemento são distinguidos por seus números de massa, que são convencionalmente escritos como um sobrescrito no lado esquerdo do símbolo atômico (por exemplo, 238U). O número de massa é sempre um número inteiro e possui unidades de "nucleons". Por exemplo, magnésio-24 (24 é o número de massa) é um átomo com 24 núcleos (12 prótons e 12 nêutrons).
Enquanto o número de massa simplesmente conta o número total de nêutrons e prótons e é, portanto, um número natural (ou inteiro), a massa atômica de um único átomo é um número real que dá a massa de um isótopo particular (ou "nuclídeo") do elemento, expresso em unidades de massa atômica (símbolo: u). Em geral, o número de massa de um determinado nuclídeo difere ligeiramente em valor de sua massa atômica, uma vez que a massa de cada próton e nêutron não é exatamente 1 u; uma vez que os elétrons contribuem com uma parcela menor para a massa atômica quando o número de nêutrons excede o número de prótons; e (finalmente) por causa da energia de ligação nuclear. Por exemplo, a massa atômica do cloro-35 com cinco dígitos significativos é 34,969 u e a do cloro-37 é 36,966 u. No entanto, a massa atômica em u de cada isótopo é bastante próxima de seu número de massa simples (sempre dentro de 1%). O único isótopo cuja massa atômica é exatamente um número natural é 12C, que por definição tem uma massa de exatamente 12 porque u é definido como 1/12 da massa de um átomo livre de carbono-12 neutro no estado fundamental.
O peso atômico padrão (comumente chamado de "peso atômico") de um elemento é a média das massas atômicas de todos os isótopos do elemento químico conforme encontrado em um ambiente particular, ponderado pela abundância isotópica, em relação à unidade de massa atômica. Este número pode ser uma fração que não é próxima de um número inteiro. Por exemplo, a massa atômica relativa do cloro é 35,453 u, que difere muito de um número inteiro, pois é uma média de cerca de 76% de cloro-35 e 24% de cloro-37. Sempre que um valor de massa atômica relativa difere em mais de 1% de um número inteiro, é devido a esse efeito de média, pois quantidades significativas de mais de um isótopo estão naturalmente presentes em uma amostra desse elemento.
Quimicamente puro e isotopicamente puro
Químicos e cientistas nucleares têm diferentes definições de um elemento puro. Em química, um elemento puro significa uma substância cujos átomos todos (ou na prática quase todos) têm o mesmo número atômico ou número de prótons. Os cientistas nucleares, no entanto, definem um elemento puro como aquele que consiste em apenas um isótopo estável.
Por exemplo, um fio de cobre é 99,99% quimicamente puro se 99,99% de seus átomos são de cobre, com 29 prótons cada. No entanto, não é isotopicamente puro, pois o cobre comum consiste em dois isótopos estáveis, 69% 63Cu e 31% 65Cu, com diferentes números de nêutrons. No entanto, um lingote de ouro puro seria quimicamente e isotopicamente puro, uma vez que o ouro comum consiste apenas em um isótopo, 197Au.
Alótropos
Os átomos de elementos quimicamente puros podem se ligar uns aos outros quimicamente de mais de uma maneira, permitindo que o elemento puro exista em múltiplas estruturas químicas (arranjos espaciais de átomos), conhecidas como alótropos, que diferem em suas propriedades. Por exemplo, o carbono pode ser encontrado na forma de diamante, que possui uma estrutura tetraédrica ao redor de cada átomo de carbono; o grafite, que possui camadas de átomos de carbono com estrutura hexagonal empilhadas umas sobre as outras; grafeno, que é uma única camada de grafite muito forte; os fulerenos, que têm formas quase esféricas; e os nanotubos de carbono, que são tubos com estrutura hexagonal (mesmo estes podem diferir entre si nas propriedades elétricas). A capacidade de um elemento existir em uma das muitas formas estruturais é conhecida como 'alotropia'.
O estado de referência de um elemento é definido por convenção, geralmente como o alótropo termodinamicamente mais estável e o estado físico a uma pressão de 1 bar e uma determinada temperatura (normalmente a 298,15 K). No entanto, para o fósforo, o estado de referência é o fósforo branco, embora não seja o alótropo mais estável. Em termoquímica, um elemento é definido para ter uma entalpia de formação de zero em seu estado de referência. Por exemplo, o estado de referência para o carbono é o grafite, porque a estrutura do grafite é mais estável que a dos outros alótropos.
Propriedades
Vários tipos de categorizações descritivas podem ser amplamente aplicadas aos elementos, incluindo a consideração de suas propriedades físicas e químicas gerais, seus estados da matéria sob condições familiares, seus pontos de fusão e ebulição, suas densidades, suas estruturas cristalinas como sólidos e suas origens.
Propriedades gerais
Vários termos são comumente usados para caracterizar as propriedades físicas e químicas gerais dos elementos químicos. Uma primeira distinção é entre metais, que prontamente conduzem eletricidade, não-metais, que não o fazem, e um pequeno grupo, (os metalóides), possuindo propriedades intermediárias e muitas vezes se comportando como semicondutores.
Uma classificação mais refinada geralmente é mostrada em apresentações coloridas da tabela periódica. Este sistema restringe os termos "metal" e "não-metal" para apenas alguns dos metais e não-metais mais amplamente definidos, acrescentando termos adicionais para certos conjuntos de metais e não-metais vistos de forma mais ampla. A versão desta classificação utilizada nas tabelas periódicas aqui apresentadas inclui: actinídeos, metais alcalinos, metais alcalino-terrosos, halogênios, lantanídeos, metais de transição, metais pós-transição, metalóides, não-metais reativos e gases nobres. Neste sistema, os metais alcalinos, metais alcalino-terrosos e metais de transição, bem como os lantanídeos e os actinídeos, são grupos especiais dos metais vistos em um sentido mais amplo. Da mesma forma, os não-metais reativos e os gases nobres são não-metais vistos no sentido mais amplo. Em algumas apresentações, os halogênios não são distinguidos, com astatine identificado como um metalóide e os outros identificados como não-metais.
Estados da matéria
Outra distinção básica comumente usada entre os elementos é o estado da matéria (fase), seja sólido, líquido ou gasoso, em uma temperatura e pressão padrão selecionada (STP). A maioria dos elementos são sólidos em temperaturas convencionais e pressão atmosférica, enquanto vários são gases. Apenas o bromo e o mercúrio são líquidos a 0 graus Celsius (32 graus Fahrenheit) e à pressão atmosférica normal; césio e gálio são sólidos a essa temperatura, mas fundem a 28,4 °C (83,2 °F) e 29,8 °C (85,6 °F), respectivamente.
Pontos de fusão e ebulição
Os pontos de fusão e ebulição, normalmente expressos em graus Celsius à pressão de uma atmosfera, são comumente usados na caracterização dos vários elementos. Embora conhecido para a maioria dos elementos, uma ou ambas as medições ainda são indeterminadas para alguns dos elementos radioativos disponíveis apenas em pequenas quantidades. Como o hélio permanece líquido mesmo no zero absoluto à pressão atmosférica, ele tem apenas um ponto de ebulição, e não um ponto de fusão, nas apresentações convencionais.
Densidades
A densidade na temperatura e pressão padrão selecionada (STP) é freqüentemente usada na caracterização dos elementos. A densidade geralmente é expressa em gramas por centímetro cúbico (g/cm3). Uma vez que vários elementos são gases em temperaturas comumente encontradas, suas densidades são geralmente indicadas para suas formas gasosas; quando liquefeitos ou solidificados, os elementos gasosos têm densidades semelhantes às dos outros elementos.
Quando um elemento tem alótropos com densidades diferentes, um alótropo representativo é normalmente selecionado em apresentações resumidas, enquanto as densidades para cada alótropo podem ser indicadas onde mais detalhes são fornecidos. Por exemplo, os três alótropos familiares de carbono (carbono amorfo, grafite e diamante) têm densidades de 1,8–2,1, 2,267 e 3,515 g/cm3, respectivamente.
Estruturas cristalinas
Os elementos estudados até agora como amostras sólidas têm oito tipos de estruturas cristalinas: cúbica, cúbica de corpo centrado, cúbica de face centrada, hexagonal, monoclínica, ortorrômbica, romboédrica e tetragonal. Para alguns dos elementos transurânicos produzidos sinteticamente, as amostras disponíveis eram muito pequenas para determinar as estruturas cristalinas.
Ocorrência e origem na Terra
Elementos químicos também podem ser categorizados por sua origem na Terra, com os primeiros 94 considerados naturais, enquanto aqueles com números atômicos acima de 94 foram produzidos apenas artificialmente como produtos sintéticos de reações nucleares feitas pelo homem.
Dos 94 elementos que ocorrem naturalmente, 83 são considerados primordiais e estáveis ou fracamente radioativos. Os 11 elementos que ocorrem naturalmente possuem meias-vidas muito curtas para estarem presentes no início do Sistema Solar e, portanto, são considerados elementos transitórios. Desses 11 elementos transitórios, 5 (polônio, radônio, rádio, actínio e protactínio) são produtos de decaimento relativamente comuns do tório e do urânio. Os 6 elementos transitórios restantes (tecnécio, promécio, astato, frâncio, neptúnio e plutônio) ocorrem apenas raramente, como produtos de modos de decaimento raros ou processos de reação nuclear envolvendo urânio ou outros elementos pesados.
Nenhum decaimento radioativo foi observado para elementos com números atômicos de 1 a 82, exceto 43 (tecnécio) e 61 (promécio). Isótopos observacionalmente estáveis de alguns elementos (como tungstênio e chumbo), no entanto, são previstos como ligeiramente radioativos com meias-vidas muito longas: por exemplo, as meias-vidas previstas para os isótopos de chumbo estáveis observacionalmente variam de 1035 a 10189 anos. Elementos com números atômicos 43, 61 e 83 a 94 são instáveis o suficiente para que seu decaimento radioativo possa ser prontamente detectado. Três desses elementos, bismuto (elemento 83), tório (elemento 90) e urânio (elemento 92) têm um ou mais isótopos com meias-vidas longas o suficiente para sobreviver como remanescentes da explosiva nucleossíntese estelar que produziu os elementos pesados antes do formação do Sistema Solar. Por exemplo, acima de 1,9×10< /span>19 anos, mais de um bilhão de vezes mais do que a idade atual estimada do universo, o bismuto-209 tem a meia-vida de decaimento alfa mais longa conhecida de qualquer elemento natural. Os 24 elementos mais pesados (aqueles além do plutônio, elemento 94) sofrem decaimento radioativo com meias-vidas curtas e não podem ser produzidos como filhos de elementos de vida mais longa e, portanto, não são conhecidos por ocorrer na natureza.
Tabela periódica
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10. | 11 | 12 | 13 | 14 | 15 | 16. | 17. | 18. | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hidrogénio e metais alcalinos | Metais de terra alcalinos | Triels | Tetrels | Pnicígenos | Calcotégenos | Halogen | Nobre. gases | ||||||||||||
| Período 1 | Hidrogénio 1,0080 | Helium2He 4.0026 | |||||||||||||||||
| 2 | Lithium3Li 6.94 | Beryllium4Be 9.0122 | Boron5B 10.81 | Carbon6C 12.011 | Nitrogen7N 14.007 | Oxigen8O 15.999 | Fluorine9F 18.998 | Neon10Ne 20.180 | |||||||||||
| 3 | Sodium11Na 22.990 | Magnésio 12Mg 24.305 | Aluminium13Al 26.982 | Silicon14Si 28.085 | Fósforo15P 30.974 | Sulfur16S 32.06 | Chlorine17Cl 35,45 | Argon18Ar 39.95 | |||||||||||
| 4 | Potassium19K 39.098 | Cálcio20Ca 40.078 | Scandium21Sc 44.956 | Titanium22Ti 47.867 | Vanadium23V 50.942 | Chromium24Cr 51.996 | Manganês25Mn 54,938 | Iron26Fe 55.845 | Cobalt27Co 58.933 | Nickel28Ni 58.693 | Copper29Cu 63.546 | Zinc30Zn 65.38 | Gallium31Ga 69.723 | Germanium32Ge 72.630 | Arsenic33As 74.922 | Selénio34Se 78.971 | Bromine35Br 79.904 | Krypton36Kr 83.798 | |
| 5 | Rubídeo37Rb 85.468 | Stront-ium38Sr 87.62 | Yttrium39Y 88.906 | Zircótico40Zr 91.224 | N.° 92.906 | Molibdénio 42Mo 95,95 | Tecnologia 43Tc [97] | Rubrica 101.07 | Rhodium45Rh 102.91 | Pallad-ium46Pd 106.42 | Silver47Ag 107.87 | Cd 112.41 | Indium49In 114.82 | Tin50Sn 118.71 | 121.76 | Tellurium52Te 127.60 | Iodo53I 126.90 | Xenon54Xe 131.29 | |
| 6 | Caesium55Cs 132.91 | Barium56Baio 137.33 | Lutetium71Lu 174.97 | 178.49 | Tantalum73Ta 180,95 | Tungsten74W 183.84 | Rhenium75Re 186.21 | Osmium76Os 190.23 | Iridium77Ir 192.22 | Quadro 195.08 | Gold79Au 196.97 | Mercury80Hg 200,59 | Thallium81Tl 204.38 | Lead82Pb 207.2 | Bismuth83Bi 208.98 | Polo-nium84Po [209] | Asta-tine85At [210] | Radon86Rn [222] | |
| 7 | Francium87Fr [223] | Radium88Ra [226] | Lawrencium103Lr [266] | Rutherfordium104Rf [267] | Dublim105Db [268] | Sea-borgium106Sg [269] | Bohr-ium107Bh [270] | Has-sium108Hs [269] | Meit-nerium109Mt [278] | Darm-stadtium110Ds [281] | Roentgenium111Rg [282] | Copernicium112Cn [285] | Nihon 113Nh [286] | Flerovium114Fl [289] | Moscovium115Mc [290] | Liver-morium116Lv [293] | Tennessine117Ts [294] | Oga-ness118Og [294] | |
| Lanthanum57La 138.91 | Cerium58Ce 140.12 | Praseo-dymium59Pr 140.91 | Neodímio60Nd 144.24 | Prome-thium61Pm [145] | Samarium62Sm 150.36 | Europium63Eu 151.96 | Gadolinium64Gd 157.25 | Terbium65Tb 158.93 | Dyspro-sium66Dy 162.50 | Holmium67Ho 164.93 | Erbium68Er 167.26 | Thulium69Tm 168.93 | Ytter-bium70Yb 173.05 | ||||||
| Actinium89Ac [227] | DIRECÇÃO | Protactinium91Pa 231.04 | Uranium92U 238.03 | Neptunio93Np [237] | Plutão 94Pu [244] | Ameri-cium95Am [243] | Curium96Cm [247] | Berkel-ium97Bk [247] | Californium98Cf [251] | Einstei-nium99E [252] | Fermium100Fm [257] | Mende-levium101Md [258] | Nobel 102No [259] | ||||||
- Ca:40.078 — Valor resumido (incerteza omitida aqui)
- Po: [209] — número de massa do isótopo mais estável
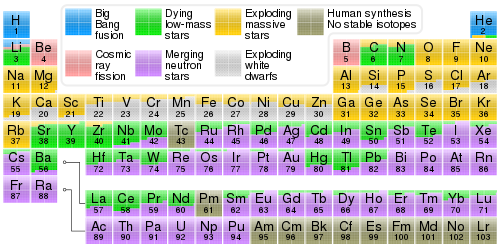
As propriedades dos elementos químicos são frequentemente resumidas usando a tabela periódica, que organiza os elementos de forma poderosa e elegante, aumentando o número atômico em linhas ("períodos") nas quais as colunas ("grupos& #34;) compartilham propriedades físicas e químicas recorrentes ("periódicas"). A tabela padrão atual contém 118 elementos confirmados a partir de 2021.
Embora existam precursores anteriores a esta apresentação, sua invenção é geralmente creditada ao químico russo Dmitri Mendeleev em 1869, que pretendia que a tabela ilustrasse tendências recorrentes nas propriedades dos elementos. O layout da tabela foi refinado e ampliado ao longo do tempo, à medida que novos elementos foram descobertos e novos modelos teóricos foram desenvolvidos para explicar o comportamento químico.
O uso da tabela periódica é agora onipresente na disciplina acadêmica de química, fornecendo uma estrutura extremamente útil para classificar, sistematizar e comparar todas as diversas formas de comportamento químico. A tabela também encontrou ampla aplicação em física, geologia, biologia, ciência dos materiais, engenharia, agricultura, medicina, nutrição, saúde ambiental e astronomia. Seus princípios são especialmente importantes na engenharia química.
Nomenclatura e símbolos
Os vários elementos químicos são formalmente identificados por seus números atômicos únicos, por seus nomes aceitos e por seus símbolos.
Números atômicos
Os elementos conhecidos têm números atômicos de 1 a 118, convencionalmente apresentados como algarismos arábicos. Uma vez que os elementos podem ser sequenciados exclusivamente por número atômico, convencionalmente do menor para o maior (como em uma tabela periódica), conjuntos de elementos são algumas vezes especificados por notação como "através de", "além";, ou "de... através de", como em "através do ferro", "além do urânio" ou "do lantânio ao lutécio". Os termos "luz" e "pesado" às vezes também são usados informalmente para indicar números atômicos relativos (não densidades), como em "mais leve que o carbono" ou "mais pesado que o chumbo", embora tecnicamente o peso ou a massa dos átomos de um elemento (seus pesos atômicos ou massas atômicas) nem sempre aumente monotonicamente com seus números atômicos.
Nomes de elementos
A nomeação de várias substâncias agora conhecidas como elementos precede a teoria atômica da matéria, pois nomes foram dados localmente por várias culturas a vários minerais, metais, compostos, ligas, misturas e outros materiais, embora na época não fosse sabia quais produtos químicos eram elementos e quais compostos. Como eles foram identificados como elementos, os nomes existentes para elementos antigos conhecidos (por exemplo, ouro, mercúrio, ferro) foram mantidos na maioria dos países. Diferenças nacionais surgiram sobre os nomes dos elementos por conveniência, sutilezas linguísticas ou nacionalismo. Para alguns exemplos ilustrativos: falantes de alemão usam "Wasserstoff" (substância aquosa) para "hidrogênio", "Sauerstoff" (substância ácida) para "oxigênio" e "Stickstoff" (substância sufocante) para "nitrogênio", enquanto o inglês e algumas línguas românicas usam "sódio" para "natrium" e "potássio" para "kalium", e os franceses, italianos, gregos, portugueses e poloneses preferem "azote/azot/azoto" (de raízes que significam "sem vida") para "nitrogênio".
Para fins de comunicação e comércio internacional, os nomes oficiais dos elementos químicos antigos e mais recentemente reconhecidos são decididos pela União Internacional de Química Pura e Aplicada (IUPAC), que decidiu por uma espécie de língua inglesa internacional, usando nomes tradicionais em inglês, mesmo quando o símbolo químico de um elemento é baseado em uma palavra latina ou outra palavra tradicional, por exemplo, adotando "ouro" em vez de "aurum" como o nome do 79º elemento (Au). A IUPAC prefere as grafias britânicas "aluminium" e "césio" sobre as grafias dos EUA "aluminum" e "césio", e o "enxofre" sobre o "enxofre" britânico. No entanto, os elementos que são práticos para vender a granel em muitos países ainda têm nomes nacionais usados localmente, e os países cuja língua nacional não usa o alfabeto latino provavelmente usam os nomes de elementos da IUPAC.
De acordo com a IUPAC, elementos químicos não são nomes próprios em inglês; consequentemente, o nome completo de um elemento não costuma ser capitalizado em inglês, mesmo se derivado de um nome próprio, como em californium e einsteinium. Nomes de isótopos de elementos químicos também são escritos sem letras maiúsculas, por exemplo, carbono-12 ou urânio-235. Os símbolos de elementos químicos (como Cf para califórnio e Es para einstênio) são sempre em letras maiúsculas (veja abaixo).
Na segunda metade do século XX, os laboratórios de física tornaram-se capazes de produzir núcleos de elementos químicos com meias-vidas muito curtas para que uma quantidade apreciável deles existisse a qualquer momento. Estes também são nomeados pela IUPAC, que geralmente adota o nome escolhido pelo descobridor. Essa prática pode levar à questão controversa de qual grupo de pesquisa realmente descobriu um elemento, uma questão que atrasou a nomeação de elementos com número atômico de 104 e superior por um período de tempo considerável. (Veja controvérsia de nomenclatura de elementos).
Os precursores de tais controvérsias envolveram as nomenclaturas nacionalistas de elementos no final do século XIX. Por exemplo, lutetium foi nomeado em referência a Paris, França. Os alemães estavam relutantes em ceder os direitos de nomeação para os franceses, muitas vezes chamando-o de cassiopeium. Da mesma forma, o descobridor britânico de nióbio originalmente o chamou de columbium em referência ao Novo Mundo. Foi amplamente utilizado como tal por publicações americanas antes da padronização internacional (em 1950).
Símbolos químicos
Elementos químicos específicos
Antes da química se tornar uma ciência, os alquimistas criaram símbolos misteriosos para metais e compostos comuns. Estes foram, no entanto, usados como abreviaturas em diagramas ou procedimentos; não havia o conceito de átomos se combinando para formar moléculas. Com seus avanços na teoria atômica da matéria, John Dalton criou seus próprios símbolos mais simples, baseados em círculos, para representar moléculas.
O atual sistema de notação química foi inventado por Berzelius. Nesse sistema tipográfico, os símbolos químicos não são meras abreviações — embora cada um deles consista em letras do alfabeto latino. Eles são concebidos como símbolos universais para pessoas de todas as línguas e alfabetos.
O primeiro desses símbolos pretendia ser totalmente universal. Como o latim era a língua comum da ciência naquela época, eram abreviações baseadas nos nomes latinos dos metais. Cu vem de cuprum, Fe vem de ferrum, Ag de argentum. Os símbolos não eram seguidos de ponto (ponto final) como nas abreviaturas. Elementos químicos posteriores também receberam símbolos químicos únicos, com base no nome do elemento, mas não necessariamente em inglês. Por exemplo, o sódio tem o símbolo químico 'Na' depois do latim natrium. O mesmo se aplica a "Fe" (ferrum) para ferro, "Hg" (hydrargyrum) para mercúrio, "Sn" (stannum) para estanho, "Au" (aurum) para ouro, "Ag" (argentum) para prata, "Pb" (prumo) para chumbo, "Cu" (cuprum) para cobre, e "Sb" (stibium) para antimônio. "W" (volfrâmio) para tungstênio deriva do alemão, "K" (kalium) para potássio, em última análise, do árabe.
Os símbolos químicos são entendidos internacionalmente quando os nomes dos elementos podem exigir tradução. Às vezes, houve diferenças no passado. Por exemplo, os alemães no passado usaram "J" (para o nome alternativo Jod) para iodo, mas agora use "I" e "Iod".
A primeira letra de um símbolo químico é sempre maiúscula, como nos exemplos anteriores, e as letras subsequentes, se houver, são sempre minúsculas (letras minúsculas). Assim, os símbolos para califórnio e einstênio são Cf e Es.
Símbolos químicos gerais
Também existem símbolos em equações químicas para grupos de elementos químicos, por exemplo, em fórmulas comparativas. Muitas vezes, são uma única letra maiúscula e as letras são reservadas e não usadas para nomes de elementos específicos. Por exemplo, um "X" indica um grupo variável (geralmente um halogênio) em uma classe de compostos, enquanto "R" é um radical, significando uma estrutura composta tal como uma cadeia de hidrocarboneto. A letra "Q" é reservado para "calor" em uma reação química. "S" também é freqüentemente usado como um símbolo químico geral, embora também seja o símbolo do ítrio. "Z" também é freqüentemente usado como um grupo de variáveis gerais. "E" é usado em química orgânica para denotar um grupo de retirada de elétrons ou um eletrófilo; da mesma forma "Nu" denota um nucleófilo. "L" é usado para representar um ligante geral em química inorgânica e organometálica. "M" também é freqüentemente usado no lugar de um metal geral.
Pelo menos dois símbolos químicos genéricos adicionais de duas letras também estão em uso informal, "Ln" para qualquer elemento lantanídeo e "An" para qualquer elemento actinídeo. "Rg" antigamente era usado para qualquer elemento de gás raro, mas o grupo de gases raros agora foi renomeado para gases nobres e o símbolo "Rg" agora foi atribuído ao elemento roentgenium.
Símbolos de isótopos
Os isótopos são distinguidos pelo número de massa atômica (total de prótons e nêutrons) para um determinado isótopo de um elemento, com esse número combinado com o símbolo do elemento pertinente. A IUPAC prefere que os símbolos de isótopos sejam escritos em notação sobrescrita quando prático, por exemplo 12C e 235U. No entanto, outras notações, como carbono-12 e urânio-235, ou C-12 e U-235, também são usadas.
Como um caso especial, os três isótopos naturais do elemento hidrogênio são frequentemente especificados como H para 1H (prótio), D para 2H (deutério) e T para 3H (trítio). Essa convenção é mais fácil de usar em equações químicas, substituindo a necessidade de escrever o número de massa de cada átomo. Por exemplo, a fórmula para água pesada pode ser escrita D2O em vez de 2H2O.
Origem dos elementos
Apenas cerca de 4% da massa total do universo é composta de átomos ou íons e, portanto, representada por elementos químicos. Essa fração é cerca de 15% da matéria total, sendo o restante da matéria (85%) matéria escura. A natureza da matéria escura é desconhecida, mas não é composta de átomos de elementos químicos porque não contém prótons, nêutrons ou elétrons. (A parte não-matéria restante da massa do universo é composta da energia escura ainda menos compreendida).
Os 94 elementos químicos que ocorrem naturalmente foram produzidos por pelo menos quatro classes de processos astrofísicos. A maior parte do hidrogênio, hélio e uma quantidade muito pequena de lítio foram produzidos nos primeiros minutos do Big Bang. Essa nucleossíntese do Big Bang aconteceu apenas uma vez; os demais processos estão em andamento. A fusão nuclear dentro das estrelas produz elementos através da nucleossíntese estelar, incluindo todos os elementos do carbono ao ferro em número atômico. Elementos com número atômico maior que o ferro, incluindo elementos pesados como urânio e plutônio, são produzidos por várias formas de nucleossíntese explosiva em supernovas e fusões de estrelas de nêutrons. Os elementos leves lítio, berílio e boro são produzidos principalmente por espalação de raios cósmicos (fragmentação induzida por raios cósmicos) de carbono, nitrogênio e oxigênio.
Durante as fases iniciais do Big Bang, a nucleossíntese de núcleos de hidrogênio resultou na produção de hidrogênio-1 (prótio, 1H) e hélio-4 (4 He), bem como uma quantidade menor de deutério (2H) e quantidades muito minúsculas (da ordem de 10−10) de lítio e berílio. Quantidades ainda menores de boro podem ter sido produzidas no Big Bang, já que foi observado em algumas estrelas muito antigas, enquanto o carbono não. Nenhum elemento mais pesado que o boro foi produzido no Big Bang. Como resultado, a abundância primordial de átomos (ou íons) consistia em aproximadamente 75% 1H, 25% 4He e 0,01% de deutério, com apenas pequenos traços de lítio, berílio e talvez boro. Enriquecimento subseqüente de halos galácticos ocorreu devido a nucleossíntese estelar e nucleossíntese de supernova. No entanto, a abundância de elementos no espaço intergaláctico ainda pode se assemelhar muito às condições primordiais, a menos que tenha sido enriquecida por algum meio.
Na Terra (e em outros lugares), vestígios de vários elementos continuam a ser produzidos a partir de outros elementos como produtos de processos de transmutação nuclear. Estes incluem alguns produzidos por raios cósmicos ou outras reações nucleares (ver nuclídeos cosmogênicos e nucleogênicos), e outros produzidos como produtos de decaimento de nuclídeos primordiais de vida longa. Por exemplo, vestígios (mas detectáveis) de carbono-14 (14C) são continuamente produzidos na atmosfera por raios cósmicos que impactam átomos de nitrogênio e argônio-40 (40 Ar) é continuamente produzido pelo decaimento do potássio-40 (40K) que ocorre primordialmente, mas é instável. Além disso, três actinídeos de ocorrência primordial, mas radioativos, tório, urânio e plutônio, decaem através de uma série de elementos radioativos produzidos de forma recorrente, mas instáveis, como rádio e radônio, que estão presentes transitoriamente em qualquer amostra desses metais ou seus minérios ou compostos. Três outros elementos radioativos, tecnécio, promécio e neptúnio, ocorrem apenas incidentalmente em materiais naturais, produzidos como átomos individuais pela fissão nuclear dos núcleos de vários elementos pesados ou em outros processos nucleares raros.
Além dos 94 elementos que ocorrem naturalmente, vários elementos artificiais foram produzidos pela tecnologia da física nuclear humana. A partir de 2021, esses experimentos produziram todos os elementos até o número atômico 118.
Abundância
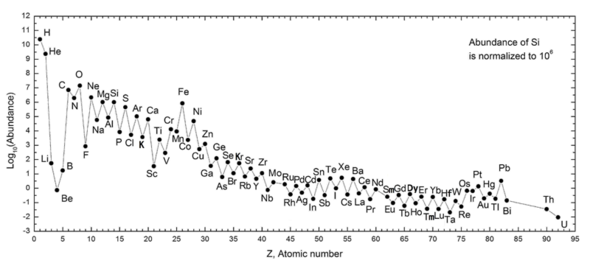
O gráfico a seguir (observe a escala logarítmica) mostra a abundância de elementos em nosso Sistema Solar. A tabela mostra os doze elementos mais comuns em nossa galáxia (estimados espectroscopicamente), medidos em partes por milhão, por massa. Galáxias próximas que evoluíram ao longo de linhas semelhantes têm um enriquecimento correspondente de elementos mais pesados que o hidrogênio e o hélio. As galáxias mais distantes estão sendo vistas como eram no passado, então suas abundâncias de elementos parecem mais próximas da mistura primordial. Como as leis e processos físicos parecem comuns em todo o universo visível, no entanto, os cientistas esperam que essas galáxias evoluam elementos em abundância semelhante.
A abundância de elementos no Sistema Solar está de acordo com sua origem na nucleossíntese no Big Bang e em várias estrelas progenitoras de supernovas. Hidrogênio e hélio muito abundantes são produtos do Big Bang, mas os próximos três elementos são raros, pois tiveram pouco tempo para se formar no Big Bang e não são produzidos em estrelas (são, no entanto, produzidos em pequenas quantidades pela quebra de elementos mais pesados na poeira interestelar, como resultado do impacto dos raios cósmicos). Começando com o carbono, os elementos são produzidos nas estrelas pelo acúmulo de partículas alfa (núcleos de hélio), resultando em uma abundância alternadamente maior de elementos com números atômicos pares (estes também são mais estáveis). Em geral, tais elementos até o ferro são feitos em grandes estrelas em processo de se tornarem supernovas. O ferro-56 é particularmente comum, pois é o elemento mais estável que pode ser facilmente produzido a partir de partículas alfa (sendo um produto do decaimento do níquel-56 radioativo, feito a partir de 14 núcleos de hélio). Elementos mais pesados que o ferro são produzidos em processos de absorção de energia em grandes estrelas, e sua abundância no universo (e na Terra) geralmente diminui com seu número atômico.
A abundância dos elementos químicos na Terra varia do ar à crosta e ao oceano, e em vários tipos de vida. A abundância de elementos na crosta terrestre difere daquela no Sistema Solar (como visto no Sol e planetas pesados como Júpiter) principalmente na perda seletiva dos elementos mais leves (hidrogênio e hélio) e também néon volátil, carbono (como hidrocarbonetos), nitrogênio e enxofre, como resultado do aquecimento solar no início da formação do sistema solar. O oxigênio, o elemento terrestre mais abundante em massa, é retido na Terra por combinação com o silício. O alumínio a 8% em massa é mais comum na crosta terrestre do que no universo e no sistema solar, mas a composição do manto bem mais volumoso, que tem magnésio e ferro no lugar do alumínio (que ocorre ali apenas em 2% da massa) espelha mais de perto a composição elementar do sistema solar, exceto pela notável perda de elementos voláteis para o espaço e perda de ferro que migrou para o núcleo da Terra.
A composição do corpo humano, em contraste, segue mais de perto a composição da água do mar - exceto que o corpo humano tem estoques adicionais de carbono e nitrogênio necessários para formar as proteínas e os ácidos nucléicos, juntamente com o fósforo nos ácidos nucléicos e molécula de transferência de energia trifosfato de adenosina (ATP) que ocorre nas células de todos os organismos vivos. Certos tipos de organismos requerem elementos adicionais específicos, por exemplo, o magnésio na clorofila em plantas verdes, o cálcio em conchas de moluscos ou o ferro na hemoglobina em animais vertebrados. glóbulos vermelhos.
| Elementos em nossa galáxia | Partes por milhão por massa |
|---|---|
| Hidrogénio | 739,000 |
| Hélio | 240.000 |
| Oxigenação | 10.400 |
| Carbono de Carbono | 4.600 |
| Neon. | 1.340 |
| Ferro de engomar | 1,090 |
| Nitrogênio | 960 |
| Silício | 650 |
| Magnésio | 580 |
| Sulfuro | 440 |
| Potássio | 210 |
| Nickel | 100. |
| Elementos nutricionais na tabela periódica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H. H. H. | Ele. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Ser | B | C | N | O | F | Não. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nao | Mg | Al. | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| KK | Ca. | Sc | Ti | V | C. | Mn. | Fe | Co | Ni | Cu | Zn | Ga | Ge | Como | Se | B. | Kr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rb | Sr. | Y | Zr | Nb | Mo | TC | Ru | Rh | Pd | Agrupamento | Cd | Em | Sn | Sb | Te | Eu... | Xe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C | Bando | * | Lu | Hf | Ta. | W | Repito | Os | Ir. | Pt | Au! | Hg | ? | PB | B. | Po | Em | RN | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pe. | Ra | Não. | Lr. | Rf | Db | Sg | B. | H. | Mt | D | RG | Cn | Não. | Fl | Mc | LV | T | Og | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu sei. | Gd | TB | Dy! | Ho. | Er. | T m | Yb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Não. | Acções | O quê? | Pai. | U | Np | Puxa. | Am | Cm | Bk. | Cf | E | F m | Md. | Não. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Legenda: Os quatro elementos orgânicos básicos
Elementos de quantidade
Oligoelementos essenciais
Deemed elemento de traço essencial pelos EUA, não pela União Europeia
Função sugerida de efeitos de privação ou manipulação metabólica ativa, mas nenhuma função bioquímica claramente identificada em humanos
Evidências circunstanciais limitadas para rastreamento de benefícios ou ação biológica em mamíferos
Nenhuma evidência de ação biológica em mamíferos, mas essencial em alguns organismos inferiores. (No caso de lantânio, a definição de um nutriente essencial como sendo indispensável e insubstituível não é completamente aplicável devido à extrema semelhança dos lantânidas. Os lantânidas iniciais estáveis até Sm são conhecidos por estimular o crescimento de vários organismos que utilizam lantânidas.) |
História
Definições em evolução
O conceito de um "elemento" como uma substância indivisível desenvolveu-se através de três grandes fases históricas: definições clássicas (como as dos gregos antigos), definições químicas e definições atômicas.
Definições clássicas
A filosofia antiga postulou um conjunto de elementos clássicos para explicar os padrões observados na natureza. Esses elementos originalmente se referiam à terra, água, ar e fogo em vez do elementos químicos da ciência moderna.
O termo 'elementos' (stoicheia) foi usado pela primeira vez pelo filósofo grego Platão por volta de 360 aC em seu diálogo Timeu, que inclui uma discussão sobre a composição de corpos inorgânicos e orgânicos e é um tratado especulativo sobre química. Platão acreditava que os elementos introduzidos um século antes por Empédocles eram compostos de pequenas formas poliédricas: tetraedro (fogo), octaedro (ar), icosaedro (água) e cubo (terra).
Aristóteles, c. 350 aC, também usou o termo stoicheia e adicionou um quinto elemento chamado éter, que formava os céus. Aristóteles definiu um elemento como:
Elemento – um desses corpos em que outros corpos podem decompor, e que em si não é capaz de ser dividido em outro.
Definições químicas
Em 1661, Robert Boyle propôs sua teoria do corpuscularismo que favorecia a análise da matéria como constituída por unidades irredutíveis de matéria (átomos) e, optando por não ficar do lado nem da visão de Aristóteles dos quatro elementos nem de Paracelso.; visão de três elementos fundamentais, deixou em aberto a questão do número de elementos. A primeira lista moderna de elementos químicos foi dada em 1789 de Antoine Lavoisier Elements of Chemistry, que continha trinta e três elementos, incluindo leves e calóricos. Em 1818, Jöns Jakob Berzelius havia determinado pesos atômicos para quarenta e cinco dos quarenta e nove elementos então aceitos. Dmitri Mendeleev tinha sessenta e seis elementos em sua tabela periódica de 1869.
De Boyle até o início do século 20, um elemento era definido como uma substância pura que não podia ser decomposta em nenhuma substância mais simples. Dito de outra forma, um elemento químico não pode ser transformado em outros elementos químicos por processos químicos. Os elementos durante esse período eram geralmente distinguidos por seus pesos atômicos, uma propriedade mensurável com razoável precisão pelas técnicas analíticas disponíveis.
Definições atômicas
A descoberta de 1913 pelo físico inglês Henry Moseley de que a carga nuclear é a base física para o número atômico de um átomo, refinada ainda mais quando a natureza dos prótons e nêutrons foi apreciada, acabou levando à definição atual de um elemento com base no número atômico (número de prótons por núcleo atômico). O uso de números atômicos, em vez de pesos atômicos, para distinguir elementos tem maior valor preditivo (uma vez que esses números são inteiros) e também resolve algumas ambigüidades na visão baseada na química devido a propriedades variáveis de isótopos e alótropos dentro do mesmo elemento. Atualmente, a IUPAC define um elemento como existindo se ele tiver isótopos com tempo de vida maior que os 10−14 segundos que o núcleo leva para formar uma nuvem eletrônica.
Em 1914, setenta e dois elementos eram conhecidos, todos de ocorrência natural. Os elementos naturais remanescentes foram descobertos ou isolados nas décadas subsequentes, e vários elementos adicionais também foram produzidos sinteticamente, com grande parte desse trabalho iniciado por Glenn T. Seaborg. Em 1955, o elemento 101 foi descoberto e nomeado mendelévio em homenagem a D.I. Mendeleev, o primeiro a organizar os elementos de maneira periódica.
Descoberta e reconhecimento de vários elementos
Dez materiais familiares a várias culturas pré-históricas são agora conhecidos como elementos químicos: carbono, cobre, ouro, ferro, chumbo, mercúrio, prata, enxofre, estanho e zinco. Três materiais adicionais agora aceitos como elementos, arsênico, antimônio e bismuto, foram reconhecidos como substâncias distintas antes de 1500 DC. Fósforo, cobalto e platina foram isolados antes de 1750.
A maioria dos elementos químicos remanescentes na natureza foram identificados e caracterizados em 1900, incluindo:
- Tais materiais industriais agora conhecidos como alumínio, silício, níquel, cromo, magnésio e tungstênio
- Metais reativos como lítio, sódio, potássio e cálcio
- Os halogênios fluorino, cloro, bromo e iodo
- Gases como hidrogênio, oxigênio, nitrogênio, hélio, argônio e néon
- A maioria dos elementos rara-terra, incluindo cério, lantânio, gadolínio e neodímio.
- Os elementos radioativos mais comuns, incluindo urânio, tório, radium e radon
Elementos isolados ou produzidos desde 1900 incluem:
- Os três elementos naturais estáveis que ocorrem regularmente não descobertos: háfnio, lutetium e rênio
- Plutão, que foi produzido pela primeira vez sinteticamente em 1940 por Glenn T. Seaborg, mas agora também é conhecido por algumas ocorrências naturais duradouras
- Os três elementos naturais que ocorrem incidentalmente (neptunium, promethium e technetium), que foram produzidos pela primeira vez sinteticamente, mas mais tarde descobertos em quantidades de traços em certas amostras geológicas
- Quatro produtos de decadência escassa de urânio ou de tório (aestatina, francium, actínio e protactinium), e
- Vários elementos transuranic sintéticos, começando com americium e curium
Elementos descobertos recentemente
O primeiro elemento transuraniano (elemento com número atômico maior que 92) descoberto foi o neptúnio em 1940. Desde 1999, reivindicações para a descoberta de novos elementos têm sido consideradas pelo Grupo de Trabalho Conjunto IUPAC/IUPAP. Em janeiro de 2016, todos os 118 elementos foram confirmados como descobertos pela IUPAC. A descoberta do elemento 112 foi reconhecida em 2009, e o nome copernicium e o símbolo atômico Cn foram sugeridos para ele. O nome e o símbolo foram endossados oficialmente pela IUPAC em 19 de fevereiro de 2010. Acredita-se que o elemento mais pesado sintetizado até hoje é o elemento 118, oganesson, em 9 de outubro de 2006, pelo Laboratório Flerov de Reações Nucleares em Dubna, Rússia. Tennessine, o elemento 117 foi o último elemento alegadamente descoberto, em 2009. Em 28 de novembro de 2016, cientistas da IUPAC reconheceram oficialmente os nomes de quatro dos mais novos elementos químicos, com números atômicos 113, 115, 117 e 118.
Lista dos 118 elementos químicos conhecidos
A seguinte tabela classificável mostra os 118 elementos químicos conhecidos.
- Número atômico, Elementoe Símbolo todos servem de forma independente como identificadores únicos.
- Elemento nomes são aqueles aceitos pelo IUPAC.
- bloco indica o bloco de tabela periódica para cada elemento: vermelho = s-block, amarelo = p-block, azul = d-block, verde = f-block.
- Grupo e período refere-se à posição de um elemento na tabela periódica. Os números do grupo aqui mostram a numeração atualmente aceita; para numeração mais antiga, ver Grupo (mesa perídica).
| Element | Origin of name | Group | Period | Block | Standardatomicweight Ar°(E) | Density | Melting point | Boiling point | Specificheatcapacity | Electronegativity | Abundancein Earth'scrust | Origin | Phase at r.t. | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atomic number Z |
Symbol | Name | (Da) | (g/cm3) | (K) | (K) | (J/g · K) | (mg/kg) | |||||||
| 1 | H | Hydrogen | Greek elements hydro- and -gen, 'water-forming' | 1 | 1 | s-block | 1.0080 | 0.00008988 | 14.01 | 20.28 | 14.304 | 2.20 | 1400 | primordial | gas |
| 2 | He | Helium | Greek hḗlios, 'sun' | 18 | 1 | s-block | 4.0026 | 0.0001785 | – | 4.22 | 5.193 | – | 0.008 | primordial | gas |
| 3 | Li | Lithium | Greek líthos, 'stone' | 1 | 2 | s-block | 6.94 | 0.534 | 453.69 | 1560 | 3.582 | 0.98 | 20 | primordial | solid |
| 4 | Be | Beryllium | Beryl, a mineral (ultimately from the name of Belur in southern India) | 2 | 2 | s-block | 9.0122 | 1.85 | 1560 | 2742 | 1.825 | 1.57 | 2.8 | primordial | solid |
| 5 | B | Boron | Borax, a mineral (from Arabic bawraq, Middle Persian *bōrag) | 13 | 2 | p-block | 10.81 | 2.34 | 2349 | 4200 | 1.026 | 2.04 | 10 | primordial | solid |
| 6 | C | Carbon | Latin carbo, 'coal' | 14 | 2 | p-block | 12.011 | 2.267 | >4000 | 4300 | 0.709 | 2.55 | 200 | primordial | solid |
| 7 | N | Nitrogen | Greek nítron and -gen, 'niter-forming' | 15 | 2 | p-block | 14.007 | 0.0012506 | 63.15 | 77.36 | 1.04 | 3.04 | 19 | primordial | gas |
| 8 | O | Oxygen | Greek oxy- and -gen, 'acid-forming' | 16 | 2 | p-block | 15.999 | 0.001429 | 54.36 | 90.20 | 0.918 | 3.44 | 461000 | primordial | gas |
| 9 | F | Fluorine | Latin fluere, 'to flow' | 17 | 2 | p-block | 18.998 | 0.001696 | 53.53 | 85.03 | 0.824 | 3.98 | 585 | primordial | gas |
| 10 | Ne | Neon | Greek néon, 'new' | 18 | 2 | p-block | 20.180 | 0.0009002 | 24.56 | 27.07 | 1.03 | – | 0.005 | primordial | gas |
| 11 | Na | Sodium | English (from medieval Latin) soda · Symbol Na is derived from New Latin natrium, coined from German Natron, 'natron' |
1 | 3 | s-block | 22.990 | 0.968 | 370.87 | 1156 | 1.228 | 0.93 | 23600 | primordial | solid |
| 12 | Mg | Magnesium | Magnesia, a district of Eastern Thessaly in Greece | 2 | 3 | s-block | 24.305 | 1.738 | 923 | 1363 | 1.023 | 1.31 | 23300 | primordial | solid |
| 13 | Al | Aluminium | Alumina, from Latin alumen (gen. aluminis), 'bitter salt, alum' | 13 | 3 | p-block | 26.982 | 2.70 | 933.47 | 2792 | 0.897 | 1.61 | 82300 | primordial | solid |
| 14 | Si | Silicon | Latin silex, 'flint' (originally silicium) | 14 | 3 | p-block | 28.085 | 2.3290 | 1687 | 3538 | 0.705 | 1.9 | 282000 | primordial | solid |
| 15 | P | Phosphorus | Greek phōsphóros, 'light-bearing' | 15 | 3 | p-block | 30.974 | 1.823 | 317.30 | 550 | 0.769 | 2.19 | 1050 | primordial | solid |
| 16 | S | Sulfur | Latin sulphur, 'brimstone' | 16 | 3 | p-block | 32.06 | 2.07 | 388.36 | 717.87 | 0.71 | 2.58 | 350 | primordial | solid |
| 17 | Cl | Chlorine | Greek chlōrós, 'greenish yellow' | 17 | 3 | p-block | 35.45 | 0.0032 | 171.6 | 239.11 | 0.479 | 3.16 | 145 | primordial | gas |
| 18 | Ar | Argon | Greek argós, 'idle' (because of its inertness) | 18 | 3 | p-block | 39.95 | 0.001784 | 83.80 | 87.30 | 0.52 | – | 3.5 | primordial | gas |
| 19 | K | Potassium | New Latin potassa, 'potash', itself from pot and ash · Symbol K is derived from Latin kalium |
1 | 4 | s-block | 39.098 | 0.89 | 336.53 | 1032 | 0.757 | 0.82 | 20900 | primordial | solid |
| 20 | Ca | Calcium | Latin calx, 'lime' | 2 | 4 | s-block | 40.078 | 1.55 | 1115 | 1757 | 0.647 | 1.00 | 41500 | primordial | solid |
| 21 | Sc | Scandium | Latin Scandia, 'Scandinavia' | 3 | 4 | d-block | 44.956 | 2.985 | 1814 | 3109 | 0.568 | 1.36 | 22 | primordial | solid |
| 22 | Ti | Titanium | Titans, the sons of the Earth goddess of Greek mythology | 4 | 4 | d-block | 47.867 | 4.506 | 1941 | 3560 | 0.523 | 1.54 | 5650 | primordial | solid |
| 23 | V | Vanadium | Vanadis, an Old Norse name for the Scandinavian goddess Freyja | 5 | 4 | d-block | 50.942 | 6.11 | 2183 | 3680 | 0.489 | 1.63 | 120 | primordial | solid |
| 24 | Cr | Chromium | Greek chróma, 'colour' | 6 | 4 | d-block | 51.996 | 7.15 | 2180 | 2944 | 0.449 | 1.66 | 102 | primordial | solid |
| 25 | Mn | Manganese | Corrupted from magnesia negra; see § magnesium | 7 | 4 | d-block | 54.938 | 7.21 | 1519 | 2334 | 0.479 | 1.55 | 950 | primordial | solid |
| 26 | Fe | Iron | English word, from Proto-Celtic *īsarnom ('iron'), from a root meaning 'blood' · Symbol Fe is derived from Latin ferrum |
8 | 4 | d-block | 55.845 | 7.874 | 1811 | 3134 | 0.449 | 1.83 | 56300 | primordial | solid |
| 27 | Co | Cobalt | German Kobold, 'goblin' | 9 | 4 | d-block | 58.933 | 8.90 | 1768 | 3200 | 0.421 | 1.88 | 25 | primordial | solid |
| 28 | Ni | Nickel | Nickel, a mischievous sprite of German miner mythology | 10 | 4 | d-block | 58.693 | 8.908 | 1728 | 3186 | 0.444 | 1.91 | 84 | primordial | solid |
| 29 | Cu | Copper | English word, from Latin cuprum, from Ancient Greek Kýpros 'Cyprus' | 11 | 4 | d-block | 63.546 | 8.96 | 1357.77 | 2835 | 0.385 | 1.90 | 60 | primordial | solid |
| 30 | Zn | Zinc | Most likely from German Zinke, 'prong' or 'tooth', though some suggest Persian sang, 'stone' | 12 | 4 | d-block | 65.38 | 7.14 | 692.88 | 1180 | 0.388 | 1.65 | 70 | primordial | solid |
| 31 | Ga | Gallium | Latin Gallia, 'France' | 13 | 4 | p-block | 69.723 | 5.91 | 302.9146 | 2673 | 0.371 | 1.81 | 19 | primordial | solid |
| 32 | Ge | Germanium | Latin Germania, 'Germany' | 14 | 4 | p-block | 72.630 | 5.323 | 1211.40 | 3106 | 0.32 | 2.01 | 1.5 | primordial | solid |
| 33 | As | Arsenic | French arsenic, from Greek arsenikón 'yellow arsenic' (influenced by arsenikós, 'masculine' or 'virile'), from a West Asian wanderword ultimately from Old Iranian *zarniya-ka, 'golden' | 15 | 4 | p-block | 74.922 | 5.727 | 1090 | 887 | 0.329 | 2.18 | 1.8 | primordial | solid |
| 34 | Se | Selenium | Greek selḗnē, 'moon' | 16 | 4 | p-block | 78.971 | 4.81 | 453 | 958 | 0.321 | 2.55 | 0.05 | primordial | solid |
| 35 | Br | Bromine | Greek brômos, 'stench' | 17 | 4 | p-block | 79.904 | 3.1028 | 265.8 | 332.0 | 0.474 | 2.96 | 2.4 | primordial | liquid |
| 36 | Kr | Krypton | Greek kryptós, 'hidden' | 18 | 4 | p-block | 83.798 | 0.003749 | 115.79 | 119.93 | 0.248 | 3.00 | 1×10−4 | primordial | gas |
| 37 | Rb | Rubidium | Latin rubidus, 'deep red' | 1 | 5 | s-block | 85.468 | 1.532 | 312.46 | 961 | 0.363 | 0.82 | 90 | primordial | solid |
| 38 | Sr | Strontium | Strontian, a village in Scotland, where it was found | 2 | 5 | s-block | 87.62 | 2.64 | 1050 | 1655 | 0.301 | 0.95 | 370 | primordial | solid |
| 39 | Y | Yttrium | Ytterby, Sweden, where it was found; see also terbium, erbium, ytterbium | 3 | 5 | d-block | 88.906 | 4.472 | 1799 | 3609 | 0.298 | 1.22 | 33 | primordial | solid |
| 40 | Zr | Zirconium | Zircon, a mineral, from Persian zargun, 'gold-hued' | 4 | 5 | d-block | 91.224 | 6.52 | 2128 | 4682 | 0.278 | 1.33 | 165 | primordial | solid |
| 41 | Nb | Niobium | Niobe, daughter of king Tantalus from Greek mythology; see also tantalum | 5 | 5 | d-block | 92.906 | 8.57 | 2750 | 5017 | 0.265 | 1.6 | 20 | primordial | solid |
| 42 | Mo | Molybdenum | Greek molýbdaina, 'piece of lead', from mólybdos, 'lead', due to confusion with lead ore galena (PbS) | 6 | 5 | d-block | 95.95 | 10.28 | 2896 | 4912 | 0.251 | 2.16 | 1.2 | primordial | solid |
| 43 | Tc | Technetium | Greek tekhnētós, 'artificial' | 7 | 5 | d-block | [97] | 11 | 2430 | 4538 | – | 1.9 | ~ 3×10−9 | from decay | solid |
| 44 | Ru | Ruthenium | New Latin Ruthenia, 'Russia' | 8 | 5 | d-block | 101.07 | 12.45 | 2607 | 4423 | 0.238 | 2.2 | 0.001 | primordial | solid |
| 45 | Rh | Rhodium | Greek rhodóeis, 'rose-coloured', from rhódon, 'rose' | 9 | 5 | d-block | 102.91 | 12.41 | 2237 | 3968 | 0.243 | 2.28 | 0.001 | primordial | solid |
| 46 | Pd | Palladium | Pallas, an asteroid, considered a planet at the time | 10 | 5 | d-block | 106.42 | 12.023 | 1828.05 | 3236 | 0.244 | 2.20 | 0.015 | primordial | solid |
| 47 | Ag | Silver | English word · Symbol Ag is derived from Latin argentum |
11 | 5 | d-block | 107.87 | 10.49 | 1234.93 | 2435 | 0.235 | 1.93 | 0.075 | primordial | solid |
| 48 | Cd | Cadmium | New Latin cadmia, from King Kadmos | 12 | 5 | d-block | 112.41 | 8.65 | 594.22 | 1040 | 0.232 | 1.69 | 0.159 | primordial | solid |
| 49 | In | Indium | Latin indicum, 'indigo', the blue colour found in its spectrum | 13 | 5 | p-block | 114.82 | 7.31 | 429.75 | 2345 | 0.233 | 1.78 | 0.25 | primordial | solid |
| 50 | Sn | Tin | English word · Symbol Sn is derived from Latin stannum |
14 | 5 | p-block | 118.71 | 7.265 | 505.08 | 2875 | 0.228 | 1.96 | 2.3 | primordial | solid |
| 51 | Sb | Antimony | Latin antimonium, the origin of which is uncertain: folk etymologies suggest it is derived from Greek antí ('against') + mónos ('alone'), or Old French anti-moine, 'Monk's bane', but it could plausibly be from or related to Arabic ʾiṯmid, 'antimony', reformatted as a Latin word · Symbol Sb is derived from Latin stibium 'stibnite' |
15 | 5 | p-block | 121.76 | 6.697 | 903.78 | 1860 | 0.207 | 2.05 | 0.2 | primordial | solid |
| 52 | Te | Tellurium | Latin tellus, 'the ground, earth' | 16 | 5 | p-block | 127.60 | 6.24 | 722.66 | 1261 | 0.202 | 2.1 | 0.001 | primordial | solid |
| 53 | I | Iodine | French iode, from Greek ioeidḗs, 'violet' | 17 | 5 | p-block | 126.90 | 4.933 | 386.85 | 457.4 | 0.214 | 2.66 | 0.45 | primordial | solid |
| 54 | Xe | Xenon | Greek xénon, neuter form of xénos 'strange' | 18 | 5 | p-block | 131.29 | 0.005894 | 161.4 | 165.03 | 0.158 | 2.60 | 3×10−5 | primordial | gas |
| 55 | Cs | Caesium | Latin caesius, 'sky-blue' | 1 | 6 | s-block | 132.91 | 1.93 | 301.59 | 944 | 0.242 | 0.79 | 3 | primordial | solid |
| 56 | Ba | Barium | Greek barýs, 'heavy' | 2 | 6 | s-block | 137.33 | 3.51 | 1000 | 2170 | 0.204 | 0.89 | 425 | primordial | solid |
| 57 | La | Lanthanum | Greek lanthánein, 'to lie hidden' | f-block groups | 6 | f-block | 138.91 | 6.162 | 1193 | 3737 | 0.195 | 1.1 | 39 | primordial | solid |
| 58 | Ce | Cerium | Ceres, a dwarf planet, considered a planet at the time | f-block groups | 6 | f-block | 140.12 | 6.770 | 1068 | 3716 | 0.192 | 1.12 | 66.5 | primordial | solid |
| 59 | Pr | Praseodymium | Greek prásios dídymos, 'green twin' | f-block groups | 6 | f-block | 140.91 | 6.77 | 1208 | 3793 | 0.193 | 1.13 | 9.2 | primordial | solid |
| 60 | Nd | Neodymium | Greek néos dídymos, 'new twin' | f-block groups | 6 | f-block | 144.24 | 7.01 | 1297 | 3347 | 0.19 | 1.14 | 41.5 | primordial | solid |
| 61 | Pm | Promethium | Prometheus, a figure in Greek mythology | f-block groups | 6 | f-block | [145] | 7.26 | 1315 | 3273 | – | 1.13 | 2×10−19 | from decay | solid |
| 62 | Sm | Samarium | Samarskite, a mineral named after V. Samarsky-Bykhovets, Russian mine official | f-block groups | 6 | f-block | 150.36 | 7.52 | 1345 | 2067 | 0.197 | 1.17 | 7.05 | primordial | solid |
| 63 | Eu | Europium | Europe | f-block groups | 6 | f-block | 151.96 | 5.244 | 1099 | 1802 | 0.182 | 1.2 | 2 | primordial | solid |
| 64 | Gd | Gadolinium | Gadolinite, a mineral named after Johan Gadolin, Finnish chemist, physicist and mineralogist | f-block groups | 6 | f-block | 157.25 | 7.90 | 1585 | 3546 | 0.236 | 1.2 | 6.2 | primordial | solid |
| 65 | Tb | Terbium | Ytterby, Sweden, where it was found; see also yttrium, erbium, ytterbium | f-block groups | 6 | f-block | 158.93 | 8.23 | 1629 | 3503 | 0.182 | 1.2 | 1.2 | primordial | solid |
| 66 | Dy | Dysprosium | Greek dysprósitos, 'hard to get' | f-block groups | 6 | f-block | 162.50 | 8.540 | 1680 | 2840 | 0.17 | 1.22 | 5.2 | primordial | solid |
| 67 | Ho | Holmium | New Latin Holmia, 'Stockholm' | f-block groups | 6 | f-block | 164.93 | 8.79 | 1734 | 2993 | 0.165 | 1.23 | 1.3 | primordial | solid |
| 68 | Er | Erbium | Ytterby, Sweden, where it was found; see also yttrium, terbium, ytterbium | f-block groups | 6 | f-block | 167.26 | 9.066 | 1802 | 3141 | 0.168 | 1.24 | 3.5 | primordial | solid |
| 69 | Tm | Thulium | Thule, the ancient name for an unclear northern location | f-block groups | 6 | f-block | 168.93 | 9.32 | 1818 | 2223 | 0.16 | 1.25 | 0.52 | primordial | solid |
| 70 | Yb | Ytterbium | Ytterby, Sweden, where it was found; see also yttrium, terbium, erbium | f-block groups | 6 | f-block | 173.05 | 6.90 | 1097 | 1469 | 0.155 | 1.1 | 3.2 | primordial | solid |
| 71 | Lu | Lutetium | Latin Lutetia, 'Paris' | 3 | 6 | d-block | 174.97 | 9.841 | 1925 | 3675 | 0.154 | 1.27 | 0.8 | primordial | solid |
| 72 | Hf | Hafnium | New Latin Hafnia, 'Copenhagen' (from Danish havn, harbour) | 4 | 6 | d-block | 178.49 | 13.31 | 2506 | 4876 | 0.144 | 1.3 | 3 | primordial | solid |
| 73 | Ta | Tantalum | King Tantalus, father of Niobe from Greek mythology; see also niobium | 5 | 6 | d-block | 180.95 | 16.69 | 3290 | 5731 | 0.14 | 1.5 | 2 | primordial | solid |
| 74 | W | Tungsten | Swedish tung sten, 'heavy stone' · Symbol W is from Wolfram, originally from Middle High German wolf-rahm 'wolf's foam' describing the mineral wolframite |
6 | 6 | d-block | 183.84 | 19.25 | 3695 | 5828 | 0.132 | 2.36 | 1.3 | primordial | solid |
| 75 | Re | Rhenium | Latin Rhenus, 'the Rhine' | 7 | 6 | d-block | 186.21 | 21.02 | 3459 | 5869 | 0.137 | 1.9 | 7×10−4 | primordial | solid |
| 76 | Os | Osmium | Greek osmḗ, 'smell' | 8 | 6 | d-block | 190.23 | 22.59 | 3306 | 5285 | 0.13 | 2.2 | 0.002 | primordial | solid |
| 77 | Ir | Iridium | Iris, the Greek goddess of the rainbow | 9 | 6 | d-block | 192.22 | 22.56 | 2719 | 4701 | 0.131 | 2.20 | 0.001 | primordial | solid |
| 78 | Pt | Platinum | Spanish platina, 'little silver', from plata 'silver' | 10 | 6 | d-block | 195.08 | 21.45 | 2041.4 | 4098 | 0.133 | 2.28 | 0.005 | primordial | solid |
| 79 | Au | Gold | English word, from the same root as 'yellow' · Symbol Au is derived from Latin aurum |
11 | 6 | d-block | 196.97 | 19.3 | 1337.33 | 3129 | 0.129 | 2.54 | 0.004 | primordial | solid |
| 80 | Hg | Mercury | Mercury, Roman god of commerce, communication, and luck, known for his speed and mobility · Symbol Hg is derived from its Latin name hydrargyrum, from Greek hydrárgyros, 'water-silver' |
12 | 6 | d-block | 200.59 | 13.534 | 234.43 | 629.88 | 0.14 | 2.00 | 0.085 | primordial | liquid |
| 81 | Tl | Thallium | Greek thallós, 'green shoot or twig' | 13 | 6 | p-block | 204.38 | 11.85 | 577 | 1746 | 0.129 | 1.62 | 0.85 | primordial | solid |
| 82 | Pb | Lead | English word, from Proto-Celtic *ɸloudom, from a root meaning 'flow' · Symbol Pb is derived from Latin plumbum |
14 | 6 | p-block | 207.2 | 11.34 | 600.61 | 2022 | 0.129 | 1.87 (2+) 2.33 (4+) |
14 | primordial | solid |
| 83 | Bi | Bismuth | German Wismut, from weiß Masse 'white mass', unless from Arabic | 15 | 6 | p-block | 208.98 | 9.78 | 544.7 | 1837 | 0.122 | 2.02 | 0.009 | primordial | solid |
| 84 | Po | Polonium | Latin Polonia, 'Poland', home country of Marie Curie | 16 | 6 | p-block | [209] | 9.196 | 527 | 1235 | – | 2.0 | 2×10−10 | from decay | solid |
| 85 | At | Astatine | Greek ástatos, 'unstable' | 17 | 6 | p-block | [210] | (8.91–8.95) | 575 | 610 | – | 2.2 | 3×10−20 | from decay | unknown phase |
| 86 | Rn | Radon | Radium emanation, originally the name of the isotope Radon-222 | 18 | 6 | p-block | [222] | 0.00973 | 202 | 211.3 | 0.094 | 2.2 | 4×10−13 | from decay | gas |
| 87 | Fr | Francium | France, home country of discoverer Marguerite Perey | 1 | 7 | s-block | [223] | (2.48) | 281 | 890 | – | >0.79 | ~ 1×10−18 | from decay | unknown phase |
| 88 | Ra | Radium | French radium, from Latin radius, 'ray' | 2 | 7 | s-block | [226] | 5.5 | 973 | 2010 | 0.094 | 0.9 | 9×10−7 | from decay | solid |
| 89 | Ac | Actinium | Greek aktís, 'ray' | f-block groups | 7 | f-block | [227] | 10 | 1323 | 3471 | 0.12 | 1.1 | 5.5×10−10 | from decay | solid |
| 90 | Th | Thorium | Thor, the Scandinavian god of thunder | f-block groups | 7 | f-block | 232.04 | 11.7 | 2115 | 5061 | 0.113 | 1.3 | 9.6 | primordial | solid |
| 91 | Pa | Protactinium | Proto- (from Greek prôtos, 'first, before') + actinium, since actinium is produced through the radioactive decay of protactinium | f-block groups | 7 | f-block | 231.04 | 15.37 | 1841 | 4300 | – | 1.5 | 1.4×10−6 | from decay | solid |
| 92 | U | Uranium | Uranus, the seventh planet in the Solar System | f-block groups | 7 | f-block | 238.03 | 19.1 | 1405.3 | 4404 | 0.116 | 1.38 | 2.7 | primordial | solid |
| 93 | Np | Neptunium | Neptune, the eighth planet in the Solar System | f-block groups | 7 | f-block | [237] | 20.45 | 917 | 4273 | – | 1.36 | ≤ 3×10−12 | from decay | solid |
| 94 | Pu | Plutonium | Pluto, a dwarf planet, considered a planet in the Solar System at the time | f-block groups | 7 | f-block | [244] | 19.85 | 912.5 | 3501 | – | 1.28 | ≤ 3×10−11 | from decay | solid |
| 95 | Am | Americium | The Americas, where the element was first synthesised, by analogy with its homologue § europium | f-block groups | 7 | f-block | [243] | 12 | 1449 | 2880 | – | 1.13 | – | synthetic | solid |
| 96 | Cm | Curium | Pierre Curie and Marie Curie, French physicists and chemists | f-block groups | 7 | f-block | [247] | 13.51 | 1613 | 3383 | – | 1.28 | – | synthetic | solid |
| 97 | Bk | Berkelium | Berkeley, California, where the element was first synthesised | f-block groups | 7 | f-block | [247] | 14.78 | 1259 | 2900 | – | 1.3 | – | synthetic | solid |
| 98 | Cf | Californium | California, where the element was first synthesised in the LBNL laboratory | f-block groups | 7 | f-block | [251] | 15.1 | 1173 | (1743) | – | 1.3 | – | synthetic | solid |
| 99 | Es | Einsteinium | Albert Einstein, German physicist | f-block groups | 7 | f-block | [252] | 8.84 | 1133 | (1269) | – | 1.3 | – | synthetic | solid |
| 100 | Fm | Fermium | Enrico Fermi, Italian physicist | f-block groups | 7 | f-block | [257] | (9.7) | (1125) (1800) |
– | – | 1.3 | – | synthetic | unknown phase |
| 101 | Md | Mendelevium | Dmitri Mendeleev, Russian chemist who proposed the periodic table | f-block groups | 7 | f-block | [258] | (10.3) | (1100) | – | – | 1.3 | – | synthetic | unknown phase |
| 102 | No | Nobelium | Alfred Nobel, Swedish chemist and engineer | f-block groups | 7 | f-block | [259] | (9.9) | (1100) | – | – | 1.3 | – | synthetic | unknown phase |
| 103 | Lr | Lawrencium | Ernest Lawrence, American physicist | 3 | 7 | d-block | [266] | (14.4) | (1900) | – | – | 1.3 | – | synthetic | unknown phase |
| 104 | Rf | Rutherfordium | Ernest Rutherford, chemist and physicist from New Zealand | 4 | 7 | d-block | [267] | (17) | (2400) | (5800) | – | – | – | synthetic | unknown phase |
| 105 | Db | Dubnium | Dubna, Russia, where the element was discovered in the JINR laboratory | 5 | 7 | d-block | [268] | (21.6) | – | – | – | – | – | synthetic | unknown phase |
| 106 | Sg | Seaborgium | Glenn T. Seaborg, American chemist | 6 | 7 | d-block | [269] | (23–24) | – | – | – | – | – | synthetic | unknown phase |
| 107 | Bh | Bohrium | Niels Bohr, Danish physicist | 7 | 7 | d-block | [270] | (26–27) | – | – | – | – | – | synthetic | unknown phase |
| 108 | Hs | Hassium | New Latin Hassia, 'Hesse', a state in Germany | 8 | 7 | d-block | [269] | (27–29) | – | – | – | – | – | synthetic | unknown phase |
| 109 | Mt | Meitnerium | Lise Meitner, Austrian physicist | 9 | 7 | d-block | [278] | (27–28) | – | – | – | – | – | synthetic | unknown phase |
| 110 | Ds | Darmstadtium | Darmstadt, Germany, where the element was first synthesised in the GSI laboratories | 10 | 7 | d-block | [281] | (26–27) | – | – | – | – | – | synthetic | unknown phase |
| 111 | Rg | Roentgenium | Wilhelm Conrad Röntgen, German physicist | 11 | 7 | d-block | [282] | (22–24) | – | – | – | – | – | synthetic | unknown phase |
| 112 | Cn | Copernicium | Nicolaus Copernicus, Polish astronomer | 12 | 7 | d-block | [285] | (14.0) | (283±11) | (340±10) | – | – | – | synthetic | unknown phase |
| 113 | Nh | Nihonium | Japanese Nihon, 'Japan', where the element was first synthesised in the Riken laboratories | 13 | 7 | p-block | [286] | (16) | (700) | (1400) | – | – | – | synthetic | unknown phase |
| 114 | Fl | Flerovium | Flerov Laboratory of Nuclear Reactions, part of JINR, where the element was synthesised; itself named after Georgy Flyorov, Russian physicist | 14 | 7 | p-block | [289] | (11.4±0.3) | (284±50) | – | – | – | – | synthetic | unknown phase |
| 115 | Mc | Moscovium | Moscow, Russia, where the element was first synthesised in the JINR laboratories | 15 | 7 | p-block | [290] | (13.5) | (700) | (1400) | – | – | – | synthetic | unknown phase |
| 116 | Lv | Livermorium | Lawrence Livermore National Laboratory in Livermore, California | 16 | 7 | p-block | [293] | (12.9) | (700) | (1100) | – | – | – | synthetic | unknown phase |
| 117 | Ts | Tennessine | Tennessee, United States, where Oak Ridge National Laboratory is located | 17 | 7 | p-block | [294] | (7.1–7.3) | (700) | (883) | – | – | – | synthetic | unknown phase |
| 118 | Og | Oganesson | Yuri Oganessian, Russian physicist | 18 | 7 | p-block | [294] | (7) | (325±15) | (450±10) | – | – | – | synthetic | unknown phase |
- ↑ a b c Peso atômico padrão
- '1.0080': valor resumido, incerteza ignorada aqui
- [97]', [ ] notation: número de massa do isótopo mais estável
- ↑ a b d e Valores em () suportes são previsões
- ^ Densidade (fontes)
- ^ Ponto de fusão em kelvin (K) (fontes)
- ^ Ponto de ebulição em kelvin (K) (fontes)
- ^ Capacidade de calor (fontes)
- ^ Eletronegatividade por Pauling (fonte)
- ^ Abundância de elementos na crosta terrestre
- ^ Primordial (=A origem da Terra), de decadência ou sintético
- ^ Fase em estado padrão (25 °C [77 °F], 100 kPa)
- ^ Ponto de fusão de hélio: hélio não solidifica a uma pressão de 1 bar (0,99 m). O hélio só pode solidificar a pressões acima de 25 atmosfera.
- ^ Arsênico: elemento sublime em uma atmosfera de pressão.
Contenido relacionado
Alessandro volta
Johannes Nicolaus Bronsted
Grupo funcional