Destilação

Destilação, ou destilação clássica, é o processo de separação dos componentes ou substâncias de uma mistura líquida usando fervura seletiva e condensação, geralmente dentro de um aparelho conhecido como alambique. A destilação seca é o aquecimento de materiais sólidos para produzir produtos gasosos (que podem condensar em líquidos ou sólidos); isso pode envolver alterações químicas, como destilação destrutiva ou craqueamento. A destilação pode resultar em separação essencialmente completa (resultando em componentes quase puros), ou pode ser uma separação parcial que aumenta a concentração de componentes selecionados; em ambos os casos, o processo explora diferenças na volatilidade relativa dos componentes da mistura. Em aplicações industriais, a destilação é uma operação unitária de importância praticamente universal, mas é um processo de separação física, não uma reação química. Uma instalação utilizada para a destilação, especialmente de bebidas destiladas, é uma destilaria. A destilação inclui as seguintes aplicações:
- A destilação de produtos fermentados produz bebidas destiladas com alto teor de álcool, ou separa outros produtos de fermentação de valor comercial.
- A destilação é um método eficaz e tradicional de dessalinização.
- Na indústria do petróleo, a estabilização do petróleo é uma forma de destilação parcial que reduz a pressão de vapor do petróleo bruto, tornando-o seguro para armazenamento e transporte, bem como reduzir as emissões atmosféricas de hidrocarbonetos voláteis. Em operações a médio prazo em refinarias de petróleo, a destilação fracionária é uma grande classe de operação para transformar o petróleo bruto em combustíveis e estoques de alimentos químicos.
- A destilação criogênica leva à separação do ar em seus componentes - nomeadamente oxigênio, nitrogênio e argônio - para uso industrial.
- Na indústria química, grandes quantidades de produtos líquidos brutos de síntese química são destilados para separá-los, seja de outros produtos, de impurezas, ou de materiais iniciais não reagidos.
História
As primeiras evidências de destilação foram encontradas em tabuletas acadianas datadas de c. 1200 aC descrevendo operações de perfumaria. As tabuinhas forneciam evidência textual de que uma forma antiga e primitiva de destilação era conhecida pelos babilônios da antiga Mesopotâmia. Evidências iniciais de destilação também foram encontradas relacionadas a alquimistas que trabalhavam em Alexandria, no Egito romano, no século I dC.
A destilação era praticada no antigo subcontinente indiano, o que é evidente nas retortas e receptores de argila cozida encontrados em Taxila, Shaikhan Dheri e Charsadda no Paquistão e Rang Mahal na Índia, datando dos primeiros séculos da Era Comum. Frank Raymond Allchin diz que esses tubos de destilação de terracota foram "feitos para imitar o bambu". Esses "alambiques de Gandhara" só eram capazes de produzir licor muito fraco, pois não havia meios eficientes de coletar os vapores em fogo baixo. A água destilada está em uso desde pelo menos c. 200 EC, quando Alexandre de Afrodisias descreveu o processo. O trabalho na destilação de outros líquidos continuou no início do Egito bizantino sob Zósimo de Panópolis no século III.
A destilação na China pode ter começado durante a dinastia Han Oriental (séculos I a II dC), mas a destilação de bebidas começou nas dinastias Jin (séculos XII a XIII) e Song do Sul (séculos X a XIII), de acordo com evidências arqueológicas.
Químicos muçulmanos medievais como Jābir ibn Ḥayyān (latim: Geber, século IX) e Abū Bakr al-Rāzī (latim: Rhazes, c. 865–925) experimentou extensivamente a destilação de várias substâncias.
A destilação do vinho é atestada em obras árabes atribuídas a al-Kindī (c. 801–873 EC) e para al-Fārābī (c. 872–950), e no século 28 livro de al-Zahrāwī's (latim: Abulcasis, 936–1013) Kitāb al-Taṣrīf código: ara promovido a código: ar (mais tarde traduzido para o latim como Liber servatoriscódigo: lat promovido a código: la ). No século XII, receitas para a produção de aqua ardenscódigo: lat promovido a código: la ("queimar água', ou seja, etanol) pela destilação do vinho com sal começou a aparecer em várias obras latinas e, no final do século XIII, tornou-se uma substância amplamente conhecida entre os químicos da Europa Ocidental. As obras de Taddeo Alderotti (1223–1296) descrevem um método para concentrar álcool envolvendo destilação repetida através de um alambique refrigerado a água, pelo qual uma pureza alcoólica de 90% pode ser obtida.
A destilação fracionada de substâncias orgânicas desempenha um papel importante nas obras atribuídas a Jābir, como no Kitāb al-Sabʿīn ('O Livro dos Setenta'), traduzido para o latim por Gerard de Cremona (c. 1114–1187) sob o título Liber de septuaginta. As experiências jabirianas com a destilação fracionada de substâncias animais e vegetais, e em menor grau também de substâncias minerais, é o tema principal do De anima in arte alkimiae, uma obra originalmente árabe falsamente atribuída a Avicena que foi traduzida para o latim e viria a formar a fonte alquímica mais importante para Roger Bacon (c. 1220–1292).
Um alambique foi encontrado em um sítio arqueológico em Qinglong, província de Hebei, China, datado do século XII. Bebidas destiladas eram comuns durante a dinastia Yuan (séculos 13 a 14).
Em 1500, o alquimista alemão Hieronymus Brunschwig publicou Liber de arte distillandi de simplicibuscódigo: lat promovido a código: la (O Livro da Arte da Destilação a partir de Ingredientes Simples), o primeiro livro exclusivamente dedicado ao tema da destilação, seguido em 1512 por uma versão bastante ampliada. Em 1651, John French publicou The Art of Distillation, o primeiro grande compêndio inglês sobre a prática, mas afirma-se que muito dele deriva do trabalho de Braunschweig. Isso inclui diagramas com pessoas mostrando a escala industrial da operação, em vez da escala de bancada.
À medida que a alquimia evoluiu para a ciência da química, recipientes chamados retortas passaram a ser usados para destilações. Tanto os alambiques quanto as retortas são formas de vidraria com gargalos longos apontando para o lado em um ângulo descendente para atuar como condensadores resfriados a ar para condensar o destilado e deixá-lo escorrer para baixo para coleta. Mais tarde, foram inventados os alambiques de cobre. As juntas rebitadas eram frequentemente mantidas apertadas usando várias misturas, por exemplo, uma massa feita de farinha de centeio. Esses alambiques muitas vezes apresentavam um sistema de resfriamento ao redor do bico, utilizando água fria, por exemplo, o que tornava a condensação do álcool mais eficiente. Estes eram chamados de alambiques. Hoje, as retortas e alambiques foram amplamente suplantados por métodos de destilação mais eficientes na maioria dos processos industriais. No entanto, o alambique ainda é muito utilizado para a elaboração de alguns álcoois finos, como conhaque, uísque escocês, uísque irlandês, tequila, rum, cachaça e algumas vodcas. Alambiques feitos de vários materiais (madeira, argila, aço inoxidável) também são usados por contrabandistas em vários países. Pequenos alambiques também são vendidos para uso na produção doméstica de água para flores ou óleos essenciais.
As primeiras formas de destilação envolviam processos em lote usando uma vaporização e uma condensação. A pureza foi melhorada por destilação adicional do condensado. Volumes maiores foram processados simplesmente repetindo a destilação. Os químicos supostamente realizaram de 500 a 600 destilações para obter um composto puro.
No início do século XIX, foram desenvolvidas as bases das técnicas modernas, incluindo pré-aquecimento e refluxo. Em 1822, Anthony Perrier desenvolveu um dos primeiros alambiques contínuos e, em 1826, Robert Stein aprimorou esse projeto para fazer sua patente ainda. Em 1830, Aeneas Coffey obteve uma patente para melhorar ainda mais o design. O alambique contínuo da Coffey pode ser considerado o arquétipo das unidades petroquímicas modernas. O engenheiro francês Armand Savalle desenvolveu seu regulador de vapor por volta de 1846. Em 1877, Ernest Solvay obteve uma patente nos Estados Unidos para uma coluna de bandeja para destilação de amônia, e no mesmo ano e nos anos subsequentes houve desenvolvimentos neste tema para óleos e bebidas espirituosas.
Com o surgimento da engenharia química como disciplina no final do século XIX, métodos científicos em vez de empíricos puderam ser aplicados. A indústria do petróleo em desenvolvimento no início do século 20 forneceu o ímpeto para o desenvolvimento de métodos de projeto precisos, como o método McCabe-Thiele de Ernest Thiele e a equação de Fenske. A primeira planta industrial nos Estados Unidos a usar a destilação como meio de dessalinização do oceano foi inaugurada em Freeport, Texas, em 1961, com a esperança de trazer segurança hídrica para a região. A disponibilidade de computadores poderosos permitiu simulações diretas em computador de colunas de destilação.
Aplicativos
A aplicação da destilação pode ser dividida em quatro grupos: escala de laboratório, destilação industrial, destilação de ervas para perfumaria e medicamentos (destilado de ervas) e processamento de alimentos. Os dois últimos são distintamente diferentes dos dois anteriores, pois a destilação não é usada como um verdadeiro método de purificação, mas sim para transferir todos os voláteis dos materiais de origem para o destilado no processamento de bebidas e ervas.
A principal diferença entre a destilação em escala de laboratório e a destilação industrial é que a destilação em escala de laboratório geralmente é realizada em lotes, enquanto a destilação industrial geralmente ocorre continuamente. Na destilação em lote, a composição do material de origem, os vapores dos compostos de destilação e o destilado mudam durante a destilação. Na destilação em batelada, um alambique é carregado (fornecido) com uma batelada de mistura de alimentação, que é então separada em suas frações componentes, que são coletadas sequencialmente da mais volátil para a menos volátil, com o fundo – fração remanescente menos volátil ou não volátil – removido no final. O alambique pode então ser recarregado e o processo repetido.
Na destilação contínua, os materiais de origem, vapores e destilados são mantidos em uma composição constante, reabastecendo cuidadosamente o material de origem e removendo frações de vapor e líquido no sistema. Isso resulta em um controle mais detalhado do processo de separação.
Modelo idealizado
O ponto de ebulição de um líquido é a temperatura na qual a pressão de vapor do líquido se iguala à pressão ao redor do líquido, permitindo a formação de bolhas sem serem esmagadas. Um caso especial é o ponto de ebulição normal, onde a pressão de vapor do líquido é igual à pressão atmosférica ambiente.
É um equívoco pensar que em uma mistura líquida a uma determinada pressão, cada componente ferve no ponto de ebulição correspondente à determinada pressão, permitindo que os vapores de cada componente se acumulem separadamente e de forma pura. No entanto, isso não ocorre, mesmo em um sistema idealizado. Modelos idealizados de destilação são essencialmente governados pela lei de Raoult e pela lei de Dalton e assumem que o equilíbrio vapor-líquido é alcançado.
A lei de Raoult afirma que a pressão de vapor de uma solução depende 1) da pressão de vapor de cada componente químico na solução e 2) da fração da solução que cada componente compõe, também conhecida como fração molar. Essa lei se aplica a soluções ideais, ou soluções que possuem componentes diferentes, mas cujas interações moleculares são as mesmas ou muito semelhantes às soluções puras.
A lei de Dalton afirma que a pressão total é a soma das pressões parciais de cada componente individual na mistura. Quando um líquido multicomponente é aquecido, a pressão de vapor de cada componente aumenta, fazendo com que a pressão de vapor total aumente. Quando a pressão de vapor total atinge a pressão ao redor do líquido, ocorre a ebulição e o líquido se transforma em gás em todo o volume do líquido. Uma mistura com uma dada composição tem um ponto de ebulição a uma dada pressão quando os componentes são mutuamente solúveis. Uma mistura de composição constante não tem múltiplos pontos de ebulição.
Uma implicação de um ponto de ebulição é que os componentes mais leves nunca "fervem primeiro". No ponto de ebulição, todos os componentes voláteis fervem, mas para um componente, sua porcentagem no vapor é a mesma que sua porcentagem na pressão total de vapor. Os componentes mais leves têm uma pressão parcial maior e, portanto, estão concentrados no vapor, mas os componentes voláteis mais pesados também têm uma pressão parcial (menor) e necessariamente também vaporizam, embora em menor concentração no vapor. De fato, a destilação e o fracionamento em batelada são bem-sucedidos ao variar a composição da mistura. Na destilação em batelada, a batelada vaporiza, o que muda sua composição; no fracionamento, o líquido mais alto na coluna de fracionamento contém mais luzes e ferve a temperaturas mais baixas. Portanto, a partir de uma determinada mistura, parece ter um intervalo de ebulição em vez de um ponto de ebulição, embora isso ocorra porque sua composição muda: cada mistura intermediária tem seu próprio ponto de ebulição singular.
O modelo idealizado é preciso no caso de líquidos quimicamente semelhantes, como benzeno e tolueno. Em outros casos, desvios severos da lei de Raoult e da lei de Dalton são observados, principalmente na mistura de etanol e água. Esses compostos, quando aquecidos juntos, formam um azeótropo, que é quando a fase vapor e a fase líquida possuem a mesma composição. Embora existam métodos computacionais que podem ser usados para estimar o comportamento de uma mistura de componentes arbitrários, a única maneira de obter dados precisos de equilíbrio vapor-líquido é por medição.
Não é possível purificar completamente uma mistura de componentes por destilação, pois isso exigiria que cada componente da mistura tivesse uma pressão parcial zero. Se o objetivo for produtos ultrapuros, a separação química adicional deve ser aplicada. Quando uma mistura binária é vaporizada e o outro componente, por exemplo, um sal, tem pressão parcial zero para fins práticos, o processo é mais simples.
Batch ou destilação diferencial
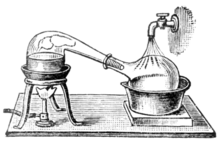
Aquecer uma mistura ideal de duas substâncias voláteis, A e B, com A tendo a maior volatilidade ou ponto de ebulição mais baixo, em uma configuração de destilação em lote (como em um aparelho representado na figura de abertura) até que a mistura esteja fervendo resulta em um vapor acima do líquido que contém uma mistura de A e B. A razão entre A e B no vapor será diferente da razão no líquido. A proporção no líquido será determinada pela forma como a mistura original foi preparada, enquanto a proporção no vapor será enriquecida no composto mais volátil, A (devido à Lei de Raoult, veja acima). O vapor passa pelo condensador e é removido do sistema. Isso, por sua vez, significa que a proporção de compostos no líquido restante agora é diferente da proporção inicial (ou seja, mais enriquecida em B do que no líquido inicial).
O resultado é que a proporção na mistura líquida está mudando, tornando-se mais rica no componente B. Isso faz com que o ponto de ebulição da mistura suba, o que resulta em um aumento na temperatura do vapor, o que resulta em uma mudança proporção de A: B na fase gasosa (à medida que a destilação continua, há uma proporção crescente de B na fase gasosa). Isso resulta em uma proporção de mudança lenta de A: B no destilado.
Se a diferença na pressão de vapor entre os dois componentes A e B for grande – geralmente expressa como a diferença nos pontos de ebulição – a mistura no início da destilação é altamente enriquecida no componente A, e quando o componente A tiver destilado, o líquido em ebulição é enriquecido no componente B.
Destilação contínua
A destilação contínua é uma destilação contínua na qual uma mistura líquida é continuamente (sem interrupção) alimentada no processo e as frações separadas são removidas continuamente à medida que os fluxos de saída ocorrem ao longo do tempo durante a operação. A destilação contínua produz um mínimo de duas frações de saída, incluindo pelo menos uma fração de destilado volátil, que ferveu e foi capturada separadamente como um vapor e depois condensada em um líquido. Há sempre uma fração de fundo (ou resíduo), que é o resíduo menos volátil que não foi capturado separadamente como um vapor condensado.
A destilação contínua difere da destilação em batelada no que diz respeito ao fato de que as concentrações não devem mudar ao longo do tempo. A destilação contínua pode ser executada em estado estacionário por um período de tempo arbitrário. Para qualquer material de origem de composição específica, as principais variáveis que afetam a pureza dos produtos em destilação contínua são a taxa de refluxo e o número de estágios teóricos de equilíbrio, na prática determinados pelo número de bandejas ou pela altura do empacotamento. O refluxo é um fluxo do condensador de volta para a coluna, que gera um reciclo que permite uma melhor separação com um determinado número de bandejas. Os estágios de equilíbrio são etapas ideais onde as composições atingem o equilíbrio líquido-vapor, repetindo o processo de separação e permitindo uma melhor separação dada uma taxa de refluxo. Uma coluna com alta taxa de refluxo pode ter menos estágios, mas faz o refluxo de uma grande quantidade de líquido, resultando em uma coluna larga com grande retenção. Por outro lado, uma coluna com baixa taxa de refluxo deve ter um grande número de estágios, exigindo assim uma coluna mais alta.
Melhorias gerais
Tanto a destilação em batelada quanto a contínua podem ser melhoradas com o uso de uma coluna de fracionamento no topo do balão de destilação. A coluna melhora a separação fornecendo uma área de superfície maior para o vapor e o condensado entrarem em contato. Isso ajuda a manter o equilíbrio pelo maior tempo possível. A coluna pode até mesmo consistir em pequenos subsistemas ('bandejas' ou 'pratos') que contêm uma mistura líquida enriquecida em ebulição, todos com seu próprio equilíbrio vapor-líquido.
Existem diferenças entre colunas de fracionamento em escala de laboratório e em escala industrial, mas os princípios são os mesmos. Exemplos de colunas de fracionamento em escala de laboratório (para aumentar a eficiência) incluem
- Condensador de ar
- Coluna de Vigreux (geralmente escala de laboratório apenas)
- Coluna embalada (embalada com contas de vidro, peças de metal ou outro material quimicamente inerte)
- Sistema de destilação de banda girando.
Procedimentos laboratoriais
As destilações em escala de laboratório são quase exclusivamente executadas como destilações em lote. O dispositivo usado na destilação, às vezes chamado de destilador, consiste no mínimo em um reaquecedor ou pote no qual o material de origem é aquecido, um condensador no qual o material aquecido o vapor é resfriado de volta ao estado líquido e um receptor no qual o líquido concentrado ou purificado, chamado destilado, é coletado. Existem várias técnicas de escala de laboratório para destilação (ver também tipos de destilação).
Um aparelho de destilação completamente selado pode sofrer pressões internas extremas e de rápida variação, o que pode fazer com que ele se abra nas juntas. Portanto, algum caminho geralmente é deixado aberto (por exemplo, no frasco receptor) para permitir que a pressão interna se iguale à pressão atmosférica. Em alternativa, pode ser utilizada uma bomba de vácuo para manter o aparelho a uma pressão inferior à atmosférica. Se as substâncias envolvidas forem sensíveis ao ar ou à umidade, a conexão com a atmosfera pode ser feita através de um ou mais tubos de secagem embalados com materiais que removem os componentes indesejados do ar, ou através de borbulhadores que fornecem uma barreira móvel para líquidos. Finalmente, a entrada de componentes de ar indesejados pode ser evitada bombeando um fluxo baixo, mas constante, de gás inerte adequado, como nitrogênio, para dentro do aparelho.
Destilação simples
Na destilação simples, o vapor é imediatamente canalizado para um condensador. Conseqüentemente, o destilado não é puro, mas sim sua composição é idêntica à composição dos vapores na temperatura e pressão dadas. Essa concentração segue a lei de Raoult.
Como resultado, a destilação simples é eficaz apenas quando os pontos de ebulição do líquido diferem muito (a regra geral é 25°C) ou ao separar líquidos de sólidos não voláteis ou óleos. Para esses casos, as pressões de vapor dos componentes geralmente são diferentes o suficiente para que o destilado seja suficientemente puro para a finalidade a que se destina.
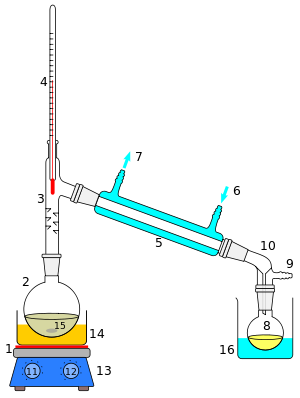
Um esquema de corte de uma operação de destilação simples é mostrado à direita. O líquido inicial 15 no balão de ebulição 2 é aquecido por uma placa de aquecimento combinada e um agitador magnético 13 por meio de um banho de óleo de silicone (laranja, 14). O vapor flui por uma curta coluna de Vigreux 3, depois por um condensador de Liebig 5, é resfriado por água (azul) que circula pelas portas 6 e 7. O líquido condensado pinga no frasco receptor 8, assentado em um banho de resfriamento (azul, 16). O adaptador 10 tem uma conexão 9 que pode ser encaixada em uma bomba de vácuo. Os componentes são conectados por juntas de vidro esmerilado.
Destilação fracionada
Em muitos casos, os pontos de ebulição dos componentes da mistura serão tão próximos que a lei de Raoult deve ser levada em consideração. Portanto, a destilação fracionada deve ser usada para separar os componentes por ciclos repetidos de vaporização-condensação dentro de uma coluna de fracionamento empacotada. Essa separação, por destilações sucessivas, também é chamada de retificação.
À medida que a solução a ser purificada é aquecida, seus vapores sobem para a coluna de fracionamento. À medida que sobe, esfria, condensando-se nas paredes do condensador e nas superfícies do material de embalagem. Aqui, o condensado continua a ser aquecido pelos vapores quentes ascendentes; vaporiza mais uma vez. No entanto, a composição dos vapores frescos é determinada mais uma vez pela lei de Raoult. Cada ciclo de vaporização-condensação (chamado de placa teórica) produzirá uma solução mais pura do componente mais volátil. Na realidade, cada ciclo a uma determinada temperatura não ocorre exatamente na mesma posição na coluna de fracionamento; placa teórica é, portanto, um conceito e não uma descrição precisa.
Mais placas teóricas levam a melhores separações. Um sistema de destilação por banda giratória usa uma banda giratória de Teflon ou metal para forçar os vapores ascendentes a entrarem em contato próximo com o condensado descendente, aumentando o número de placas teóricas.
Destilação a vapor
Assim como a destilação a vácuo, a destilação a vapor é um método para destilar compostos sensíveis ao calor. A temperatura do vapor é mais fácil de controlar do que a superfície de um elemento de aquecimento e permite uma alta taxa de transferência de calor sem aquecer a uma temperatura muito alta. Este processo envolve borbulhar vapor através de uma mistura aquecida da matéria-prima. Pela lei de Raoult, parte do composto alvo irá vaporizar (de acordo com sua pressão parcial). A mistura de vapor é resfriada e condensada, geralmente produzindo uma camada de óleo e uma camada de água.
A destilação a vapor de várias ervas e flores aromáticas pode resultar em dois produtos; um óleo essencial, bem como um destilado de ervas aquoso. Os óleos essenciais são freqüentemente usados em perfumaria e aromaterapia, enquanto os destilados aquosos têm muitas aplicações em aromaterapia, processamento de alimentos e cuidados com a pele.

- Barra de Stirrer / grânulos anti-bumping
- Ainda bem.
- Coluna de fracionamento
- Temperatura do ponto de termômetro/ferrugamento
- Toque de teflon 1
- Dedo frio
- Água de resfriamento para fora
- Água de refrigeração em
- Toque de teflon 2
- Entrada de vácuo/gás
- Toque de pano 3
- Ainda receptor
Destilação a vácuo
Alguns compostos têm pontos de ebulição muito altos. Para ferver esses compostos, geralmente é melhor diminuir a pressão na qual esses compostos são fervidos em vez de aumentar a temperatura. Uma vez que a pressão é reduzida para a pressão de vapor do composto (na temperatura dada), a fervura e o resto do processo de destilação podem começar. Essa técnica é chamada de destilação a vácuo e é comumente encontrada em laboratório na forma de evaporador rotativo.
Esta técnica também é muito útil para compostos que fervem além de sua temperatura de decomposição à pressão atmosférica e que, portanto, seriam decompostos por qualquer tentativa de fervê-los à pressão atmosférica.
Caminho curto e destilação molecular
A destilação molecular é a destilação a vácuo abaixo da pressão de 0,01 torr. 0,01 torr é uma ordem de grandeza acima do alto vácuo, onde os fluidos estão no regime de fluxo molecular livre, ou seja, o caminho livre médio das moléculas é comparável ao tamanho do equipamento. A fase gasosa não exerce mais pressão significativa sobre a substância a ser evaporada e, conseqüentemente, a taxa de evaporação não depende mais da pressão. Isto é, porque as suposições contínuas da dinâmica dos fluidos não se aplicam mais, o transporte de massa é governado pela dinâmica molecular em vez da dinâmica dos fluidos. Assim, é necessário um caminho curto entre a superfície quente e a superfície fria, normalmente suspendendo uma placa quente coberta com uma película de alimentação próxima a uma placa fria com uma linha de visão intermediária. A destilação molecular é usada industrialmente para purificação de óleos.
- Ainda pote com barra de agitação / grânulos anti-bumping
- Dedo frio – dobrado para condensado direto
- Água de resfriamento para fora
- água de refrigeração
- Entrada de vácuo/gás
- Flask destilado / destilado.
A destilação de caminho curto é uma técnica de destilação que envolve o destilado percorrendo uma curta distância, muitas vezes apenas alguns centímetros, e normalmente é feito a pressão reduzida. Um exemplo clássico seria uma destilação envolvendo o destilado passando de um bulbo de vidro para outro, sem a necessidade de um condensador separando as duas câmaras. Esta técnica é freqüentemente usada para compostos que são instáveis em altas temperaturas ou para purificar pequenas quantidades de compostos. A vantagem é que a temperatura de aquecimento pode ser consideravelmente menor (a pressão reduzida) do que o ponto de ebulição do líquido à pressão padrão, e o destilado só precisa percorrer uma curta distância antes de condensar. Um caminho curto garante que pouco composto seja perdido nas laterais do aparelho. O aparelho Kugelrohr é um tipo de método de destilação de caminho curto que geralmente contém múltiplas câmaras para coletar frações destiladas.
Destilação a vácuo sensível ao ar
Alguns compostos têm pontos de ebulição altos, além de serem sensíveis ao ar. Pode ser usado um sistema de destilação a vácuo simples, conforme exemplificado acima, em que o vácuo é substituído por um gás inerte após a conclusão da destilação. No entanto, este é um sistema menos satisfatório se se deseja coletar frações sob pressão reduzida. Para fazer isso, uma "vaca" ou "porco" adaptador pode ser adicionado ao final do condensador, ou para melhores resultados ou para compostos muito sensíveis ao ar, um aparelho de triângulo Perkin pode ser usado.
O triângulo Perkin, tem meios através de uma série de torneiras de vidro ou Teflon para permitir que as frações sejam isoladas do resto do alambique, sem que o corpo principal da destilação seja removido do vácuo ou da fonte de calor, e assim pode permanecer em estado de refluxo. Para fazer isso, a amostra é primeiro isolada do vácuo por meio das torneiras, o vácuo sobre a amostra é então substituído por um gás inerte (como nitrogênio ou argônio) e pode então ser tampado e removido. Um novo recipiente de coleta pode então ser adicionado ao sistema, evacuado e conectado de volta ao sistema de destilação através das torneiras para coletar uma segunda fração e assim por diante, até que todas as frações tenham sido coletadas.
Destilação de zona
A destilação por zona é um processo de destilação em um recipiente longo com fusão parcial de matéria refinada na zona líquida em movimento e condensação de vapor na fase sólida na extração de condensado na área fria. O processo é trabalhado na teoria. Quando o aquecedor de zona está se movendo de cima para baixo do recipiente, forma-se um condensado sólido com distribuição irregular de impurezas. Então a parte mais pura do condensado pode ser extraída como produto. O processo pode ser repetido muitas vezes movendo (sem rotatividade) o condensado recebido para a parte inferior do recipiente no lugar da matéria refinada. A distribuição irregular de impurezas no condensado (que é a eficiência da purificação) aumenta com o número de iterações. A destilação de zona é o análogo de destilação da recristalização de zona. A distribuição de impurezas no condensado é descrita por equações conhecidas de zona de recristalização – com a substituição do coeficiente de distribuição k de cristalização – pelo fator de separação α de destilação.
Destilação a vácuo em sistema fechado (cryovap)
Gás não condensável pode ser expelido do aparelho pelo vapor de co-solvente relativamente volátil, que evapora espontaneamente durante o bombeamento inicial, e isso pode ser obtido com óleo regular ou bomba de diafragma.
Outros tipos
- O processo de destilação reativa envolve o uso do vaso de reação como o ainda. Neste processo, o produto geralmente é significativamente mais baixo do que seus reagentes. Como o produto é formado a partir dos reagentes, é vaporizado e removido da mistura de reação. Esta técnica é um exemplo de um processo contínuo contra um lote; vantagens incluem menos tempo de inatividade para carregar o vaso de reação com material inicial, e menos workup. A destilação "sobre um reagente" pode ser classificada como uma destilação reativa. É tipicamente usado para remover a impureza volátil do feed de distalação. Por exemplo, um pouco de cal pode ser adicionado para remover o dióxido de carbono da água seguido por uma segunda destilação com um pouco de ácido sulfúrico adicionado para remover vestígios de amônia.
- A destilação catalítica é o processo pelo qual os reagentes são catalisados enquanto são destilados para separar continuamente os produtos dos reagentes. Este método é usado para ajudar as reações de equilíbrio em alcançar a conclusão.
- Pervaporação é um método para a separação de misturas de líquidos por vaporização parcial através de uma membrana não porosa.
- A destilação extrativa é definida como destilação na presença de um componente miscível, de alta fervura, relativamente não volátil, o solvente, que não forma azeotrope com os outros componentes na mistura.
- A evaporação do flash (ou evaporação parcial) é a vaporização parcial que ocorre quando um fluxo líquido saturado sofre uma redução da pressão, passando por uma válvula de aceleração ou outro dispositivo de aceleração. Este processo é uma das operações unitárias mais simples, sendo equivalente a uma destilação com apenas uma etapa de equilíbrio.
- A destilação é destilação que é realizada em misturas em que os dois compostos não são miscíveis. No laboratório, o aparelho Dean-Stark é usado com esta finalidade para remover a água de produtos de síntese. O aparelho Bleidner é outro exemplo com dois solventes de refluxo.
- A destilação da membrana é um tipo de destilação em que os vapores de uma mistura a ser separada são passados através de uma membrana, que seletivamente permeia um componente da mistura. A diferença de pressão de vapor é a força motriz. Tem aplicações potenciais na dessalinização da água do mar e na remoção de componentes orgânicos e inorgânicos.
O processo unitário de evaporação também pode ser chamado de "destilação":
- Na evaporação rotativa, um aparelho de destilação a vácuo é usado para remover solventes a granel de uma amostra. Tipicamente, o vácuo é gerado por um aspirador de água ou uma bomba de membrana.
- Em um aparelho Kugelrohr um aparelho de destilação de caminho curto é tipicamente usado (geralmente em combinação com um vácuo (alto) para destilar compostos de ebulição alta (> 300 °C). O aparelho consiste em um forno em que o composto a ser destilado é colocado, uma parte receptora que está fora do forno, e um meio de girar a amostra. O vácuo é normalmente gerado usando uma bomba de vácuo alta.
Outras utilizações:
- A destilação a seco ou a destilação destrutiva, apesar do nome, não é verdadeiramente destilação, mas sim uma reação química conhecida como pirólise em que substâncias sólidas são aquecidas em uma atmosfera inerte ou reduzindo e quaisquer frações voláteis, contendo líquidos de alto teor e produtos de pirólise, são coletadas. A destilação destrutiva de madeira para dar metanol é a raiz do seu nome comum – álcool de madeira.
- A destilação de congelação é um método análogo de purificação usando congelamento em vez de evaporação. Não é realmente destilação, mas uma recristalização onde o produto é o licor mãe, e não produz produtos equivalentes à destilação. Este processo é usado na produção de cerveja de gelo e vinho de gelo para aumentar o teor de etanol e açúcar, respectivamente. Também é usado para produzir applejack. Ao contrário da destilação, a destilação congelada concentra congéneres venenosos em vez de removê-los; Como resultado, muitos países proíbem tal maçã como uma medida de saúde. Além disso, a destilação por evaporação pode separá-los desde que têm diferentes pontos de ebulição.
- Destilação por filtração: Na alquimia precoce e química, conhecida como filosofia natural, uma forma de "distillação" por filtração capilar era conhecida como uma forma de destilação na época. Neste, uma série de copos ou tigelas foram colocadas em cima de um suporte pisado com um "wick" de algodão ou material semelhante a feltro, que tinha sido molhado com água ou um líquido claro com cada passo gotejando para baixo através do pano molhado através da ação capilar em etapas sucessivas, criando uma "purificação" do líquido, deixando materiais sólidos para trás nas tigelas superiores e purificando o produto sucedendo através da ação capilar através do pano úmido. Isso foi chamado de "distillatio" por filtração por aqueles que usam o método.
Processo azeotrópico
As interações entre os componentes da solução criam propriedades únicas para a solução, pois a maioria dos processos envolve misturas não ideais, onde a lei de Raoult não é válida. Tais interações podem resultar em um azeotropo de ebulição constante que se comporta como se fosse um composto puro (ou seja, ferve em uma única temperatura em vez de em um intervalo). Em um azeótropo, a solução contém o componente dado na mesma proporção que o vapor, de modo que a evaporação não altera a pureza e a destilação não efetua a separação. Por exemplo, álcool etílico e água formam um azeótropo de 95,6% a 78,1°C.
Se o azeótropo não for considerado suficientemente puro para uso, existem algumas técnicas para quebrar o azeótropo para dar um destilado puro. Este conjunto de técnicas é conhecido como destilação azeotrópica. Algumas técnicas conseguem isso "pulando" sobre a composição azeotrópica (adicionando outro componente para criar um novo azeótropo, ou variando a pressão). Outros trabalham removendo ou sequestrando química ou fisicamente a impureza. Por exemplo, para purificar o etanol além de 95%, um agente de secagem (ou dessecante, como carbonato de potássio) pode ser adicionado para converter a água solúvel em água insolúvel de cristalização. As peneiras moleculares também são frequentemente usadas para esse fim.
Líquidos imiscíveis, como água e tolueno, formam facilmente azeótropos. Comumente, esses azeótropos são referidos como um azeótropo de baixo ponto de ebulição porque o ponto de ebulição do azeótropo é menor do que o ponto de ebulição de qualquer um dos componentes puros. A temperatura e a composição do azeótropo são facilmente previstas a partir da pressão de vapor dos componentes puros, sem o uso da lei de Raoult. O azeótropo é facilmente quebrado em uma configuração de destilação usando um separador líquido-líquido (um decantador) para separar as duas camadas líquidas que são condensadas no topo. Apenas uma das duas camadas de líquido é refluída para a configuração de destilação.
Também existem azeótropos de alto ponto de ebulição, como uma mistura de 20% em peso de ácido clorídrico em água. Como está implícito no nome, o ponto de ebulição do azeótropo é maior que o ponto de ebulição de qualquer um dos componentes puros.
Para quebrar destilações azeotrópicas e ultrapassar os limites da destilação, como no Problema DeRosier, é necessário aumentar a composição da chave de luz no destilado.
Quebrando um azeótropo com manipulação de pressão unidirecional
Os pontos de ebulição dos componentes em um azeótropo se sobrepõem para formar uma banda. Ao expor um azeótropo a um vácuo ou pressão positiva, é possível desviar o ponto de ebulição de um componente para longe do outro, explorando as diferentes curvas de pressão de vapor de cada um; as curvas podem se sobrepor no ponto azeotrópico, mas é improvável que permaneçam idênticas ao longo do eixo de pressão para qualquer lado do ponto azeotrópico. Quando o viés é grande o suficiente, os dois pontos de ebulição não se sobrepõem e a banda azeotrópica desaparece.
Este método pode eliminar a necessidade de adicionar outros produtos químicos a uma destilação, mas tem duas desvantagens potenciais.
Sob pressão negativa, é necessária energia para uma fonte de vácuo e os pontos de ebulição reduzidos dos destilados exigem que o condensador funcione em temperatura mais baixa para evitar que os vapores do destilado sejam perdidos para a fonte de vácuo. O aumento das demandas de resfriamento geralmente exigirá energia adicional e possivelmente novos equipamentos ou uma troca de refrigerante.
Alternativamente, se forem necessárias pressões positivas, a vidraria padrão não pode ser usada, a energia deve ser usada para pressurização e há uma chance maior de ocorrerem reações colaterais na destilação, como decomposição, devido às temperaturas mais altas necessárias para efetuar ebulição.
Uma destilação unidirecional dependerá de uma mudança de pressão em uma direção, positiva ou negativa.
Destilação com oscilação de pressão
A destilação com oscilação de pressão é essencialmente a mesma que a destilação unidirecional usada para quebrar misturas azeotrópicas, mas aqui podem ser empregadas pressões positivas e negativas.
Isso melhora a seletividade da destilação e permite que um químico otimize a destilação evitando extremos de pressão e temperatura que desperdiçam energia. Isto é particularmente importante em aplicações comerciais.
Um exemplo da aplicação da destilação com oscilação de pressão é durante a purificação industrial do acetato de etila após sua síntese catalítica a partir do etanol.
Processo industrial
Aplicações de destilação industrial em grande escala incluem destilação em lote e fracionada contínua, a vácuo, azeotrópica, extrativa e a vapor. As aplicações industriais mais amplamente utilizadas de destilação fracionada contínua em estado estacionário são em refinarias de petróleo, plantas petroquímicas e químicas e plantas de processamento de gás natural.
Para controlar e otimizar essa destilação industrial, um método de laboratório padronizado, ASTM D86, é estabelecido. Este método de teste se estende à destilação atmosférica de produtos petrolíferos usando uma unidade de destilação em lote de laboratório para determinar quantitativamente as características da faixa de ebulição de produtos petrolíferos.
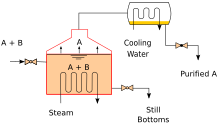
A destilação industrial é normalmente realizada em grandes colunas cilíndricas verticais conhecidas como torres de destilação ou colunas de destilação com diâmetros que variam de cerca de 0,65 a 16 metros (2 ft 2 in a 52 ft 6 in) e alturas que variam de cerca de 6 a 90 metros (20 a 295 pés) ou mais. Quando a alimentação do processo tem uma composição diversa, como na destilação de petróleo bruto, saídas de líquido em intervalos acima da coluna permitem a retirada de diferentes frações ou produtos com diferentes pontos de ebulição ou faixas de ebulição. O "mais leve" produtos (aqueles com o menor ponto de ebulição) saem do topo das colunas e os "mais pesados" os produtos (aqueles com o ponto de ebulição mais alto) saem do fundo da coluna e geralmente são chamados de fundos.
As torres industriais utilizam o refluxo para conseguir uma separação mais completa dos produtos. O refluxo refere-se à porção do produto líquido superior condensado de uma torre de destilação ou fracionamento que é devolvido à parte superior da torre, conforme mostrado no diagrama esquemático de uma torre de destilação industrial típica de grande escala. Dentro da torre, o líquido de refluxo descendente fornece resfriamento e condensação dos vapores ascendentes, aumentando assim a eficiência da torre de destilação. Quanto mais refluxo for fornecido para um determinado número de pratos teóricos, melhor será a separação da torre de materiais de baixo ponto de ebulição dos materiais de alto ponto de ebulição. Alternativamente, quanto mais refluxo for fornecido para uma determinada separação desejada, menor será o número de placas teóricas necessárias. Os engenheiros químicos devem escolher qual combinação de taxa de refluxo e número de placas é econômica e fisicamente viável para os produtos purificados na coluna de destilação.
Essas torres de fracionamento industrial também são usadas na separação de ar criogênico, produzindo oxigênio líquido, nitrogênio líquido e argônio de alta pureza. A destilação de clorossilanos também permite a produção de silício de alta pureza para uso como semicondutor.
O projeto e a operação de uma torre de destilação dependem da alimentação e dos produtos desejados. Dada uma alimentação de componente binária simples, métodos analíticos como o método de McCabe-Thiele ou a equação de Fenske podem ser usados. Para uma alimentação multicomponente, modelos de simulação são usados tanto para projeto quanto para operação. Além disso, a eficiência dos dispositivos de contato vapor-líquido (referidos como "placas" ou "bandejas") usados em torres de destilação são tipicamente menores do que em um estágio de equilíbrio teórico de 100% de eficiência. Portanto, uma torre de destilação precisa de mais bandejas do que o número teórico de estágios de equilíbrio líquido-vapor. Uma variedade de modelos foi postulada para estimar a eficiência da bandeja.
Nos usos industriais modernos, um material de enchimento é usado na coluna em vez de bandejas quando são necessárias baixas quedas de pressão na coluna. Outros fatores que favorecem o empacotamento são: sistemas de vácuo, colunas de menor diâmetro, sistemas corrosivos, sistemas propensos à formação de espuma, sistemas que requerem baixa retenção de líquido e destilação em batelada. Por outro lado, os fatores que favorecem as colunas de placas são: presença de sólidos na alimentação, altas taxas de líquido, grandes diâmetros de coluna, colunas complexas, colunas com ampla variação na composição da alimentação, colunas com reação química, colunas de absorção, colunas limitadas pela tolerância de peso da fundação, baixo taxa de líquido, grande taxa de turn-down e os processos sujeitos a picos de processo.
Este material de embalagem pode ser embalagem despejada aleatoriamente (25 a 76 milímetros (1 a 3 pol.) De largura), como anéis de Raschig ou chapas metálicas estruturadas. Os líquidos tendem a molhar a superfície do recheio e os vapores passam por essa superfície molhada, onde ocorre a transferência de massa. Ao contrário da destilação de bandeja convencional em que cada bandeja representa um ponto separado de equilíbrio líquido-vapor, a curva de equilíbrio líquido-vapor em uma coluna empacotada é contínua. No entanto, ao modelar colunas empacotadas, é útil calcular uma série de "estágios teóricos" para denotar a eficiência de separação da coluna empacotada em relação às bandejas mais tradicionais. Gaxetas de formas diferentes têm diferentes áreas de superfície e espaços vazios entre as gaxetas. Esses dois fatores afetam o desempenho da embalagem.
Outro fator além da forma do empacotamento e da área de superfície que afeta o desempenho do empacotamento aleatório ou estruturado é a distribuição de líquido e vapor que entra no leito empacotado. O número de estágios teóricos necessários para fazer uma determinada separação é calculado usando uma proporção específica de vapor para líquido. Se o líquido e o vapor não forem distribuídos uniformemente pela área superficial da torre ao entrar no leito empacotado, a relação líquido/vapor não será correta no leito empacotado e a separação necessária não será alcançada. A embalagem parecerá não estar funcionando corretamente. A altura equivalente a uma placa teórica (HETP) será maior do que o esperado. O problema não é o empacotamento em si, mas a má distribuição dos fluidos que entram no leito empacotado. A má distribuição de líquidos é mais frequentemente o problema do que o vapor. O projeto dos distribuidores de líquido utilizados para introduzir a alimentação e o refluxo em um leito empacotado é fundamental para que o enchimento funcione com a máxima eficiência. Os métodos de avaliação da eficácia de um distribuidor de líquido para distribuir uniformemente o líquido que entra em um leito compactado podem ser encontrados nas referências. Um trabalho considerável foi feito sobre este tópico pela Fractionation Research, Inc. (comumente conhecida como FRI).
Destilação multiefeito
O objetivo da destilação multiefeito é aumentar a eficiência energética do processo, para uso na dessalinização, ou em alguns casos uma etapa na produção de água ultrapura. O número de efeitos é inversamente proporcional ao valor de kW·h/m3 de água recuperada e refere-se ao volume de água recuperada por unidade de energia em comparação com a destilação de efeito único. Um efeito é de aproximadamente 636 kW·h/m3.
- A destilação de flash multi-estágio pode alcançar mais de 20 efeitos com entrada de energia térmica, como mencionado no artigo.
- Evaporação de compressão de vapor – As unidades comerciais de grande escala podem atingir cerca de 72 efeitos com entrada de energia elétrica, de acordo com os fabricantes.
Existem muitos outros tipos de processos de destilação multiefeito, incluindo um chamado simplesmente destilação multiefeito (MED), no qual são empregadas múltiplas câmaras, com trocadores de calor intervenientes.
No processamento de alimentos
Bebidas
Materiais vegetais contendo carboidratos podem fermentar, produzindo uma solução diluída de etanol no processo. Bebidas alcoólicas como uísque e rum são preparadas pela destilação dessas soluções diluídas de etanol. Outros componentes além do etanol, incluindo água, ésteres e outros álcoois, são coletados no condensado, o que contribui para o sabor da bebida. Algumas dessas bebidas são armazenadas em barris ou outros recipientes para adquirir mais compostos aromáticos e sabores característicos.
Galeria
Contenido relacionado
Californium
Ernest Rutherford
Nitreto de boro