Clorofórmio
clorofórmio , ou triclorometano (frequentemente abreviado como tcm ), é um organocloreto com a fórmula CHCL
Estrutura e nome
A molécula adota uma geometria molecular tetraédrica com simetria C 3V. A molécula de clorofórmio pode ser vista como uma molécula de metano com três átomos de hidrogênio substituídos por três átomos de cloro, deixando um único átomo de hidrogênio.
o nome " clorofórmio " é um portmanteau de tercloreto (cloreto terciário, um tricloreto) e formyle , um nome obsoleto para o radical de metilideno (CH) derivado do ácido fórmico.
Ocorrência natural
O fluxo global total de clorofórmio através do ambiente é aproximadamente 660 000 toneladas por ano e cerca de 90% das emissões são naturais de origem. Muitos tipos de algas marinhas produzem clorofórmio, e acredita -se que os fungos produzam clorofórmio no solo. Acredita -se também que os processos abióticos contribuam para as produções naturais de clorofórmio nos solos, embora o mecanismo ainda não esteja claro.
Como a clorofórmio é um composto orgânico volátil, ele se dissipa prontamente do solo e da água superficial e sofre degradação no ar para produzir fosgeno, diclorometano, cloreto de formil, monóxido de carbono, dióxido de carbono e cloreto de hidrogênio. Sua meia-vida no ar varia de 55 a 620 dias. A biodegradação na água e no solo é lenta. A clorofórmio não bioacumula significativamente em organismos aquáticos.
História
O clorofórmio foi sintetizado independentemente por vários investigadores c.
- Moldenhawer, um farmacêutico alemão de Frankfurt an der Oder, parece ter produzido clorofórmio em 1830 misturando cal clorada com etanol; no entanto, ele confundiu-o para Produtos agrícolas (éter clorico, 1,2-dicloroetano).
- Samuel Guthrie, um médico norte-americano de Sackets Harbor, Nova Iorque, também parece ter produzido clorofórmio em 1831, reagindo o cal clorado com etanol, e notou suas propriedades anestésicas; no entanto, ele também acreditava que tinha preparado o éter clorídrico.
- Justus von Liebig realizou a clivagem alcalina de cloro. Liebig afirma incorretamente que a fórmula empírica do clorofórmio foi C2Cl5 e nomeou-o "Clorkohlenstoff" ("cloreto de carbono").
- Eugène Soubeiran obteve o composto pela ação de lixívia de cloro em etanol e acetona.
Em 1834, o químico francês Jean-Baptiste Dumas determinou a fórmula empírica de clorofórmio e nomeou-o: " 2 H
Em 1835, os dumas prepararam a substância pela clivagem alcalina do ácido tricloroacético.
Em 1842, Robert Mortimer Glover, em Londres, descobriu as qualidades anestésicas de clorofórmio em animais de laboratório. Em 1847, o obstetra escocês James Y. Simpson foi o primeiro a demonstrar as propriedades anestésicas do clorofórmio em humanos, fornecidos pelo farmacêutico local William Flockhart de Duncan, Flockhart e companhia, e ajudou a popularizar o medicamento para uso em medicina.Na década de 1850, o clorofórmio estava sendo produzido em uma base comercial. Na Grã -Bretanha, cerca de 750.000 doses por semana estavam sendo produzidas em 1895, usando o procedimento Liebig, que manteve sua importância até a década de 1960. Hoje, o clorofórmio - junto com o diclorometano - é preparado exclusivamente e em uma escala maciça pela cloração de metano e clorometano.
Produção
Industrialmente, a clorofórmio é produzida aquecendo uma mistura de cloro e cloreto de metila ( ch
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
O clorofórmio passa por uma cloração adicional para produzir tetracloreto de carbono ( ccl
- CHCl3 + Cl2 → CCl4 + HCl
A saída deste processo é uma mistura dos quatro clorometanos: clorometano, cloreto de metileno (diclorometano), triclorometano (cloroforme), e tetraclorometano (tetracloridrato de carbono). Estes podem então ser separados por destilação.
A clorofórmio também pode ser produzida em pequena escala através da reação de halofórmio entre acetona e hipoclorito de sódio:
- 3 NaOCl + (CH)3)2CO → CHCl3 + 2 NaOH + CH3COONa
Deuterochloroform
clorofórmio deuterado é um isotopólogo de clorofórmio com um único átomo de deutério. CDCL
Formação inadvertida do clorofórmio
A reação de halofórmio também pode ocorrer inadvertidamente em ambientes domésticos. O branqueamento com hipoclorito gera compostos halogenados nas reações colaterais; O clorofórmio é o principal subproduto. Solução de hipoclorito de sódio (alvejante de cloro) misturada com líquidos domésticos comuns, como acetona, metil etiletona, etanol ou álcool isopropílico, pode produzir algum clorofórmio, além de outros compostos, como cloroacetona ou dicloroacetona.
Usos
Em termos de escala, a reação mais importante do clorofórmio é com o fluoreto de hidrogênio para dar monoclorodifluorometano (HCFC-22), um precursor na produção de politetrafluoroetileno (Teflon) e outros fluoropolímeros:
- CHCl3 + 2 HF → CHClF2 + 2 HCl
A reação é realizada na presença de uma quantidade catalítica de halogenetos de antimônio misto. O clorodifluorometano é então convertido em tetrafluoroetileno, o principal precursor de Teflon.
Solvente
O hidrogênio ligado ao carbono no clorofórmio participa da ligação de hidrogênio, tornando -o um bom solvente para muitos materiais.
Em todo o mundo, a clorofórmio também é usada em formulações de pesticidas, como solvente para lipídios, borracha, alcalóides, ceras, guta-percha e resinas, como um agente de limpeza, como fumigante de grãos, em exagerantes de incêndio e na borracha indústria. CDCL3 é um solvente comum usado na espectroscopia de RMN.
Refrigerante
O clorofórmio é usado como precursor para fabricar R-22 (clorodifluorometano). Isso é feito reagindo-o com uma solução de ácido hidrofluórico (HF) que fluorina o chcl
Embora o clorofórmio tenha propriedades como um ponto de ebulição baixo e um baixo potencial de aquecimento global de apenas 31 (em comparação com o 1760 do R-22), que são propriedades atraentes para um refrigerante, há pouca informação que sugira que elas viu o uso generalizado como refrigerante em qualquer produto de consumo.
Ácido de Lewis
Em solventes como ccl
Reagente
Como reagente, o clorofórmio serve como fonte do intermediário diclorocarbeno ccl
Anastético

As qualidades anestésicas do clorofórmio foram descritas pela primeira vez em 1842 em uma tese de Robert Mortimer Glover, que ganhou a medalha de ouro da sociedade harveiana por esse ano. Glover também realizou experimentos práticos sobre cães para provar suas teorias, refinaram suas teorias e os apresentaram em sua tese de doutorado na Universidade de Edimburgo no verão de 1847.
O obstetra escocês James Young Simpson foi um daqueles necessários para ler a tese, mas mais tarde afirmou nunca ter lido e ter chegado a suas próprias conclusões de forma independente. Em 4 de novembro de 1847, Simpson argumentou que havia descoberto as qualidades anestésicas de clorofórmio em humanos. Ele e dois colegas se divertiram tentando os efeitos de várias substâncias e, portanto, revelaram o potencial de clorofórmio em procedimentos médicos.

Alguns dias depois, durante um procedimento odontológico em Edimburgo, Francis Brodie Imlach se tornou a primeira pessoa a usar clorofórmio em um paciente em um contexto clínico.
Em maio de 1848, Robert Halliday Gunning fez uma apresentação para a Sociedade Médica-Chirurgical de Edimburgo, após uma série de experimentos de laboratório em coelhos que confirmaram as descobertas de originalidade de Glover e também reabasteceram a originalidade de Simpson. Os experimentos de laboratório que provaram que os perigos do clorofórmio foram amplamente ignorados.O uso de clorofórmio durante a cirurgia expandiu -se rapidamente na Europa; Por exemplo, na década de 1850, o clorofórmio foi usado pelo médico John Snow durante o nascimento da última vez, os últimos dois filhos Leopold e Beatrice. Nos Estados Unidos, a clorofórmio começou a substituir o éter como anestésico no início do século XX; Foi abandonado em favor do Ether sobre a descoberta de sua toxicidade, especialmente sua tendência a causar arritmias cardíacas fatais análogas ao que agora é denominado. Algumas pessoas usaram a clorofórmio como uma droga recreativa ou para tentar suicídio. Um possível mecanismo de ação do clorofórmio é que ele aumenta o movimento de íons de potássio através de certos tipos de canais de potássio nas células nervosas. A clorofórmio também pode ser misturada com outros agentes anestésicos, como o éter, para fazer a mistura C.E., ou éter e álcool para fazer a.c.e. mistura.
Em 1848, Hannah Greener, uma menina de 15 anos que estava removida uma unha infectada, morreu após receber o anestésico. Sua autópsia que estabelece a causa da morte foi realizada por John Fife, assistido por Robert Mortimer Glover. Vários pacientes fisicamente aptos morreram após inalá -lo. Em 1848, no entanto, John Snow desenvolveu um inalador que regulou a dose e reduziu com sucesso o número de mortes.
Os oponentes e apoiadores da clorofórmio discordaram da questão de saber se as complicações médicas serem devidas a distúrbios respiratórios ou se a clorofórmio teve um efeito específico no coração. Entre 1864 e 1910, inúmeras comissões na Grã -Bretanha estudaram clorofórmio, mas não chegaram a conclusões claras. Foi somente em 1911 que a taxa provou em experimentos com animais que o clorofórmio pode causar fibrilação ventricular. Apesar disso, entre 1865 e 1920, o clorofórmio foi usado em 80 a 95% de todos os narcos realizados nos países do Reino Unido e de língua alemã. Na Alemanha, pesquisas abrangentes da taxa de mortalidade durante a anestesia foram feitas por Gurlt entre 1890 e 1897. Ao mesmo tempo no Reino Unido, o diário médico o Lancet realizou uma pesquisa de questionário e compilou um relatório detalhando numerosos numerosos Reações adversas a anestésicos, incluindo clorofórmio. Em 1934, Killian reuniu todas as estatísticas compiladas até então e descobriu que as chances de sofrer complicações fatais sob éter estavam entre 1: 14.000 e 1: 28.000, enquanto que com clorofórmio as chances estavam entre 1: 3.000 e 1: 6.000. A ascensão da anestesia a gás usando óxido nitroso, equipamento aprimorado para administrar anestésicos e a descoberta do hexobarbital em 1932 levaram ao declínio gradual da narcose de clorofórmio.
O mais recente uso anestésico relatado de clorofórmio no mundo ocidental data de 1987, quando o último médico que o usou se aposentou, cerca de 140 anos após seu primeiro uso.
Uso criminal
O clorofórmio tem sido usado por criminosos para nocautear, atordoar ou até mesmo vítimas de assassinato. Joseph Harris foi acusado em 1894 de usar o clorofórmio para roubar pessoas. O assassino em série H. H. Holmes usou overdoses de clorofórmio para matar suas vítimas. Em setembro de 1900, o clorofórmio foi implicado no assassinato do empresário dos EUA William Marsh Rice. A clorofórmio foi considerada um fator no suposto assassinato de uma mulher em 1991, quando foi asfixiada enquanto dormia. Em 2002, Kacie Woody, de 13 anos, foi sedada com clorofórmio quando foi sequestrada por David Fuller e durante o tempo que ele a teve, antes de atirar e matá-la. Em uma barganha de 2007, um homem confessou usar armas de choque e clorofórmio para agredir sexualmente menores.
O uso do clorofórmio como agente incapacitador tornou -se amplamente reconhecido, na fronteira com o clichê, através da adoção de autores de ficção criminal de parcelas envolvendo criminosos ' Uso de trapos encharcados de clorofórmio para tornar as vítimas inconscientes. No entanto, é quase impossível incapacitar alguém usando clorofórmio dessa maneira. Demora pelo menos cinco minutos de inalação de clorofórmio para tornar uma pessoa inconsciente. A maioria dos casos criminais envolvendo clorofórmio envolve co-administração de outra droga, como álcool ou diazepam, ou a vítima sendo cúmplice em sua administração. Depois que uma pessoa perdeu a consciência devido à inalação de clorofórmio, um volume contínuo deve ser administrado e o queixo deve ser apoiado para impedir que a língua obstrua as vias aéreas, um procedimento difícil, normalmente exigindo as habilidades de um anestesiologista. Em 1865, como resultado direto da reputação criminal, a clorofórmio havia ganho, o diário médico o Lancet ofereceu uma reputação científica permanente " Para qualquer pessoa que possa demonstrar a insensibilidade instantânea - ou seja, perda de consciência, usando clorofórmio.
Segurança
Exposição
Enquanto poucos estudos avaliaram os riscos apresentados pela exposição ao clorofórmio através da água potável isoladamente de outros THMs, muitos estudos mostraram que a exposição à categoria geral de THMS, incluindo a clorofórmio, está associada a um risco aumentado de câncer da bexiga ou menor trato GI.
Historicamente, a exposição ao clorofórmio pode muito bem ter sido maior, devido ao seu uso comum como anestésico, como ingrediente em xaropes de tosse e como constituinte da fumaça do tabaco, onde o DDT havia sido usado anteriormente como fumigante.Farmacologia
Como a maioria dos outros anestésicos gerais e medicamentos-hipnóticos sedativos, o clorofórmio é um modulador alostérico positivo nos receptores GABAA. A clorofórmio causa depressão do sistema nervoso central (SNC), produzindo finalmente a depressão do centro e do centro respiratório profundo. Quando ingerido, a clorofórmio causa sintomas semelhantes aos observados após a inalação. A doença grave seguiu a ingestão de 7,5 g (0,26 oz). A dose oral letal média em um adulto é estimada em 45 g (1,6 oz).
O uso anestésico de clorofórmio foi descontinuado, porque causou mortes por insuficiência respiratória e arritmias cardíacas. Após a anestesia induzida por clorofórmio, alguns pacientes sofreram náusea, vômito, hipertermia, icterícia e coma devido à disfunção hepática. Na autópsia, foram observadas necrose hepática e degeneração.
O clorofórmio induziu tumores hepáticos em camundongos e tumores renais em camundongos e ratos. Pensa -se que a hepatotoxicidade e a nefrotoxicidade da clorofórmio sejam devidas em grande parte ao fosgeno, um de seus metabólitos.Conversão para phosgene
O clorofórmio se converte lentamente na presença de luz UV e ar para o gás extremamente venenoso, fosgeno ( cocl
- 2 CHCl3 + O2 → 2 COCl2 + 2 HCl
Para evitar acidentes, o clorofórmio comercial é estabilizado com etanol ou amileno, mas as amostras que foram recuperadas ou secas não contêm mais nenhum estabilizador. Verificou -se que o amileno é ineficaz e o fosgeno pode afetar analitos em amostras, lipídios e ácidos nucleicos dissolvidos ou extraídos com clorofórmio. O fosgeno e o HCl podem ser removidos da clorofórmio com lavagem com soluções de carbonato aquoso saturado, como bicarbonato de sódio. Este procedimento é simples e resulta em produtos inofensivos. O fosgeno reage com a água para formar dióxido de carbono e HCl, e o sal de carbonato neutraliza o ácido resultante.
Amostras suspeitas podem ser testadas quanto a fosgeno usando papel de filtro que, quando tratado com 5% de difenilamina, a 5% de dimetilaminobenzaldeído em etanol e depois seco, fica amarelo na presença de vapor de fosgeno. Existem vários reagentes colorimétricos e fluorométricos para fosgeno e também podem ser quantificados usando espectrometria de massa.
Regulamento
clorofórmio é suspeito de causar câncer (ou seja, é possivelmente carcinogênico, Grupo 2B da IARC), de acordo com as monografias da Agência Internacional de Pesquisa sobre Câncer (IARC).
É classificado como uma substância extremamente perigosa nos Estados Unidos, conforme definido na Seção 302 da Lei de Planejamento de Emergência e Comunidade de Emergência dos EUA (42 U.S.C. 11002) e está sujeito a requisitos estritos de relatórios por instalações que que produzir, armazenar ou usá -lo em quantidades significativas.
Bioremediação do clorofórmio
Algumas bactérias anaeróbicas usam clorofórmio para respiração, denominada respiração de organohalato, convertendo -a em diclorometano.
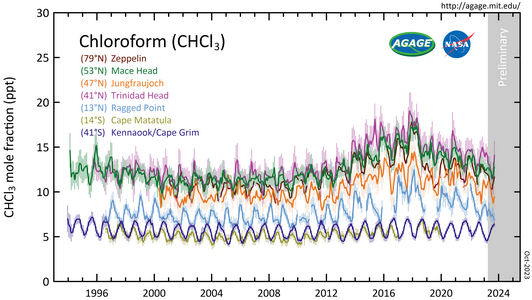
Galeria
- CHCl3 medidos pelo Advanced Global AMF Gases Experiment (AGAGE) na atmosfera inferior (troposfera) em estações ao redor do mundo. Abundâncias são dadas como fracções de toupeira média mensal livre de poluição em partes por trilhões (ppt).
Referências
- ^ Gregory, William, A Handbook of Organic Chemistry (Terceira edição corrigida e muito estendida), 1852, página 177
- ^ Daniel Pereira Gardner, Química Medicinal para o Uso de Estudantes e a Profissão: Ser um Manual da Ciência, com Suas Aplicações para Toxicologia, Fisiologia, Terapêutica, Higiene, Etc (1848), página 271
- ^ "Parte 3 Perigos de Saúde" (PDF). Sistema globalmente harmonizado de classificação e rotulagem de produtos químicos (GHS). Segunda edição revista. Nações Unidas. Arquivado (PDF) do original em 4 Março 2019. Retrieved 30 de Setembro 2017.
- ↑ a b d NIOSH Pocket Guide to Chemical Hazards (em inglês). «#0127». Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ Toxicity on PubChem Arquivado em 17 de agosto de 2018 no Wayback Machine
- ^ Lewis, Richard J. (2012). Propriedades Perigosas da Sax de Materiais Industriais (12ed.). Wiley. ISBN 978-0-470-62325-1.
- ^ "Chloroform" (PDF). Agência de Protecção Ambiental. Setembro 2016. Retrieved 19 de Fevereiro 2024.
- ^ "Chloroform". Imediatamente Perigoso para Concentrações de Vida ou Saúde (IDLH). Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ «PubChem: Safety and Hazards – GHS Classification» (em inglês). Centro Nacional de Informação em Biotecnologia, Biblioteca Nacional de Medicina dos EUA. Arquivado do original em 17 de agosto de 2018. Retrieved 17 de Agosto 2018.
- ^ «Front Matter» (em inglês). Nomenclatura da Química Orgânica: IUPAC Recomendações e Nomes Preferidos 2013 (Livro Azul). Cambridge: The Royal Society of Chemistry. 2014. p. 661. doi:10.1039/9781849733069-FP001 (inativo em 26 de abril de 2024). ISBN 978-0-85404-182-4.
Os nomes retidos 'bromoform' para HCBr3, 'cloroform' para HCCl3, e 'iodoform' para HCI3 são aceitáveis na nomenclatura geral. Os nomes preferenciais do IUPAC são nomes substitutivos.
{{cite book}}: Principal CS1: DOI inativo a partir de abril 2024 (link) - ↑ a b d e Rossberg, M.; et al. «Chlorinated Hydrocarbons» (em inglês). Enciclopédia de Química Industrial de Ullmann. Wiley-VCH. doi:10.1002/14356007.a06_233.pub2. ISBN 978-3527306732.
- ^ «Ether and Chloroform» (em inglês). Arquivado do original em 24 de março de 2018. Retrieved 24 de Abril 2018.
- ^ «Chloroform [MAK Value Documentation, 2000]» (em inglês). O MAK-Collection para a Saúde e Segurança Ocupacional. 2012. pp. 20–58. doi:10.1002/3527600418.mb6766e0014. ISBN 978-3-527-60041-0.
- ^ «Illustrated Glossary of Organic Chemistry - Chloroform» (em inglês). www.chem.ucla. Retrieved 29 de Dezembro 2022.
- ^ Gribble, Gordon W. (2004). «Natural Organohalogens: A New Frontier for Medicinal Agents?» (em inglês). Revista de Educação Química. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- ^ Cappelletti, M. (2012). «Microbial degradation of chloroform» (em inglês). Microbiologia Aplicada e Biotecnologia. 96 (6): 1395–409. doi:10.1007/s00253-012-4494-1. PMID 23093177. S2CID 12429523.
- ^ Jiao, Yi; et al. (2018). «Halocarbon Emissions from a Degraded Forested Wetland in Coastal South Carolina Impacted by Sea Level Rise» (em inglês). ACS Terra e Química Espacial. 2 (10): 955–967. Bibcode:2018ESC.....2..955J. doi:10.1021/acsearthspacechem.8b00044. S2CID 134649348.
- ^ «Complete list of VOC's» (em inglês).
- ↑ a b d e f Cronograma (PDF), CICAD, vol. 58, Organização Mundial da Saúde, 2004, arquivado (PDF) do original em 31 de julho de 2020
- ^ Moldenhawer (1830). "Verfahren den Spiritus von dem Fuselöl auf leichte Weise zu befreien" [Processo de libertação de etanol de óleo de fusel de uma forma fácil]. Magazin für Farmácia. 8 (31): 222-227. Arquivado do original em 29 de julho de 2020. Retrieved 6 de Maio 2016.
- ^ Defalque, Ray J.; Wright, A. J. (2000). «Was chloroform produziu antes de 1831?». Anestesiologia. 92 (1): 290–291.10.1097/00000542-200001000-00060. PMID 10638939.
- ^ Guthrie, Samuel (1832). «New mode of prepare a spirituous solution of chloric ether» (em inglês). The American Journal of Science and Arts. 21: 64–65 e 405–408. Arquivado do original em 29 de julho de 2020. Retrieved 6 de Maio 2016.
- ^ Guthrie, Ossian (1887). Memórias do Dr. Samuel Guthrie e da História do Descobrimento de Chloroform. Chicago: George K. Hazlitt & Co. p. 1.
- ^ Stratmann, Linda (2003). «Chapter 2». Cloroforma: A busca pelo esquecimento. Stroud: Sutton Publishing. ISBN 978-0-7524-9931-4. Arquivado do original em 29 de julho de 2020. Retrieved 6 de Maio 2016.
- ^ Liebig, Justus von (1831). "Ueber die Zersetzung des Alkohols durch Chlor" [Na decomposição de álcool por cloro]. Annalen der Physik und Chemie. 99 (11): 444. Bibcode:1831AnP....99..444L. doi:10.1002/andp.18310991111. Arquivado do original em 10 de maio de 2017. Retrieved 6 de Maio 2016.
- ^ Liebig, Justus von (1832). "Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen" [Nos compostos que surgem pela reação de cloro com álcool [eter], gás de formação de óleo [etileno], e espírito de vinagre]. Annalen der Physik und Chemie. 100. (2): 243–295. Bibcode:1832AnP...100..243L. doi:10.1002/andp.18321000206.
Nas páginas 259–265, Liebig descreve Clorkohlenstoff ("cloreto de carbono", clorofórmio), mas em p. 264, Liebig afirma incorretamente que a fórmula empírica do clorofórmio é C2Cl5. - ^ Soubeiran, Eugène (1831). "Recherches sur quelques combinaisons du chlore" [Investigações em alguns compostos de cloro]. Annales de Chimie et de Physique. Série 2. 48: 113–157. Arquivado do original em 10 de maio de 2017. Retrieved 6 de Maio 2016.
- Reimpresso em Soubeiran, Eugène (1831). "Recherches sur quelques combinaisons du chlore" [Investigações em alguns compostos de cloro]. Journal de Pharmacie et des Sciences Accessoires. 17.: 657–672. Arquivado do original em 29 de julho de 2020. Retrieved 6 de Maio 2016.
- Reimpresso em Soubeiran, Eugène (1832). "Suite des recherches sur quelques combinaisons du chlore" [Continuação de investigações sobre alguns compostos de cloro]. Journal de Pharmacie et des Sciences Accessoires. 18.: 1–24. Arquivado do original em 29 de julho de 2020. Retrieved 6 de Maio 2016.
- ^ Dumas, J.-B. (1834). "Récherches rélative à l'action du chlore sur l'alcool" [Experiments about the action of chlorine on alcohol]. L'Institut, Journal Général des Sociétés et Travaux Scientifiques de la France et de l'Étranger. 2: 106-108 e 112–115.
- Reimpresso em Dumas, J.-B. (1834). "Untersuchung über die Wirkung des Chlors auf den Alkohol" [Investigação da ação do cloro sobre o álcool]. Annalen der Physik und Chemie. 107 (42): 657–673. Bibcode:1834AnP...107..657D. doi:10.1002/andp.18341074202. Arquivado do original em 10 de maio de 2017. Retrieved 12 de Maio 2016.
Em p. 653, Dumas afirma a fórmula empírica do clorofórmio:
- "Es scheint mir também erweisen, dass die von mir analysirte Substance, ... zur Formel chapéu: C2H. H. H.2Cl6" (Assim, parece-me mostrar que a substância [que foi] analisada por mim ... tem como [sua fórmula empírica]: C2H. H. H.2Cl6.) [Nota: Os coeficientes de sua fórmula empírica devem ser halved.]
- Dumas então observa que a fórmula empírica simples do clorofórmio assemelha-se à do ácido fórmico. Além disso, se o clorofórmio é fervido com hidróxido de potássio, um dos produtos é o formato de potássio. Em p. 654, nomes de Dumas chloroform:
- "Diess hat mich veranlasst diese Substanz mit dem Namen 'Chloroform' zu belegen." (Isso fez com que eu concedesse esta substância com o nome "cloroforme" [isto é, cloreto de forma ou cloreto de ácido fórmico].)
- Reimpresso em Dumas, J.-B. (1835). "Ueber die Wirkung des Chlors auf den Alkohol" [Sobre a ação do cloro sobre o álcool]. Analen der Pharmacie. 16. (2): 164–171. doi:10.1002/jlac.18350160213. Arquivado do original em 10 de maio de 2017. Retrieved 12 de Maio 2016.
- Reimpresso em Dumas, J.-B. (1834). "Untersuchung über die Wirkung des Chlors auf den Alkohol" [Investigação da ação do cloro sobre o álcool]. Annalen der Physik und Chemie. 107 (42): 657–673. Bibcode:1834AnP...107..657D. doi:10.1002/andp.18341074202. Arquivado do original em 10 de maio de 2017. Retrieved 12 de Maio 2016.
- ↑ a b Defalque, R. J.; Wright, A. J. (2004). "A curta e trágica vida de Robert M. Glover" (PDF). Anestesia. 59 (4): 394–400.10.1111/j.1365-2044.2004.03671.x. PMID 15023112. S2CID 46428403. Arquivado (PDF) do original em 9 de março de 2016.
- ↑ a b Gordon, H. Laing (novembro de 2002). Sir James Young Simpson e Chloroform (1811-1870). Minerva Group. pp. 106–109. ISBN 978-1-4102-0291-8. Arquivado do original em 6 de maio de 2016. Retrieved 5 de Janeiro 2016.
- ^ "Sir James Young Simpson". Enciclopédia Britannica. Arquivado do original em 27 de julho de 2013. Retrieved 23 de Agosto 2013.
- ^ Worling, P.M. (1998). «Duncan and Flockhart: the Story of Two Men and a Pharmacy» (em inglês). Historiador farmacêutico. 28 (2): 28–33. PMID 11620310.
- ^ Paulsen, P. J.; Cooke, W. D. (1 de setembro de 1963). «Preparation of Deuterated Solvents for Nuclear Magnetic Resonance Spectrometry» (em inglês). Química Analítica. 35 (10): 1560. doi:10.1021/ac60203a072.
- ^ Breuer, F. W. (1935). «Chloroform-d (Deuteriochloroform)1» (em inglês). Journal of the American Chemical Society. 57 (11): 2236–2237. doi:10.1021/ja01314a058.
- ^ Kluger, Ronald (1964). «A Convenient Preparation of Chloroform-d1» (em inglês). O Jornal de Química Orgânica. 29 de Março (7): 2045–2046. doi:10.1021/jo01030a526.
- ^ Süss, Hans Ulrich. "Bleaching". Enciclopédia de Química Industrial de Ullmann. Wiley-VCH. ISBN 978-3527306732.
- ^ «Chlorodifluoromethane | chemical complex» (em inglês). Enciclopédia Britannica. Arquivado do original em 17 de julho de 2021. Retrieved 8 de Setembro 2021.
- ^ Wiley, G. R.; Miller, S. I. (1972). "Parâmetros teóricos para ligação de hidrogênio de clorofórmio com bases de Lewis em cicloexano. Estudo de ressonância magnética de Proton". Journal of the American Chemical Society. 94 (10): 3287–3293. doi:10.1021/ja00765a001.
- ^ Kwak, K.; Rosenfeld, D. E.; Chung, J. K.; Fayer, M. D. (2008). «Solute-solvent complex switching dynamics of chloroform between acetone and dimethylsulfoxide-two-dimensional IR chemical exchange spectroscopy» (em inglês). O Jornal de Química Física B. 112 (44): 13906–13915. doi:10.1021/jp806035w. PMC 264. PMID 18855462.
- ↑ a b Leikin, Jerrold B.; Paloucek, Frank P., eds. (2008). "Chloroform". Manual de Envenenamento e Toxicologia (4a ed.). Informa. p. 774.
- ^ Fulmer, Gregory R.; Miller, Alexander J. M.; Sherden, Nathaniel H.; Gottlieb, Hugo E.; Nudelman, Abraham; Stoltz, Brian M.; Bercaw, John E.; Goldberg, Karen I. (2010). "NMR Chemical Shifts of Trace Impurities: Common Laboratory Solvents, Organics, and Gases in Deuterated Solvents Relevant to the Organometallic Chemist" (PDF). Organometálico. 29 de Março (9): 2176–2179. doi:10.1021/om100106e. S2CID 2755004.
- ^ «Chloroform (CHEBI:35255)» (em inglês).
- ^ "Produção, importação/exportação, uso e eliminação" (PDF). Anúncio grátis para sua empresa. Retrieved 5 de Abril 2023.
- ^ «Chloroform as a pollutant» (em inglês). A Enciclopédia dos Problemas Mundiais.
- ^ Srebnik, M.; Laloë, E. (2001). "Chloroform". Enciclopédia de Reagentes para Síntese Orgânica. Wiley. doi:10.1002/047084289X.rc105. ISBN 978-0-471-93623-7.
- ^ Vogel, E.; Klug, W.; Breuer, A. (1988). «1,6-Methano[10]annulene». Sínteses orgânicas; Volumes recolhidos6, p. 731.
- ^ Gokel, G. W.; Widera, R. P.; Weber, W. P. (1988). «Phase-Transfer Hofmann Carbylamine Reaction: tert-Butyl Isocyanide» (em inglês). Sínteses orgânicas; Volumes recolhidos, vol. 6, p. 232.
- ^ Perkins-McVey, Matthew (10 de novembro de 2023). "Uma nova ordem de substâncias venenosas": revisitar a dissertação de Robert M. Glover sobre os efeitos fisiológicos dos compostos de bromo, cloro e iodo". Arquivos de Farmacologia de Naunyn-Schmiedeberg. 397 (5): 3343–3350.10.1007/s00210-023-02820-y. AMID 37947840. Retrieved 27 de Janeiro 2024.
- ^ Glover, Robert M. (1 de outubro de 1842). «On the Physiological and Medicinel Properties of Bromine and Its Compounds; Also on the Analogies between the Physiological and Medicinel Properties of These Bodies, and those of Chlorine and Iodine, with Their Correspondent Compounds; Being the Harveian Prize Essay for 1842» (em inglês). Revista Médica e Cirúrgica de Edimburgo. 58 (153): 335-364. PMC 5789197. PMID 30330609.
- ^ Dingwall (abril de 2004). "Uma história pioneira: odontologia e o Royal College of Surgeons of Edinburgh" (PDF). História da indústria.co.uk. Arquivado do original (PDF) em 1 de fevereiro de 2013.
- ^ Baillie, T. W. (2003). «Robert Halliday Gunning and the Victoria Jubilee Prizes» (em inglês). (PDF). Revista médica escocesa. 48 (2): 54–57. doi:10.1177/003693300304800209. PMID 12774598. S2CID 10998512. Arquivado do original (PDF) em 22 de agosto de 2016. Retrieved 18 de Agosto 2016.
- ^ «Anesthesia and Queen Victoria» (em inglês). ph.ucla.edu. Arquivado do original em 16 de julho de 2012. Retrieved 13 de Agosto 2012.
- ^ Martin, William (3 de julho de 1886). «A Case of Chloroform Poisoning; Recovery» (em inglês). British Medical Journal. 2 (1331): 16–17. doi:10.1136/bmj.2.1331.16-a. PMC 2257365. PMID 20751619.
- ^ Patel, Amanda J.; Honoré, Eric; Lesage, Florian; Fink, Michel; Romey, Georges; Lazdunski, Michel (maio de 1999). "Anestésicos inalacionais ativam o fundo de dois póres-domínio K+ canais". Natureza Neurociências. 2 (5): 422–426. doi:10.1038/8084. PMID 10321245. S2CID 23092576.
- ^ Knight, Paul R. III; Bacon, Douglas R. (2002). «An Unexplained Death: Hannah Greener and Chloroform» (em inglês). Anestesiologia. 96 (5): 1250-1253. - Sim.10.1097/00000542-200205000-00030. PMID 11981167. S2CID 12865865.
- ^ Snow, John (1858). Sobre o clorofórmio e outros anestésicos e sua ação e administração. London: John Churchill. pp. 82–85. Arquivado do original em 23 de novembro de 2015.
- ^ Anónimo (1890). «The Lancet Inquiry into the Mortality Under Anaesthetics» (em inglês). Lancet!. 145 (3472): 612-13.
- ^ Anônimo (1893). «Relatório da Comissão Lancet apontado para investigar o assunto da administração do clorofórmio e outros anestésicos de um ponto de vista clínico». Lancet!. 141 (3629): 629–38.
- ^ Wawersik, J. (1997). «History of chloroform anesthesia» (em inglês). Anestesiologia e Reanimação. 22 (6): 144-152. PMID 9487785.
- ^ Stratmann, Linda (2003). Cloroforma: A busca pelo esquecimento. Stroud: Sutton Publishing. ISBN 978-0-7524-9931-4.
- ^ «Knock-out and Chloroform» (em inglês). A Filadélfia Gravação. 9 de fevereiro de 1894. Arquivado do original em 20 de janeiro de 2022. Retrieved 31 de Março 2011.
- ^ «Chloroform case retrial underway» (em inglês). Record-Journal7 de Julho de 1993. Arquivado do original em 6 de novembro de 2021. Retrieved 31 de Março 2011.
- ^ Cathy Frye - Arkansas Democrat-Gazette (17 de dezembro de 2003). "Mas não esquecido". www.arkansasonline.com. Arquivado do original em 7 de dezembro de 2021. Retrieved 7 de Dezembro 2021.
- ^ «Man admits to raping friends' daughters» (em inglês). Estados Unidos Hoje. 6 de novembro de 2007. Arquivado do original em 29 de abril de 2011. Retrieved 31 de Março 2011.
- ^ Payne, J. P. (julho de 1998). «The criminal use of chloroform» (em inglês). Anestesia. 53 (7): 685–690. doi:10.1046/j.1365-2044.1998.528-az0572.xPMID 9771177. S2CID 1718276.
- ^ «Medical Annotation: Chloroform amongst Thieves» (em inglês). O Lancet. 2 (2200): 490–491. 1865. doi:10.1016/s0140-6736(02)58434-8.
- ^ Nieuwenhuijsen, MJ; Toledano, MB; Elliott, P (8 de agosto de 2000). «Uptake of chlorinfection desinfection by-products; a review and a discussion of its implicações for exhibition evaluation in epidemiol studies» (em inglês). Revista de Análise de Exposição e Epidemiologia Ambiental. 10. (6 Pt 1): 586–99. doi:10.1038/sj.jea.7500139. PMID 11140442.
- ^ Grupo, Trabalho Ambiental. «EWG's Tap Water Database: Contaminants in Your Water» (em inglês). www.ewg. Retrieved 8 de Agosto 2023.
- ^ "Galerias de Saúde Públicas para Trihalometanos em Água potável" (PDF). Oehha.ca.gov. p. 93. Retrieved 8 de Agosto 2023.
- ^ Yin-Tak Woo, David Y. Lai, Joseph C. Arcos Carcinogênios Alifáticos e Polialogenados: Bases Estruturais e Biológicos Arquivado em 5 de junho de 2018 no Wayback Machine
- ↑ a b c Fan, Anna M. (2005). "Chloroform". Enciclopédia da ToxicologiaVol. 1 (2a ed.). Elsevier. pp. 561–565.
- ^ Jenkins, Andrew; Greenblatt, Eric P.; Faulkner, Howard J.; Bertaccini, Edward; Light, Adam; Lin, Audrey; Andreasen, Alyson; Viner, Anna; Trudell, James R.; Harrison, Neil L. (15 de março de 2001). «Evidence for a Common Binding Cavity for Three General Anesthetics inside the GABAA Receptor» (em inglês). Journal of Neuroscience. 21 (6): RC136. doi:10.1523/JNEUROSCI.21-06-j0002.2001. ISSN 0270-6474. PMC 6762625. PMID 11245705.
- ^ «Chloroform and Phosgene, Chemical Hygiene and Safety» (em inglês). Faculdade de Earlham. Arquivado do original em 19 de agosto de 2017. Retrieved 17 de Agosto 2017.
- ^ Turk, Eric (2 de março de 1998). «Phosgene from Chloroform» (em inglês). Engenharia Química Notícias. 76 (9): 6.10.1021/cen-v076n009.p006. Arquivado do original em 24 de julho de 2008. Retrieved 13 de Agosto 2012.
- ^ «phosgene (composto químico)» (em inglês). Enciclopédia Britannica. Arquivado do original em 5 de junho de 2013. Retrieved 16 de Agosto 2013.
- ^ Manogue, W. H.; Pigford, R. L. (Setembro de 1960). «A cinética da absorção de fosgênio em água e soluções aquosas». Jornal AIChE. 6 (3): 494–500. Bibcode:1960AIChE...6..494M. doi:10.1002/aic.690060329. ISSN 0001-1541.
- ^ «American Chemical Society: Chemical & Engineering Safety Letters» (em inglês). O que fazer?. Retrieved 18 de Março 2024.
- ^ Cheng, Xueheng; Gao, Quanyin; Smith, Richard D.; Simanek, Eric E.; Mammen, Mathai; Whitesides, George M. (1996). «Characterization of Hydrogen-Bonded Aggregates in Chloroform by Electrospray Ionization Mass Spectrometry» (em inglês). O Jornal de Química Orgânica. 61 (6): 2204–2206. doi:10.1021/jo951345g. ISSN 0022-3263. Arquivado do original em 31 de julho de 2022.
- ^ "Chloroform" (PDF). Retrieved 5 de Dezembro 2023.
- ^ "40 C.F.R.: Apêndice A à Parte 355 - A Lista de Substâncias Extremamente Perigosas e Suas Quantidades de Planejamento Threshold" (PDF). Código dos Regulamentos Federais (1 de julho de 2008). Escritório de impressão do governo. Arquivado do original (PDF) em 25 de fevereiro de 2012. Retrieved 29 de Outubro 2011.
- ^ Shuiquan Tang; Elizabeth A. Edwards (2013). «Identificação de Dehalobacter dehalogenases redutores que catalisam a decloração do clorofórmio, 1,1,1-trichloroethane e 1,1-dichloroethane». Philos Trans R Soc Lond B Biol Sci. 368 (1616): 20120318. doi:10.1098/rstb.2012.0318. PMC 3638459. PMID 23479748.
- ^ Jugder, Bat-Erdene; Ertan, Haluk; Wong, Yie Kuan; Braidy, Nady; Manefield, Michael; Marquis, Christopher P.; Lee, Matthew (10 de agosto de 2016). «Genomic, transcriptomic and proteomic analysis of Dehalobacter UNSWDHB in response to chloroform» (em inglês). Relatórios de Microbiologia Ambiental. 8 (5): 814–824. Bibcode:2016EnvMR...8.814J. doi:10.1111/1758-2229.12444. ISSN 1758-2229. PMID 27452500.
Ligações externas
- Chloroform "The Molecular Lifesaver" – Um artigo na Universidade de Oxford fornecendo fatos sobre clorofórmio.
- Administração de clorofórmio – um curta-metragem de aplicação de clorofórmio anestésico, filmado na década de 1930
- Concisão Internacional Documento de Avaliação Química 58
- IARC Sumários e Avaliação: Vol. 1 (1972), Vol. 20 (1979), Suppl. 7 (1987), Vol. 73 (1999)
- Cartão de Segurança Química Internacional 0027
- NIOSH Pocket Guide to Chemical Hazards (em inglês). «#0127». Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- NIST Standard Reference Database