Bicarbonato
Em química inorgânica, bicarbonato (nomenclatura recomendada pela IUPAC: hidrogenocarbonato) é uma forma intermediária na desprotonação do ácido carbônico. É um ânion poliatômico com a fórmula química HCO−
3.
O bicarbonato desempenha um papel bioquímico crucial no sistema de tamponamento do pH fisiológico.
O termo "bicarbonato" foi cunhado em 1814 pelo químico inglês William Hyde Wollaston. O nome vive como um nome trivial.
Propriedades químicas
O íon bicarbonato (íon hidrogencarbonato) é um ânion com a fórmula empírica HCO-
3 e uma massa molecular de 61,01 daltons; consiste em um átomo de carbono central rodeado por três átomos de oxigênio em um arranjo trigonal planar, com um átomo de hidrogênio ligado a um dos oxigênios. É isoeletrônico com ácido nítrico HNO
3. O íon bicarbonato carrega uma carga formal negativa e é uma espécie anfiprótica que possui propriedades ácidas e básicas. É a base conjugada do ácido carbônico H
2CO
3; e o ácido conjugado de CO2−
3, o íon carbonato, conforme mostrado por estas reações de equilíbrio:
- CO2-
3 + 2 H2O HCO- Sim.
3 + H2O + OH- Sim. ?2CO3 + 2 OH- Sim.
- H. H. H.2CO3 + 2 H2O HCO- Sim.
3 + H3O+ + H2O CO2-
3 + 2 H3O+.
Um sal de bicarbonato se forma quando um íon carregado positivamente se liga aos átomos de oxigênio carregados negativamente do íon, formando um composto iônico. Muitos bicarbonatos são solúveis em água em temperatura e pressão padrão; em particular, o bicarbonato de sódio contribui para o total de sólidos dissolvidos, um parâmetro comum para avaliar a qualidade da água.
Papel fisiológico
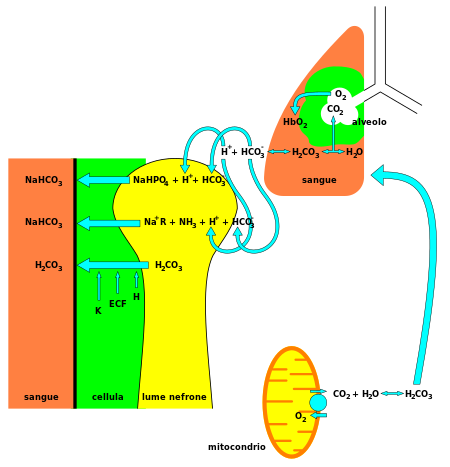
Bicarbonato (HCO−
3) é um componente vital do sistema de tamponamento do pH do corpo humano (mantendo o ácido– homeostase básica). 70%–75% de CO2 no corpo é convertido em ácido carbônico (H2CO3), que é o ácido conjugado de HCO−
3 e pode rapidamente se transformar nele.
Com o ácido carbônico como espécie intermediária central, o bicarbonato – em conjunto com água, íons de hidrogênio e dióxido de carbono – forma esse sistema de tamponamento, que é mantido no equilíbrio volátil necessário para fornecer resistência imediata às mudanças de pH tanto no ácido e direções básicas. Isso é especialmente importante para proteger os tecidos do sistema nervoso central, onde as mudanças de pH muito fora da faixa normal em qualquer direção podem ser desastrosas (consulte acidose ou alcalose). Recentemente também foi demonstrado que o metabolismo celular de bicarbonato pode ser regulado pela sinalização mTORC1.
Além disso, o bicarbonato desempenha um papel fundamental no sistema digestivo. Aumenta o pH interno do estômago, depois que os sucos digestivos altamente ácidos terminam a digestão dos alimentos. O bicarbonato também atua para regular o pH no intestino delgado. É liberado pelo pâncreas em resposta ao hormônio secretina para neutralizar o quimo ácido que entra no duodeno vindo do estômago.
Bicarbonato no ambiente
O bicarbonato é a forma dominante de carbono inorgânico dissolvido na água do mar e na maioria das águas doces. Como tal, é um sumidouro importante no ciclo do carbono.
Na ecologia de água doce, a forte atividade fotossintética das plantas de água doce à luz do dia libera oxigênio gasoso na água e, ao mesmo tempo, produz íons de bicarbonato. Estes alteram o pH para cima até que, em certas circunstâncias, o grau de alcalinidade pode se tornar tóxico para alguns organismos ou pode tornar tóxicos outros constituintes químicos, como a amônia. No escuro, quando não ocorre fotossíntese, os processos respiratórios liberam dióxido de carbono e não são produzidos novos íons de bicarbonato, resultando em uma queda rápida do pH.
O fluxo de íons de bicarbonato de rochas desgastadas pelo ácido carbônico na água da chuva é uma parte importante do ciclo do carbono.
Outros usos
O sal mais comum do íon bicarbonato é o bicarbonato de sódio, NaHCO3, comumente conhecido como bicarbonato de sódio. Quando aquecido ou exposto a um ácido como o ácido acético (vinagre), o bicarbonato de sódio libera dióxido de carbono. Isso é usado como um agente de fermentação na panificação.
O bicarbonato de amônio é utilizado na fabricação de biscoitos digestivos.
Diagnóstico
Na medicina diagnóstica, o valor do bicarbonato no sangue é um dos vários indicadores do estado da fisiologia ácido-base no corpo. Ele é medido, juntamente com dióxido de carbono, cloreto, potássio e sódio, para avaliar os níveis de eletrólitos em um teste de painel de eletrólitos (que tem a terminologia de procedimento atual, CPT, código 80051).
O parâmetro concentração padrão de bicarbonato (SBCe) é a concentração de bicarbonato no sangue a uma PaCO2 de 40 mmHg (5,33 kPa), saturação total de oxigênio e 36 ° C.
Compostos de bicarbonato
- Bicarbonato de sódio
- Bicarbonato de potássio
- Bicarbonato de cálcio
- Bicarbonato de magnésio
- Bicarbonato de cálcio
- Bicarbonato de amônio
- Ácido carbono
Contenido relacionado
Eletroforese em gel de agarose
Bohrium
Reação ácido-base