Berílio
Berílio é um elemento químico com o símbolo Be e número atômico 4. É um metal alcalino-terroso cinza-aço, forte, leve e quebradiço. É um elemento bivalente que ocorre naturalmente apenas em combinação com outros elementos para formar minerais. Gemas notáveis ricas em berílio incluem berilo (água-marinha, esmeralda) e crisoberilo. É um elemento relativamente raro no universo, geralmente ocorrendo como produto da fragmentação de núcleos atômicos maiores que colidiram com raios cósmicos. Dentro dos núcleos das estrelas, o berílio é esgotado à medida que se funde em elementos mais pesados. O berílio constitui cerca de 0,0004 por cento em massa da crosta terrestre. A produção mundial anual de berílio de 220 toneladas é geralmente fabricada pela extração do mineral berilo, um processo difícil porque o berílio se liga fortemente ao oxigênio.
Em aplicações estruturais, a combinação de alta rigidez flexural, estabilidade térmica, condutividade térmica e baixa densidade (1,85 vezes a da água) torna o berílio metálico um material aeroespacial desejável para componentes de aeronaves, mísseis, espaçonaves e satélites. Devido à sua baixa densidade e massa atômica, o berílio é relativamente transparente aos raios X e outras formas de radiação ionizante; portanto, é o material de janela mais comum para equipamentos de raios X e componentes de detectores de partículas. Quando adicionado como elemento de liga ao alumínio, cobre (principalmente a liga de cobre berílio), ferro ou níquel, o berílio melhora muitas propriedades físicas. Por exemplo, ferramentas e componentes feitos de ligas de cobre berílio são fortes e duros e não criam faíscas quando atingem uma superfície de aço. No ar, a superfície do berílio oxida prontamente à temperatura ambiente para formar uma camada de passivação de 1 a 10 nm de espessura que o protege de oxidação e corrosão adicionais. O metal oxida em massa (além da camada de passivação) quando aquecido acima de 500 °C (932 °F) e queima brilhantemente quando aquecido a cerca de 2.500 °C (4.530 °F).
O uso comercial de berílio requer o uso de equipamentos apropriados de controle de poeira e controles industriais em todos os momentos devido à toxicidade das poeiras contendo berílio inaladas que podem causar uma doença alérgica crônica com risco de vida em algumas pessoas chamada beriliose. A beriliose causa pneumonia e outras doenças respiratórias associadas.
Características
Propriedades físicas
O berílio é um metal cinza e duro que é frágil à temperatura ambiente e possui uma estrutura cristalina hexagonal compacta. Possui rigidez excepcional (módulo de Young 287 GPa) e um ponto de fusão de 1287 °C. O módulo de elasticidade do berílio é aproximadamente 50% maior que o do aço. A combinação desse módulo e uma densidade relativamente baixa resulta em uma velocidade de condução de som excepcionalmente rápida no berílio - cerca de 12,9 km/s em condições ambientais. Outras propriedades significativas são o alto calor específico (1925 J·kg−1·K−1) e condutividade térmica (216 W·m−1 ·K−1), que fazem do berílio o metal com as melhores características de dissipação de calor por unidade de peso. Em combinação com o coeficiente relativamente baixo de expansão térmica linear (11,4×10−6 K−1), essas características resultam em uma estabilidade única sob condições de carga térmica.
Propriedades nucleares
O berílio que ocorre naturalmente, exceto por uma leve contaminação pelos radioisótopos cosmogênicos, é o berílio-9 isotopicamente puro, que tem um spin nuclear de 3/2. O berílio tem uma grande seção transversal de espalhamento para nêutrons de alta energia, cerca de 6 celeiros para energias acima de aproximadamente 10 keV. Portanto, ele funciona como um refletor de nêutrons e moderador de nêutrons, efetivamente desacelerando os nêutrons para a faixa de energia térmica abaixo de 0,03 eV, onde a seção transversal total é pelo menos uma ordem de magnitude menor; o valor exato depende fortemente da pureza e tamanho dos cristalitos no material.
O único isótopo de berílio primordial 9Be também sofre uma reação de nêutrons (n,2n) com energias de nêutrons acima de 1,9 MeV, para produzir 8Be, que quase imediatamente se divide em duas partículas alfa. Assim, para nêutrons de alta energia, o berílio é um multiplicador de nêutrons, liberando mais nêutrons do que absorve. Esta reação nuclear é:
- 9
4Ser
+ n → 2 4
2Ele.
+ 2 n
Os nêutrons são liberados quando os núcleos de berílio são atingidos por partículas alfa energéticas que produzem a reação nuclear
- 9
4Ser
+ 4
2Ele.
→ 12
6C
+ n
onde 4
2Ele
é um alfa partícula e 12
6C
é um núcleo de carbono-12.
O berílio também libera nêutrons sob bombardeio de raios gama. Assim, o berílio natural bombardeado por alfas ou gamas de um radioisótopo adequado é um componente chave da maioria das fontes de nêutrons de reação nuclear alimentadas por radioisótopos para a produção laboratorial de nêutrons livres.
Pequenas quantidades de trítio são liberadas quando 9
4Ser
núcleos absorvem nêutrons de baixa energia na reação nuclear de três etapas
- 9
4Ser
+ n → 4
2Ele.
+ 6
2Ele.
, 6
2Ele.
→ 6
3Li
+ β- Sim., 6
3Li
+ n → 4
2Ele.
+ 3
1H. H. H.
Observe que 6
2Ele
tem um meia-vida de apenas 0,8 segundos, β− é um elétron e 6
3Li
tem uma alta seção transversal de absorção de nêutrons. O trítio é um radioisótopo preocupante em fluxos de resíduos de reatores nucleares.
Propriedades ópticas
Como um metal, o berílio é transparente ou translúcido para a maioria dos comprimentos de onda de raios-X e raios gama, tornando-o útil para as janelas de saída de tubos de raios-X e outros aparelhos semelhantes.
Isótopos e nucleossíntese
Ambos os isótopos estáveis e instáveis de berílio são criados nas estrelas, mas os radioisótopos não duram muito. Acredita-se que a maior parte do berílio estável no universo foi originalmente criado no meio interestelar quando os raios cósmicos induziram a fissão em elementos mais pesados encontrados no gás e poeira interestelar. O berílio primordial contém apenas um isótopo estável, 9Be, e, portanto, o berílio é um elemento monoisotópico e mononuclídico.
O 10Be radioativo cosmogênico é produzido na atmosfera da Terra pela espalação de raios cósmicos de oxigênio. 10Be se acumula na superfície do solo, onde sua meia-vida relativamente longa (1,36 milhões de anos) permite um longo tempo de residência antes de decair para boro-10. Assim, 10Be e seus produtos derivados são usados para examinar a erosão natural do solo, a formação do solo e o desenvolvimento de solos lateríticos, e como um proxy para medir as variações na atividade solar e a idade dos núcleos de gelo. A produção de 10Be é inversamente proporcional à atividade solar, porque o aumento do vento solar durante períodos de alta atividade solar diminui o fluxo de raios cósmicos galácticos que atingem a Terra. Explosões nucleares também formam 10Be pela reação de nêutrons rápidos com 13C no dióxido de carbono no ar. Este é um dos indicadores de atividade passada em locais de teste de armas nucleares. O isótopo 7Be (meia-vida de 53 dias) também é cosmogênico, e mostra uma abundância atmosférica ligada a manchas solares, bem como 10Be.
8Be tem uma meia-vida muito curta de cerca de 8×10−17 s que contribui para seu papel cosmológico significativo, pois elementos mais pesados que o berílio não poderiam ter sido produzidos por energia nuclear fusão no Big Bang. Isso se deve à falta de tempo suficiente durante a fase de nucleossíntese do Big Bang para produzir carbono pela fusão de núcleos 4He e as concentrações muito baixas de berílio-8 disponível. O astrônomo britânico Sir Fred Hoyle mostrou pela primeira vez que os níveis de energia de 8Be e 12C permitem a produção de carbono pelo chamado processo triplo-alfa em estrelas alimentadas com hélio, onde mais tempo de nucleossíntese está disponível. Este processo permite que o carbono seja produzido nas estrelas, mas não no Big Bang. O carbono criado pelas estrelas (a base da vida baseada no carbono) é, portanto, um componente dos elementos do gás e da poeira ejetados pelas estrelas AGB e supernovas (ver também nucleossíntese do Big Bang), bem como a criação de todos os outros elementos com propriedades atômicas. números maiores que o do carbono.
Os elétrons 2s do berílio podem contribuir para a ligação química. Portanto, quando 7Be decai por captura de elétrons-L, ele o faz retirando elétrons de seus orbitais atômicos que podem estar participando da ligação. Isso torna sua taxa de decaimento dependente em um grau mensurável de seus arredores químicos - uma ocorrência rara em decaimento nuclear.
O isótopo conhecido de vida mais curta do berílio é 16Be, que decai por emissão de nêutrons com uma meia-vida de 6,5×10−22 s. Os isótopos exóticos 11Be e 14Be são conhecidos por exibirem um halo nuclear. Este fenômeno pode ser entendido como os núcleos de 11Be e 14Be têm, respectivamente, 1 e 4 nêutrons orbitando substancialmente fora da clássica 'waterdrop' modelo do núcleo.
Ocorrência
O Sol tem uma concentração de 0,1 partes por bilhão (ppb) de berílio. O berílio tem uma concentração de 2 a 6 partes por milhão (ppm) na crosta terrestre. É mais concentrado nos solos, 6 ppm. Traços de 9Be são encontrados na atmosfera da Terra. A concentração de berílio na água do mar é de 0,2 a 0,6 partes por trilhão. Na água corrente, no entanto, o berílio é mais abundante com uma concentração de 0,1 ppb.
O berílio é encontrado em mais de 100 minerais, mas a maioria é incomum a rara. Os minerais contendo berílio mais comuns incluem: bertrandita (Be4Si2O7(OH)2), berilo (Al2Be3Si6O18), crisoberilo (Al2BeO4) e fenakita (Be2SiO4). Formas preciosas de berilo são água-marinha, berilo vermelho e esmeralda. A cor verde nas formas de berilo com qualidade de gema vem de quantidades variáveis de cromo (cerca de 2% para esmeralda).
Os dois principais minérios de berílio, berilo e bertrandita, são encontrados na Argentina, Brasil, Índia, Madagascar, Rússia e Estados Unidos. As reservas mundiais totais de minério de berílio são superiores a 400.000 toneladas.
Produção
A extração do berílio de seus compostos é um processo difícil devido à sua alta afinidade pelo oxigênio em temperaturas elevadas, e sua capacidade de reduzir a água quando seu filme de óxido é removido. Atualmente, os Estados Unidos, a China e o Cazaquistão são os únicos três países envolvidos na extração de berílio em escala industrial. O Cazaquistão produz berílio a partir de um concentrado estocado antes da dissolução da União Soviética, por volta de 1991. Esse recurso quase se esgotou em meados da década de 2010.
A produção de berílio na Rússia foi interrompida em 1997 e está planejada para ser retomada na década de 2020.
O berílio é mais comumente extraído do mineral berilo, que é sinterizado usando um agente de extração ou fundido em uma mistura solúvel. O processo de sinterização envolve a mistura de berilo com fluorosilicato de sódio e soda a 770 °C (1.420 °F) para formar fluoroberilato de sódio, óxido de alumínio e dióxido de silício. O hidróxido de berílio é precipitado de uma solução de fluoroberilato de sódio e hidróxido de sódio em água. A extração de berílio usando o método de fusão envolve a moagem de berilo em pó e o aquecimento a 1.650 °C (3.000 °F). O fundido é rapidamente resfriado com água e depois reaquecido de 250 a 300 °C (482 a 572 °F) em ácido sulfúrico concentrado, produzindo principalmente sulfato de berílio e sulfato de alumínio. A amônia aquosa é então usada para remover o alumínio e o enxofre, deixando o hidróxido de berílio.
O hidróxido de berílio criado usando o método de sínter ou fusão é então convertido em fluoreto de berílio ou cloreto de berílio. Para formar o fluoreto, o fluoreto de hidrogênio de amônio aquoso é adicionado ao hidróxido de berílio para produzir um precipitado de tetrafluoroberilato de amônio, que é aquecido a 1.000 °C (1.830 °F) para formar o fluoreto de berílio. O aquecimento do flúor a 900 °C (1.650 °F) com magnésio forma o berílio finamente dividido e o aquecimento adicional a 1.300 °C (2.370 °F) cria o metal compacto. O aquecimento do hidróxido de berílio forma o óxido, que se torna cloreto de berílio quando combinado com carbono e cloro. A eletrólise do cloreto de berílio fundido é então usada para obter o metal.
Propriedades químicas
Um átomo de berílio tem a configuração eletrônica [He] 2s2. O estado de oxidação predominante do berílio é +2; o átomo de berílio perdeu seus dois elétrons de valência. Estados de oxidação mais baixos foram encontrados, por exemplo, em compostos bis(carbeno). O comportamento químico do berílio é em grande parte resultado de seus pequenos raios atômicos e iônicos. Assim, possui potenciais de ionização muito altos e forte polarização quando ligado a outros átomos, razão pela qual todos os seus compostos são covalentes. Sua química tem semelhanças com a do alumínio, um exemplo de relação diagonal.
À temperatura ambiente, a superfície do berílio forma uma camada de passivação de óxido de 1 a 10 nm de espessura que evita novas reações com o ar, exceto pelo espessamento gradual do óxido até cerca de 25 nm. Quando aquecido acima de cerca de 500 °C, a oxidação no metal a granel progride ao longo dos contornos de grão. Uma vez que o metal é inflamado no ar por aquecimento acima do ponto de fusão do óxido em torno de 2500 °C, o berílio queima brilhantemente, formando uma mistura de óxido de berílio e nitreto de berílio. O berílio se dissolve facilmente em ácidos não oxidantes, como HCl e H2SO4 diluído, mas não em ácido nítrico ou água, pois isso forma o óxido. Este comportamento é semelhante ao do metal alumínio. O berílio também se dissolve em soluções alcalinas.
Compostos binários de berílio(II) são poliméricos no estado sólido. BeF2 tem uma estrutura semelhante à sílica com tetraedros BeF4 compartilhados nos cantos. BeCl2 e BeBr2 têm estruturas de cadeia com tetraedros compartilhados na borda. O óxido de berílio, BeO, é um sólido refratário branco, que possui a estrutura cristalina wurtzita e uma condutividade térmica tão alta quanto alguns metais. BeO é anfótero. Sulfeto de berílio, seleneto e telureto são conhecidos, todos possuindo a estrutura da mistura de zinco. O nitreto de berílio, Be3N2 é um composto de alto ponto de fusão que é facilmente hidrolisado. Azida de berílio, BeN6 é conhecida e fosfeto de berílio, Be3P2 tem uma estrutura semelhante a Be3 N2. Vários boretos de berílio são conhecidos, como Be5B, Be4B, Be2B, BeB2, BeB6 e BeB12. O carboneto de berílio, Be2C, é um composto refratário vermelho-tijolo que reage com a água para formar metano. Nenhum siliceto de berílio foi identificado.
Os haletos BeX2 (X = F, Cl, Br, I) possuem uma estrutura molecular monomérica linear na fase gasosa. Os complexos dos haletos são formados com um ou mais ligantes doando no total dois pares de elétrons. Tais compostos obedecem à regra do octeto. Outros complexos de 4 coordenadas como o aqua-ion [Be(H2O)4]2+ também obedecem à regra do octeto.
Soluções aquosas
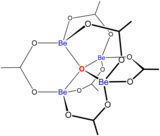
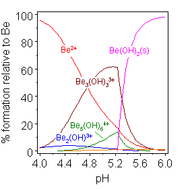
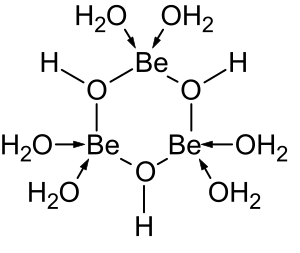
A química da solução aquosa de berílio é objeto de uma revisão abrangente. Soluções de sais de berílio, como sulfato de berílio e nitrato de berílio, são ácidas devido à hidrólise do [Be(H2O)4]2+ íon. A concentração do primeiro produto de hidrólise, [Be(H2O)3(OH)]+, é inferior a 1% do concentração de berílio. O produto de hidrólise mais estável é o íon trimérico [Be3(OH)3(H2O)6 ]3+. O hidróxido de berílio, Be(OH)2, é insolúvel em água com pH 5 ou mais. Consequentemente, os compostos de berílio são geralmente insolúveis em pH biológico. Por causa disso, a inalação de pó de metal de berílio por pessoas leva ao desenvolvimento da condição fatal de beriliose. Be(OH)2 dissolve-se em soluções fortemente alcalinas.
Beryllium (II) forma alguns complexos com ligantes monodentados porque as moléculas de água no aquo-ion, Não.Ser(H. H. H.2O)4]2+{displaystyle {ce {[Be(H_2O)_4]^{2+}} estão ligados muito fortemente ao íon de berílio. Excepções notáveis são a série de complexos solúvel em água com o íon de fluoreto.
- Não.Ser(H. H. H.2O)4]2++NF- Sim. - Sim. ⇋ ⇋ SerNão.(H. H. H.2O)2- Sim. - Sim. nFn](2- Sim. - Sim. n)± ± +n H. H. H.2O{displaystyle {ce {[Be(H_{2}O)_{4}]^{2+}{+}nF^{-}leftrightharpoons Be[(H_{2}O)_{2-n}F_{n}]^{(2-n)pm - Sim.
Beryllium (II) forma muitos complexos com ligantes bidentados contendo átomos de oxigênio-donor. A espécie Não.Ser3O(H. H. H.2PODE4)6]2- Sim. - Sim. {displaystyle {ce {[Be_3O(H_2PO_4)_6]^{2-}}}} é notável por ter um íon de óxido de 3 coordenadas em seu centro. Acetato de berílio básico, Ser4O(OA)6{displaystyle {ce {Be_4 O(OAc)_6}}}, tem um íon de óxido cercado por um tetraedro de átomos de berílio.
Com ligantes orgânicos, como o íon malonato, o ácido é desprotonado ao formar o complexo. Os átomos doadores são dois oxigênios.
- H. H. H.2A+Não.Ser(H. H. H.2O)4]2+⇋ ⇋ Não.BeA(H. H. H.2O)2]+2H. H. H.++2H. H. H.2ONão. {H_{2}A{+}[Be(H_{2}O)_{4}]^{2+}leftrightharpoons [BeA(H_{2}O)_{2}]{+}2H^{+}{+}2H_{2}O}}}
- H. H. H.2A+Não.BeA(H. H. H.2O)2]⇋ ⇋ Não.BeA2]2- Sim. - Sim. +2H. H. H.++2H. H. H.2ONão. {H_{2}A{+}[BeA(H_{2}O)_{2}]leftrightharpoons [BeA_{2}]^{2-}{+}2H^{+}{+}2H_{2}O}}}
A formação de um complexo está em competição com a reação de hidrólise do íon metálico e também são formados complexos mistos com o ânion e o íon hidróxido. Por exemplo, são conhecidos derivados do trímero cíclico, com um ligante bidentado substituindo um ou mais pares de moléculas de água. Ligandos como o EDTA comportam-se como ácidos dicarboxílicos.
Ácidos hidroxicarboxílicos como o ácido glicólico formam um pouco fraco, monodentato, complexos em solução em que o grupo hidroxil permanece intacto. Um hexamer, Nao4Não.Ser6(O2(O)O)6](Na_4[Be_6(OCH_2(O)O)_6]}, em que os grupos hidroxila são deprotonados foi isolado, no estado sólido, há muito tempo. Os ligantes di-hidroxi aromáticos formam complexos relativamente fortes. Por exemplo, log K1 e log K2 valores de 12,2 e 9,3 foram relatados para complexos com tiron.
Existem muitos relatos iniciais de complexos com aminoácidos, mas infelizmente eles não são confiáveis, pois as reações de hidrólise concomitantes não eram compreendidas no momento da publicação. Valores para log β de ca. 6 a 7 foram relatados. O grau de formação é pequeno devido à competição com as reações de hidrólise.
Química orgânica
A química do organoberílio é limitada à pesquisa acadêmica devido ao custo e toxicidade do berílio, derivados do berílio e reagentes necessários para a introdução do berílio, como o cloreto de berílio. Os compostos organometálicos de berílio são conhecidos por serem altamente reativos. Exemplos de compostos organometálicos conhecidos são dineopentilberílio, beriloceno (Cp2Be), dialilberílio (por reação de troca de dietil berílio com trialil boro), bis(1,3-trimetilsililalil)berílio e Be(mes)2. Os ligantes também podem ser aris e alquinis.
História
O mineral berilo, que contém berílio, tem sido usado pelo menos desde a dinastia ptolomaica do Egito. No primeiro século EC, o naturalista romano Plínio, o Velho, mencionou em sua enciclopédia História Natural que o berilo e a esmeralda ("smaragdus") eram semelhantes. O Papyrus Graecus Holmiensis, escrito no terceiro ou quarto século EC, contém notas sobre como preparar esmeralda e berilo artificiais.
As primeiras análises de esmeraldas e berilos por Martin Heinrich Klaproth, Torbern Olof Bergman, Franz Karl Achard e Johann Jakob Bindheim sempre produziram elementos semelhantes, levando à conclusão equivocada de que ambas as substâncias são silicatos de alumínio. O mineralogista René Just Haüy descobriu que ambos os cristais são geometricamente idênticos e pediu ao químico Louis-Nicolas Vauquelin uma análise química.
Em um artigo de 1798 lido perante o Institut de France, Vauquelin relatou ter encontrado uma nova "terra" dissolvendo hidróxido de alumínio de esmeralda e berilo em um álcali adicional. Os editores da revista Annales de Chimie et de Physique chamaram a nova terra de "glucina" pelo sabor doce de alguns de seus compostos. Klaproth preferiu o nome "beryllina" devido ao fato de que a ítria também formava sais doces. O nome "berílio" foi usado pela primeira vez por Wöhler em 1828.
Friedrich Wöhler e Antoine Bussy isolaram independentemente o berílio em 1828 pela reação química do potássio metálico com cloreto de berílio, como segue:
- BeCl2 + 2 K → 2 KCl + Ser
Usando uma lâmpada de álcool, Wöhler aqueceu camadas alternadas de cloreto de berílio e potássio em um cadinho de platina fechado por fio. A reação acima ocorreu imediatamente e fez com que o cadinho se tornasse branco quente. Após resfriar e lavar o pó cinza-escuro resultante, ele viu que era feito de partículas finas com um brilho metálico escuro. O potássio altamente reativo havia sido produzido pela eletrólise de seus compostos, processo descoberto 21 anos antes. O método químico usando potássio produziu apenas pequenos grãos de berílio, dos quais nenhum lingote de metal poderia ser fundido ou martelado.
A eletrólise direta de uma mistura fundida de fluoreto de berílio e fluoreto de sódio por Paul Lebeau em 1898 resultou nas primeiras amostras puras (99,5 a 99,8%) de berílio. No entanto, a produção industrial começou apenas após a Primeira Guerra Mundial. O envolvimento industrial original incluía subsidiárias e cientistas relacionados à Union Carbide and Carbon Corporation em Cleveland, Ohio, e Siemens & Halske AG em Berlim. Nos Estados Unidos, o processo foi conduzido por Hugh S. Cooper, diretor da The Kemet Laboratories Company. Na Alemanha, o primeiro processo comercialmente bem-sucedido para a produção de berílio foi desenvolvido em 1921 por Alfred Stock e Hans Goldschmidt.
Uma amostra de berílio foi bombardeada com raios alfa do decaimento do rádio em um experimento de 1932 de James Chadwick que descobriu a existência do nêutron. Esse mesmo método é usado em uma classe de fontes de nêutrons de laboratório baseadas em radioisótopos que produzem 30 nêutrons para cada milhão de partículas α.
A produção de berílio teve um rápido aumento durante a Segunda Guerra Mundial, devido à crescente demanda por ligas duras de cobre-berílio e fósforo para lâmpadas fluorescentes. A maioria das primeiras lâmpadas fluorescentes usava ortossilicato de zinco com conteúdo variável de berílio para emitir luz esverdeada. Pequenas adições de tungstato de magnésio melhoraram a parte azul do espectro para produzir uma luz branca aceitável. Os fósforos à base de halofosfato substituíram os fósforos à base de berílio depois que o berílio foi considerado tóxico.
A eletrólise de uma mistura de fluoreto de berílio e fluoreto de sódio foi usada para isolar o berílio durante o século XIX. O alto ponto de fusão do metal torna esse processo mais consumidor de energia do que os processos correspondentes usados para os metais alcalinos. No início do século 20, a produção de berílio pela decomposição térmica do iodeto de berílio foi investigada após o sucesso de um processo semelhante para a produção de zircônio, mas esse processo provou ser antieconômico para produção em volume.
O berílio metálico puro não se tornou prontamente disponível até 1957, embora tenha sido usado como metal de liga para endurecer e endurecer o cobre muito antes. O berílio pode ser produzido pela redução de compostos de berílio, como cloreto de berílio, com potássio metálico ou sódio. Atualmente, a maior parte do berílio é produzida pela redução do fluoreto de berílio com magnésio. O preço no mercado americano de lingotes de berílio fundido a vácuo era de cerca de US$ 338 por libra (US$ 745 por quilo) em 2001.
Entre 1998 e 2008, a produção mundial de berílio diminuiu de 343 para cerca de 200 toneladas. Em seguida, aumentou para 230 toneladas em 2018, das quais 170 toneladas vieram dos Estados Unidos.
Etimologia
Nomeado após o berilo, um mineral semiprecioso, do qual foi isolado pela primeira vez.
Aplicativos
Janelas de radiação
Devido ao seu baixo número atômico e baixíssima absorção de raios-X, a aplicação mais antiga e ainda uma das mais importantes do berílio é em janelas de radiação para tubos de raios-X. Exigências extremas são colocadas na pureza e limpeza do berílio para evitar artefatos nas imagens de raios-X. Folhas finas de berílio são usadas como janelas de radiação para detectores de raios X, e a absorção extremamente baixa minimiza os efeitos de aquecimento causados por raios X de alta intensidade e baixa energia, típicos da radiação síncrotron. Janelas à prova de vácuo e tubos de feixe para experimentos de radiação em síncrotrons são fabricados exclusivamente a partir de berílio. Em configurações científicas para vários estudos de emissão de raios-X (por exemplo, espectroscopia de raios-X de energia dispersiva), o porta-amostra é geralmente feito de berílio porque seus raios-X emitidos têm energias muito mais baixas (≈100 eV) do que os raios-X da maioria materiais estudados.
O baixo número atômico também torna o berílio relativamente transparente para partículas energéticas. Portanto, é usado para construir o tubo de feixe em torno da região de colisão em configurações de física de partículas, como todos os quatro principais experimentos de detectores no Grande Colisor de Hádrons (ALICE, ATLAS, CMS, LHCb), no Tevatron e no SLAC. A baixa densidade do berílio permite que os produtos de colisão cheguem aos detectores circundantes sem interação significativa, sua rigidez permite que um poderoso vácuo seja produzido dentro do tubo para minimizar a interação com gases, sua estabilidade térmica permite que funcione corretamente em temperaturas de apenas alguns graus acima do zero absoluto, e sua natureza diamagnética o impede de interferir com os complexos sistemas magnéticos multipolares usados para direcionar e focar os feixes de partículas.
Aplicações mecânicas
Devido à sua rigidez, leveza e estabilidade dimensional em uma ampla faixa de temperatura, o berílio metálico é usado para componentes estruturais leves nas indústrias de defesa e aeroespacial em aeronaves de alta velocidade, mísseis guiados, espaçonaves e satélites, incluindo o James Telescópio Espacial Webb. Vários foguetes de combustível líquido usaram bicos de foguetes feitos de berílio puro. O pó de berílio foi estudado como combustível de foguetes, mas esse uso nunca se materializou. Um pequeno número de quadros de bicicletas extremamente sofisticados foi construído com berílio. De 1998 a 2000, a equipe de Fórmula 1 da McLaren usou motores Mercedes-Benz com pistões de liga de alumínio e berílio. O uso de componentes de motor de berílio foi proibido após um protesto da Scuderia Ferrari.
A mistura de cerca de 2,0% de berílio em cobre forma uma liga chamada cobre-berílio que é seis vezes mais forte que o cobre sozinho. As ligas de berílio são usadas em muitas aplicações devido à sua combinação de elasticidade, alta condutividade elétrica e térmica, alta resistência e dureza, propriedades não magnéticas, bem como boa resistência à corrosão e à fadiga. Essas aplicações incluem ferramentas não faiscantes que são usadas perto de gases inflamáveis (berílio-níquel), em molas e membranas (berílio-níquel e berílio-ferro) usadas em instrumentos cirúrgicos e dispositivos de alta temperatura. Tão pouco quanto 50 partes por milhão de berílio ligado com magnésio líquido leva a um aumento significativo na resistência à oxidação e diminuição na inflamabilidade.
A alta rigidez elástica do berílio levou ao seu uso extensivo em instrumentação de precisão, por ex. em sistemas de orientação inercial e nos mecanismos de suporte para sistemas ópticos. As ligas de cobre-berílio também foram aplicadas como agente de endurecimento nas "pistolas Jason", usadas para remover a tinta dos cascos dos navios.
O berílio também foi usado para cantilevers em agulhas de cartucho fonográfico de alto desempenho, onde sua extrema rigidez e baixa densidade permitiam que os pesos de rastreamento fossem reduzidos para 1 grama, mas ainda rastreiam passagens de alta frequência com distorção mínima.
Uma das principais aplicações anteriores do berílio foi em freios para aviões militares por causa de sua dureza, alto ponto de fusão e capacidade excepcional de dissipar o calor. Considerações ambientais levaram à substituição por outros materiais.
Para reduzir custos, o berílio pode ser ligado com quantidades significativas de alumínio, resultando na liga AlBeMet (um nome comercial). Esta mistura é mais barata que o berílio puro, mantendo muitas propriedades desejáveis.
Espelhos
Os espelhos de berílio são de particular interesse. Espelhos de grande área, frequentemente com uma estrutura de suporte em favo de mel, são usados, por exemplo, em satélites meteorológicos onde o baixo peso e a estabilidade dimensional a longo prazo são críticos. Espelhos de berílio menores são usados em sistemas de orientação ótica e em sistemas de controle de incêndio, por exemplo. nos tanques de batalha principais Leopard 1 e Leopard 2, de fabricação alemã. Nesses sistemas, é necessário um movimento muito rápido do espelho, o que novamente determina baixa massa e alta rigidez. Normalmente, o espelho de berílio é revestido com revestimento de níquel químico duro, que pode ser mais facilmente polido para um acabamento óptico mais fino do que o berílio. Em algumas aplicações, porém, o bloco de berílio é polido sem qualquer revestimento. Isso é particularmente aplicável à operação criogênica em que a incompatibilidade da expansão térmica pode causar a deformação do revestimento.
O Telescópio Espacial James Webb tem 18 seções hexagonais de berílio para seus espelhos, cada uma revestida com uma fina camada de ouro. Como o JWST enfrentará uma temperatura de 33 K, o espelho é feito de berílio banhado a ouro, capaz de lidar com o frio extremo melhor do que o vidro. O berílio se contrai e se deforma menos que o vidro – e permanece mais uniforme – nessas temperaturas. Pela mesma razão, a ótica do Telescópio Espacial Spitzer é inteiramente construída de berílio metálico.
Aplicações magnéticas
O berílio não é magnético. Portanto, as ferramentas fabricadas com materiais à base de berílio são usadas por equipes de descarte de munições explosivas navais ou militares para trabalhar em ou perto de minas navais, uma vez que essas minas geralmente possuem espoletas magnéticas. Eles também são encontrados em materiais de manutenção e construção perto de máquinas de ressonância magnética (MRI) por causa dos altos campos magnéticos gerados. Nos campos das comunicações de rádio e radares poderosos (geralmente militares), ferramentas manuais feitas de berílio são usadas para sintonizar os altamente magnéticos klystrons, magnetrons, tubos de ondas progressivas, etc., que são usados para gerar altos níveis de potência de micro-ondas nos transmissores.
Aplicações nucleares
Placas finas ou folhas de berílio às vezes são usadas em projetos de armas nucleares como a camada mais externa dos poços de plutônio nos estágios primários de bombas termonucleares, colocadas para cercar o material físsil. Essas camadas de berílio são bons "empurradores" para a implosão do plutônio-239, e são bons refletores de nêutrons, assim como em reatores nucleares moderados a berílio.
O berílio também é comumente usado em algumas fontes de nêutrons em dispositivos de laboratório nos quais relativamente poucos nêutrons são necessários (em vez de ter que usar um reator nuclear ou um gerador de nêutrons alimentado por um acelerador de partículas). Para isso, um alvo de berílio-9 é bombardeado com partículas alfa energéticas de um radioisótopo como polônio-210, rádio-226, plutônio-238 ou amerício-241. Na reação nuclear que ocorre, um núcleo de berílio é transmutado em carbono-12 e um nêutron livre é emitido, viajando aproximadamente na mesma direção que a partícula alfa estava indo. Tais fontes de nêutrons de berílio impulsionadas pelo decaimento alfa, chamadas de "ouriço" iniciadores de nêutrons, foram usados em algumas das primeiras bombas atômicas. Fontes de nêutrons nas quais o berílio é bombardeado com raios gama de um radioisótopo de decaimento gama também são usadas para produzir nêutrons de laboratório.
O berílio também é usado na fabricação de combustível para reatores CANDU. Os elementos de combustível têm pequenos apêndices que são soldados por resistência ao revestimento de combustível usando um processo de brasagem por indução com Be como material de enchimento de brasagem. As almofadas de rolamento são soldadas no local para evitar o contato entre o feixe de combustível e o tubo de pressão que o contém, e as almofadas espaçadoras entre os elementos são soldadas para evitar o contato elemento a elemento.
O berílio também é usado no laboratório de pesquisa de fusão nuclear Joint European Torus, e será usado no mais avançado ITER para condicionar os componentes que enfrentam o plasma. O berílio também foi proposto como material de revestimento para barras de combustível nuclear, devido à sua boa combinação de propriedades mecânicas, químicas e nucleares. O fluoreto de berílio é um dos sais constituintes da mistura de sal eutético FLiBe, que é usado como solvente, moderador e refrigerante em muitos projetos hipotéticos de reatores de sal fundido, incluindo o reator de tório e fluoreto líquido (LFTR).
Acústica
O baixo peso e a alta rigidez do berílio o tornam útil como material para drivers de alto-falantes de alta frequência. Como o berílio é caro (muitas vezes mais do que o titânio), difícil de moldar devido à sua fragilidade e tóxico se for mal manuseado, os tweeters de berílio são limitados a aplicações domésticas, de áudio profissional e de alto-falantes. Alguns produtos de alta fidelidade foram reivindicados de forma fraudulenta como sendo feitos do material.
Alguns cartuchos fonográficos de última geração usavam cantilevers de berílio para melhorar o rastreamento reduzindo a massa.
Eletrônico
O berílio é um dopante do tipo p em semicondutores compostos III-V. É amplamente utilizado em materiais como GaAs, AlGaAs, InGaAs e InAlAs cultivados por epitaxia de feixe molecular (MBE). A folha de berílio enrolada cruzada é um excelente suporte estrutural para placas de circuito impresso na tecnologia de montagem em superfície. Em aplicações eletrônicas críticas, o berílio é um suporte estrutural e um dissipador de calor. A aplicação também requer um coeficiente de expansão térmica que seja bem compatível com os substratos de alumina e vidro de poliimida. O composto de óxido de berílio-berílio "E-Materials" foram especialmente projetados para essas aplicações eletrônicas e têm a vantagem adicional de que o coeficiente de expansão térmica pode ser adaptado para combinar com diversos materiais de substrato.
O óxido de berílio é útil para muitas aplicações que requerem as propriedades combinadas de um isolante elétrico e um excelente condutor de calor, com alta resistência e dureza e um ponto de fusão muito alto. O óxido de berílio é freqüentemente usado como placa de base isolante em transistores de alta potência em transmissores de radiofrequência para telecomunicações. O óxido de berílio também está sendo estudado para uso no aumento da condutividade térmica de pastilhas de combustível nuclear de dióxido de urânio. Compostos de berílio foram usados em tubos de iluminação fluorescente, mas esse uso foi interrompido por causa da doença beriliose que se desenvolveu nos trabalhadores que fabricavam os tubos.
Saúde
O berílio é um componente de várias ligas odontológicas.
Toxicidade e segurança
Efeitos biológicos
Aproximadamente 35 microgramas de berílio são encontrados no corpo humano médio, uma quantidade não considerada prejudicial. O berílio é quimicamente semelhante ao magnésio e, portanto, pode deslocá-lo das enzimas, causando mau funcionamento. Como o Be2+ é um íon altamente carregado e pequeno, ele pode entrar facilmente em muitos tecidos e células, onde atinge especificamente os núcleos celulares, inibindo muitas enzimas, incluindo aquelas usadas para sintetizar o DNA. Sua toxicidade é exacerbada pelo fato de que o corpo não tem como controlar os níveis de berílio e, uma vez dentro do corpo, o berílio não pode ser removido.
Inalação
A beriliose crônica é uma doença granulomatosa pulmonar e sistêmica causada pela inalação de poeiras ou vapores contaminados com berílio; grandes quantidades em um curto período de tempo ou pequenas quantidades em um longo período de tempo podem levar a essa doença. Os sintomas da doença podem demorar até cinco anos para se desenvolver; cerca de um terço dos pacientes morrem e os sobreviventes ficam incapacitados. A Agência Internacional de Pesquisa sobre o Câncer (IARC) lista o berílio e compostos de berílio como cancerígenos de categoria 1.
Exposição ocupacional
Nos EUA, a Occupational Safety and Health Administration (OSHA) designou um limite de exposição permissível (PEL) para berílio e compostos de berílio de 0,2 µg/m3 como um tempo de 8 horas- média ponderada (TWA) e 2,0 µg/m3 como um limite de exposição de curto prazo durante um período de amostragem de 15 minutos. O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH) estabeleceu um limite superior de exposição recomendado (REL) de 0,5 µg/m3. O valor IDLH (imediatamente perigoso para a vida e a saúde) é de 4 mg/m3. A toxicidade do berílio está no mesmo nível de outros metaloides/metais tóxicos, como arsênico e mercúrio.
A exposição ao berílio no local de trabalho pode levar a uma resposta imunológica de sensibilização e, ao longo do tempo, desenvolver a doença crônica do berílio (CBD). O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH) nos Estados Unidos pesquisa esses efeitos em colaboração com um grande fabricante de produtos de berílio. O NIOSH também realiza pesquisas genéticas sobre sensibilização e CBD, independentemente dessa colaboração.
A doença aguda do berílio na forma de pneumonite química foi relatada pela primeira vez na Europa em 1933 e nos Estados Unidos em 1943. Uma pesquisa descobriu que cerca de 5% dos trabalhadores em fábricas de lâmpadas fluorescentes em 1949 nos Estados Unidos tinham berílio- doenças pulmonares relacionadas. A beriliose crônica assemelha-se à sarcoidose em muitos aspectos, e o diagnóstico diferencial costuma ser difícil. Ele matou alguns dos primeiros trabalhadores no projeto de armas nucleares, como Herbert L. Anderson.
O berílio pode ser encontrado na escória de carvão. Quando a escória é formulada em um agente abrasivo para jateamento de tinta e ferrugem de superfícies duras, o berílio pode se espalhar pelo ar e se tornar uma fonte de exposição.
Embora o uso de compostos de berílio em tubos de iluminação fluorescente tenha sido descontinuado em 1949, existe potencial para exposição ao berílio nas indústrias nuclear e aeroespacial e no refino de berílio metálico e fusão de ligas contendo berílio, na fabricação de dispositivos eletrônicos, e o manuseio de outros materiais contendo berílio.
Detecção
Os primeiros pesquisadores empreenderam a prática altamente perigosa de identificar o berílio e seus vários compostos a partir de seu sabor doce. A identificação agora é realizada usando técnicas de diagnóstico modernas e seguras. Um teste bem-sucedido para berílio no ar e em superfícies foi desenvolvido e publicado como um padrão internacional de consenso voluntário ASTM D7202. O procedimento utiliza bifluoreto de amônio diluído para dissolução e detecção de fluorescência com berílio ligado a hidroxibenzoquinolina sulfonada, permitindo detecção até 100 vezes mais sensível do que o limite recomendado para concentração de berílio no local de trabalho. A fluorescência aumenta com o aumento da concentração de berílio. O novo procedimento foi testado com sucesso em uma variedade de superfícies e é eficaz para a dissolução e detecção de óxido de berílio refratário e berílio silicioso em concentrações mínimas (ASTM D7458). O Manual de Métodos Analíticos do NIOSH contém métodos para medir a exposição ocupacional ao berílio.
Fontes citadas
- Emsley, John (2001). Blocos de construção da natureza: um guia A-Z para os elementos. Oxford, England, UK: Oxford University Press. ISBN 978-0-19-850340-8.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introdução à química inorgânica moderna (6a ed.). CRC Imprensa. ISBN 978-0-7487-6420-4.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). Descoberta dos Elementos. Easton, PA: Journal of Chemical Education (em inglês). LCCCN 68-15217.
Contenido relacionado
Regla de Markovnikov
Reflujo (química)
Amonio



![{displaystyle {ce {[Be(H_2O)_4]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c300bc0a3682a741d256b1a6a8dcb246a855239)
![{displaystyle {ce {[Be(H_{2}O)_{4}]^{2+}{+}nF^{-}leftrightharpoons Be[(H_{2}O)_{2-n}F_{n}]^{(2-n)pm }{+}nH_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a912c3571a62ed845ae0e535cb0a611b1b19518)
![{displaystyle {ce {[Be_3O(H_2PO_4)_6]^{2-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a5d9b088328a7ec7a57f65641f44ab8eab4e152)

![{displaystyle {ce {H_{2}A{+}[Be(H_{2}O)_{4}]^{2+}leftrightharpoons [BeA(H_{2}O)_{2}]{+}2H^{+}{+}2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88afd13645c1b2eca86d7ba9ba8586abca494284)
![{displaystyle {ce {H_{2}A{+}[BeA(H_{2}O)_{2}]leftrightharpoons [BeA_{2}]^{2-}{+}2H^{+}{+}2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a36992a15f44668eff511201715607bfbbfcdfaa)
![{displaystyle {ce {Na_4[Be_6(OCH_2(O)O)_6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb11d9d4fdbfc6972b29c3f0da2932c7af31f59a)






