Bário
Bário é um elemento químico com o símbolo Ba e número atômico 56. É o quinto elemento do grupo 2 e é um metal alcalino-terroso macio e prateado. Devido à sua alta reatividade química, o bário nunca é encontrado na natureza como um elemento livre.
Os minerais de bário mais comuns são a barita (sulfato de bário, BaSO4) e a witherita (carbonato de bário, BaCO3). O nome bário origina-se do derivado alquímico "baryta", do grego βαρὺς (barys), significando &# 39;pesado'. Bárico é a forma adjetivada de bário. O bário foi identificado como um novo elemento em 1772, mas não foi reduzido a metal até 1808 com o advento da eletrólise.
O bário tem poucas aplicações industriais. Historicamente, foi usado como um coletor para tubos de vácuo e na forma de óxido como revestimento emissivo em catodos aquecidos indiretamente. É um componente do YBCO (supercondutores de alta temperatura) e da eletrocerâmica, e é adicionado ao aço e ao ferro fundido para reduzir o tamanho dos grãos de carbono dentro da microestrutura. Compostos de bário são adicionados aos fogos de artifício para dar uma cor verde. O sulfato de bário é usado como um aditivo insolúvel para fluido de perfuração de poços de petróleo. Em uma forma mais pura, é usado como agentes de radiocontraste de raios-X para imagens do trato gastrointestinal humano. Compostos de bário solúveis em água são venenosos e têm sido usados como raticidas.
Características
Propriedades físicas
O bário é um metal macio, branco prateado, com um leve tom dourado quando ultrapuro. A cor branca prateada do bário metálico desaparece rapidamente após a oxidação ao ar, produzindo uma camada cinza escura contendo o óxido. O bário tem peso específico médio e alta condutividade elétrica. Como o bário é difícil de purificar, muitas de suas propriedades não foram determinadas com precisão.
À temperatura e pressão ambiente, o bário metálico adota uma estrutura cúbica de corpo centrado, com uma distância bário-bário de 503 picômetros, expandindo com aquecimento a uma taxa de aproximadamente 1,8×10−5/°C. É um metal muito macio com dureza Mohs de 1,25. Sua temperatura de fusão de 1.000 K (730 °C; 1.340 °F) é intermediária entre as do estrôncio mais leve (1.050 K ou 780 °C ou 1.430 °F) e o rádio mais pesado (973 K ou 700 °C ou 1.292 °F); no entanto, seu ponto de ebulição de 2.170 K (1.900 °C; 3.450 °F) excede o do estrôncio (1.655 K ou 1.382 °C ou 2.519 °F). A densidade (3,62 g/cm3) é novamente intermediária entre as do estrôncio (2,36 g/cm3) e do rádio (≈5 g/cm3).
Reatividade química
O bário é quimicamente semelhante ao magnésio, cálcio e estrôncio, mas ainda mais reativo. Geralmente é encontrado no estado de oxidação +2. A maioria das exceções está em algumas espécies moleculares raras e instáveis que são caracterizadas apenas na fase gasosa, como BaF, mas em 2018 uma espécie de bário(I) foi relatada em um composto de intercalação de grafite. As reações com calcogênios são altamente exotérmicas (liberam energia); a reação com oxigênio ou ar ocorre à temperatura ambiente. Por esta razão, o bário metálico é frequentemente armazenado sob óleo ou em atmosfera inerte. As reações com outros não-metais, como carbono, nitrogênio, fósforo, silício e hidrogênio, são geralmente exotérmicas e ocorrem mediante aquecimento. As reações com água e álcoois são muito exotérmicas e liberam gás hidrogênio:
- Ba + 2 ROH → Ba (OR)2 + H2↑ (R é um grupo alcalino ou um átomo de hidrogênio)
Bário reage com amônia para formar complexos como Ba(NH3)6.
O metal é facilmente atacado por ácidos. O ácido sulfúrico é uma exceção notável porque a passivação interrompe a reação formando o sulfato de bário insolúvel na superfície. O bário se combina com vários outros metais, incluindo alumínio, zinco, chumbo e estanho, formando fases e ligas intermetálicas.
Compostos
| O2- | S2- | F- | Cl. | SO2-4 | CO2-3 | O2−2 | H... | |
|---|---|---|---|---|---|---|---|---|
| Ca2+ | 3.34 | 2.59 | 3.18 | 2.15 | 2.96 | 2.83 | 2.9 | 1.7. |
| Sr2. | 5. | 3.7 | 4.24 | 3.05 | 3.96 | 3.5 | 4.78 | 3.26 |
| Bando2+ | 5.72 | 4.3 | 4.89 | 3.89 | 4.49 | 4.29 | 4.96 | 4.16 |
| Zn2+ | 5.6 | 4.09 | 4.95 | 2.09 | 3.54 | 4.4 | 1.57 | — |
Os sais de bário são tipicamente brancos quando sólidos e incolores quando dissolvidos. Eles são mais densos que os análogos de estrôncio ou cálcio, exceto os haletos (ver tabela; o zinco é dado para comparação).
O hidróxido de bário ("baryta") era conhecido pelos alquimistas, que o produziam aquecendo o carbonato de bário. Ao contrário do hidróxido de cálcio, ele absorve muito pouco CO2 em soluções aquosas e, portanto, é insensível às flutuações atmosféricas. Esta propriedade é usada na calibração de equipamentos de pH.
Compostos de bário voláteis queimam com uma chama verde a verde pálida, que é um teste eficiente para detectar um composto de bário. A cor resulta de linhas espectrais em 455,4, 493,4, 553,6 e 611,1 nm.
Compostos organobários são um campo crescente de conhecimento: recentemente descobertos são dialquilbários e alquilhalobários.
Isótopos
O bário encontrado na crosta terrestre é uma mistura de sete nuclídeos primordiais, bário-130, 132 e 134 a 138. O bário-130 sofre um decaimento radioativo muito lento em xenônio-130 por duplo decaimento beta mais, com meia-vida de (0,5–2,7)×1021 anos (cerca de 1011 vezes a idade do universo). Sua abundância é ≈0,1% a do bário natural. Teoricamente, o bário-132 também pode sofrer um duplo decaimento beta para o xenônio-132; este decaimento não foi detectado. A radioatividade desses isótopos é tão fraca que não representam perigo para a vida.
Dos isótopos estáveis, o bário-138 compõe 71,7% de todo o bário; outros isótopos têm abundância decrescente com número de massa decrescente.
No total, o bário tem 40 isótopos conhecidos, variando em massa entre 114 e 153. O radioisótopo artificial mais estável é o bário-133, com uma meia-vida de aproximadamente 10,51 anos. Cinco outros isótopos têm meias-vidas superiores a um dia. O bário também tem 10 meta-estados, dos quais o bário-133m1 é o mais estável com uma meia-vida de cerca de 39 horas.
História
Os alquimistas do início da Idade Média conheciam alguns minerais de bário. Pedras lisas semelhantes a seixos de barita mineral foram encontradas em rochas vulcânicas perto de Bolonha, na Itália, e por isso foram chamadas de "pedras de Bolonha". Os alquimistas eram atraídos por eles porque, após a exposição à luz, eles brilhavam por anos. As propriedades fosforescentes da barita aquecida com orgânicos foram descritas por V. Casciorolus em 1602.
Carl Scheele determinou que a barita continha um novo elemento em 1772, mas não conseguiu isolar o bário, apenas o óxido de bário. Johan Gottlieb Gahn também isolou o óxido de bário dois anos depois em estudos semelhantes. O bário oxidado foi inicialmente chamado de "barote" por Guyton de Morveau, nome que foi mudado por Antoine Lavoisier para baryte (em francês) ou baryta (em latim). Também no século 18, o mineralogista inglês William Withering notou um mineral pesado nas minas de chumbo de Cumberland, agora conhecido como witherita. O bário foi isolado pela primeira vez por eletrólise de sais de bário fundido em 1808 por Sir Humphry Davy na Inglaterra. Davy, por analogia com o cálcio, denominou "bário" após baryta, com o "-ium" terminando significando um elemento metálico. Robert Bunsen e Augustus Matthiessen obtiveram bário puro por eletrólise de uma mistura fundida de cloreto de bário e cloreto de amônio.
A produção de oxigênio puro no processo Brin foi uma aplicação em larga escala de peróxido de bário na década de 1880, antes de ser substituído por eletrólise e destilação fracionada de ar liquefeito no início de 1900. Neste processo, o óxido de bário reage a 500–600 °C (932–1.112 °F) com o ar para formar peróxido de bário, que se decompõe acima de 700 °C (1.292 °F) liberando oxigênio:
- 2 BaO + O2 Gerenciamento de contas2
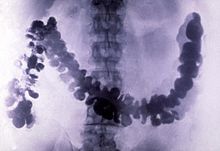
O sulfato de bário foi aplicado pela primeira vez como agente de radiocontraste em imagens de raios X do sistema digestivo em 1908.
Ocorrência e produção
A abundância de bário é de 0,0425% na crosta terrestre e 13 μg/L na água do mar. A principal fonte comercial de bário é a barita (também chamada de barita ou longarina pesada), um mineral de sulfato de bário. com depósitos em muitas partes do mundo. Outra fonte comercial, muito menos importante que a barita, é a murcha, carbonato de bário. Os principais depósitos estão localizados na Grã-Bretanha, Romênia e na ex-URSS.
As reservas de barita são estimadas entre 0,7 e 2 bilhões de toneladas. A produção máxima, 8,3 milhões de toneladas, foi produzida em 1981, mas apenas 7–8% foi usado para bário metálico ou compostos. A produção de barita aumentou desde a segunda metade da década de 1990 de 5,6 milhões de toneladas em 1996 para 7,6 em 2005 e 7,8 em 2011. A China responde por mais de 50% dessa produção, seguida pela Índia (14% em 2011), Marrocos (8,3 %), EUA (8,2%), Turquia (2,5%), Irã e Cazaquistão (2,6% cada).
O minério extraído é lavado, triturado, classificado e separado do quartzo. Se o quartzo penetrar muito profundamente no minério, ou o teor de ferro, zinco ou chumbo for anormalmente alto, então a flotação por espuma é usada. O produto é uma barita 98% pura (em massa); a pureza não deve ser inferior a 95%, com um teor mínimo de ferro e dióxido de silício. É então reduzido por carbono a sulfeto de bário:
- BaSO4 + 2 C → BaS + 2 CO2
O sulfeto de bário solúvel em água é o ponto de partida para outros compostos: tratar BaS com oxigênio produz o sulfato, com ácido nítrico o nitrato, com dióxido de carbono aquoso o carbonato e assim por diante. O nitrato pode ser decomposto termicamente para produzir o óxido. O bário metálico é produzido por redução com alumínio a 1.100 °C (2.010 °F). O composto intermetálico BaAl4 é produzido primeiro:
- 3 BaO + 14 Al → 3 BaAl4 + Al2O3
BaAl4 é um intermediário que reagiu com óxido de bário para produzir o metal. Observe que nem todo bário é reduzido.
- 8 BaO + BaAl4 → Ba↓ + 7 BaAl2O4
O óxido de bário restante reage com o óxido de alumínio formado:
- BaO + Al2O3 →2O4
e a reação geral é
- 4 BaO + 2 Al → 3 Ba↓ + BaAl2O4
O vapor de bário é condensado e embalado em moldes em uma atmosfera de argônio. Este método é usado comercialmente, produzindo bário ultrapuro. O bário comumente vendido é cerca de 99% puro, com as principais impurezas sendo estrôncio e cálcio (até 0,8% e 0,25%) e outros contaminantes contribuindo com menos de 0,1%.
Uma reação semelhante com silício a 1.200 °C (2.190 °F) produz bário e metassilicato de bário. A eletrólise não é usada porque o bário se dissolve prontamente em haletos fundidos e o produto é bastante impuro.
Pedra preciosa
O mineral de bário, benitoita (silicato de titânio e bário), ocorre como uma pedra preciosa fluorescente azul muito rara e é a gema oficial do estado da Califórnia.
Bário na água do mar
O bário existe na água do mar como o íon Ba2+ com uma concentração oceânica média de 109 nmol/kg. O bário também existe no oceano como BaSO4, ou barita. O bário tem um perfil semelhante a um nutriente com um tempo de residência de 10.000 anos.
O bário mostra uma concentração relativamente consistente na água do oceano superior, exceto regiões de altas entradas de rios e regiões com forte ressurgência. Há pouco esgotamento das concentrações de bário no oceano superior para um íon com um perfil semelhante a um nutriente, portanto, a mistura lateral é importante. Os valores isotópicos de bário mostram equilíbrios em escala de bacia em vez de processos locais ou de curto prazo.
Aplicativos
Metais e ligas
O bário, como metal ou quando ligado ao alumínio, é usado para remover gases indesejados (gettering) de tubos de vácuo, como tubos de imagem de TV. O bário é adequado para essa finalidade devido à sua baixa pressão de vapor e reatividade com oxigênio, nitrogênio, dióxido de carbono e água; pode até remover parcialmente os gases nobres, dissolvendo-os na rede cristalina. Esta aplicação está gradualmente desaparecendo devido à crescente popularidade dos conjuntos LCD, LED e plasma sem câmara.
Outros usos de bário elementar são menores e incluem um aditivo para silumin (ligas de alumínio-silício) que refina sua estrutura, bem como
- ligas de rolamento;
- ligas de solda de chumbo-tin – para aumentar a resistência de fluência;
- liga com níquel para velas de faísca;
- aditivo ao aço e ferro fundido como inoculante;
- ligas com cálcio, manganês, silício e alumínio como deoxidantes de aço de alta qualidade.
Sulfato de bário e barita
O sulfato de bário (o mineral barita, BaSO4) é importante para a indústria do petróleo como fluido de perfuração em poços de petróleo e gás. O precipitado do composto (chamado "blanc fixe", do francês para "branco permanente") é usado em tintas e vernizes; como um enchimento em tinta de toque, plásticos e borrachas; como pigmento de revestimento de papel; e em nanopartículas, para melhorar as propriedades físicas de alguns polímeros, como os epóxis.
O sulfato de bário tem baixa toxicidade e densidade relativamente alta de ca. 4,5 g/cm3 (e, portanto, opacidade para raios-X). Por esta razão, é usado como um agente de radiocontraste em imagens de raios-X do sistema digestivo ("refeições de bário" e "enemas de bário"). Litopone, pigmento que contém sulfato de bário e sulfeto de zinco, é um branco permanente com bom poder de cobertura que não escurece quando exposto a sulfetos.
Outros compostos de bário
Outros compostos de bário encontram apenas aplicações de nicho, limitadas pela toxicidade dos íons Ba2+ (o carbonato de bário é um veneno para ratos), o que não é um problema para o insolúvel BaSO4 .
- O revestimento de óxido de bário sobre os eletrodos de lâmpadas fluorescentes facilita a liberação de elétrons.
- Pela sua grande densidade atômica, o carbonato de bário aumenta o índice de refração e o brilho do vidro e reduz vazamentos de raios-X de tubos de raios catódicos (CRT) televisores.
- Barium, tipicamente como o nitrato de bário transmite uma cor verde amarela ou "apple" a fogos de artifício; para o monocloreto de bário verde brilhante é usado.
- O peróxido de bário é um catalisador na reação aluminotérmica (termita) para trilhos de solda. É também um sinal verde na munição do rastreador e um agente de branqueamento.
- O titato de bário é um electroceramico promissor.
- O fluoreto de bário é usado para óptica em aplicações infravermelhas por causa de sua ampla gama de transparência de 0,15-12 micrômetros.
- YBCO foi o primeiro supercondutor de alta temperatura refrigerado por nitrogênio líquido, com uma temperatura de transição de 93 K (−180.2 °C; −292.3 °F) que excedeu o ponto de ebulição de nitrogênio (77 K ou −196.2 °C ou −321.1 °F).
- Ferrite, um tipo de cerâmica sinterizada composta de óxido de ferro (Fe2O3) e óxido de bário (BaO), é eletricamente não condutor e ferrimagnético, e pode ser temporariamente ou permanentemente magnetizado.
Paleoceanografia
A mistura lateral do bário é causada pela mistura da massa de água e pela circulação oceânica. A circulação oceânica global revela uma forte correlação entre o bário dissolvido e o ácido silícico. A circulação oceânica em grande escala combinada com a remineralização do bário mostra uma correlação semelhante entre o bário dissolvido e a alcalinidade oceânica.
A correlação do bário dissolvido com o ácido silícico pode ser vista vertical e espacialmente. O bário particulado mostra uma forte correlação com o carbono orgânico particulado ou POC. O bário está se tornando mais popular para ser usado como base para proxies paleoceanográficos. Com ligações de bário dissolvido e particulado com ácido silícico e POC, ele pode ser usado para determinar variações históricas na bomba biológica, ciclo do carbono e clima global.
A barita particulada de bário (BaSO4), como um dos muitos substitutos, pode ser usada para fornecer uma série de informações históricas sobre processos em diferentes ambientes oceânicos (coluna d'água, sedimentos e locais hidrotermais). Em cada configuração existem diferenças na composição isotópica e elementar do particulado de barita. A barita na coluna de água, conhecida como barita marinha ou pelágica, revela informações sobre a variação química da água do mar ao longo do tempo. A barita em sedimentos, conhecida como barita diagenética ou fria, fornece informações sobre processos redox sedimentares. A barita formada por atividade hidrotermal em fontes hidrotermais, conhecida como barita hidrotermal, revela alterações na condição da crosta terrestre ao redor dessas fontes.
Toxicidade
Devido à alta reatividade do metal, os dados toxicológicos estão disponíveis apenas para compostos. Compostos solúveis de bário são venenosos. Em doses baixas, os íons de bário agem como estimulante muscular, e doses mais altas afetam o sistema nervoso, causando irregularidades cardíacas, tremores, fraqueza, ansiedade, falta de ar e paralisia. Essa toxicidade pode ser causada pelo bloqueio dos canais iônicos de potássio pelo Ba2+, que são críticos para o bom funcionamento do sistema nervoso. Outros órgãos danificados por compostos de bário solúveis em água (ou seja, íons de bário) são os olhos, sistema imunológico, coração, sistema respiratório e pele causando, por exemplo, cegueira e sensibilização.
O bário não é cancerígeno e não se bioacumula. A poeira inalada contendo compostos de bário insolúveis pode se acumular nos pulmões, causando uma condição benigna chamada baritose. O sulfato insolúvel não é tóxico e não é classificado como produto perigoso nos regulamentos de transporte.
Para evitar uma reação química potencialmente vigorosa, o bário metálico é mantido em atmosfera de argônio ou sob óleos minerais. O contato com o ar é perigoso e pode causar ignição. Umidade, fricção, calor, faíscas, chamas, choques, eletricidade estática e exposição a oxidantes e ácidos devem ser evitados. Qualquer coisa que possa entrar em contato com o bário deve ser eletricamente aterrada. Qualquer pessoa que trabalhe com o metal deve usar sapatos anti-faíscas pré-limpos, roupas de borracha resistentes a chamas, luvas de borracha, avental, óculos de proteção e máscara de gás. Normalmente é proibido fumar na área de trabalho. É necessária uma lavagem completa após o manuseio do bário.
Contenido relacionado
Célula eletroquímica
Cristal
Processo endotérmico
Isomeria cis-trans
Hélio