Ânodo
Um ânodo é um eletrodo de um dispositivo elétrico polarizado através do qual a corrente convencional entra no dispositivo. Isso contrasta com um cátodo, um eletrodo do dispositivo através do qual a corrente convencional sai do dispositivo. Um mnemônico comum é ACID, para "anode current into device". A direção da corrente convencional (o fluxo de cargas positivas) em um circuito é oposta à direção do fluxo de elétrons, de modo que os elétrons (com carga negativa) fluem do ânodo de uma célula galvânica para um circuito externo ou externo conectado à célula. Por exemplo, o fim de uma bateria doméstica marcada com "-" (menos) é o ânodo.
Tanto em uma célula galvânica quanto em uma célula eletrolítica, o ânodo é o eletrodo no qual ocorre a reação de oxidação. Em uma célula galvânica, o ânodo é o fio ou placa com excesso de carga negativa como resultado da reação de oxidação. Em uma célula eletrolítica, o ânodo é o fio ou placa sobre a qual o excesso de carga positiva é imposto. Como resultado disso, os ânions tenderão a se mover em direção ao ânodo, onde sofrerão oxidação.
Historicamente, o ânodo de uma célula galvânica também era conhecido como zincode porque geralmente era composto de zinco.
Fluxo de carga
Os termos ânodo e cátodo não são definidos pela polaridade da tensão dos eletrodos, mas pela direção da corrente através do eletrodo. Um ânodo é um eletrodo de um dispositivo através do qual a corrente convencional (carga positiva) flui para o dispositivo a partir de um circuito externo, enquanto um cátodo é um eletrodo através do qual a corrente convencional flui para fora do dispositivo. Se a corrente através dos eletrodos inverter o sentido, como ocorre por exemplo em uma bateria recarregável quando está sendo carregada, os papéis dos eletrodos como ânodo e cátodo são invertidos.
A corrente convencional depende não apenas da direção em que os portadores de carga se movem, mas também da direção dos portadores de carga. carga elétrica. As correntes fora do dispositivo geralmente são transportadas por elétrons em um condutor de metal. Como os elétrons têm carga negativa, a direção do fluxo de elétrons é oposta à direção da corrente convencional. Consequentemente, os elétrons saem do dispositivo pelo ânodo e entram no dispositivo pelo cátodo.
A definição de ânodo e cátodo é diferente para dispositivos elétricos, como diodos e tubos de vácuo, onde a nomenclatura do eletrodo é fixa e não depende do fluxo de carga real (corrente). Esses dispositivos geralmente permitem fluxo de corrente substancial em uma direção, mas corrente insignificante na outra direção. Portanto, os eletrodos são nomeados com base na direção deste "para frente" atual. Em um diodo, o ânodo é o terminal através do qual a corrente entra e o cátodo é o terminal através do qual a corrente sai, quando o diodo é polarizado diretamente. Os nomes dos eletrodos não mudam nos casos em que a corrente reversa flui pelo dispositivo. Da mesma forma, em um tubo de vácuo apenas um eletrodo pode emitir elétrons para o tubo evacuado devido ao aquecimento de um filamento, de modo que os elétrons só podem entrar no dispositivo do circuito externo através do eletrodo aquecido. Portanto, esse eletrodo é permanentemente chamado de cátodo, e o eletrodo através do qual os elétrons saem do tubo é chamado de ânodo.
Exemplos
A polaridade da tensão em um ânodo em relação a um cátodo associado varia dependendo do tipo de dispositivo e de seu modo de operação. Nos exemplos a seguir, o ânodo é negativo em um dispositivo que fornece energia e positivo em um dispositivo que consome energia:
Em uma bateria ou célula galvânica descarregada (diagrama à esquerda), o ânodo é o terminal negativo: é onde a corrente convencional flui para a célula. Essa corrente interna é transportada externamente por elétrons que se movem para fora.
Em uma bateria em recarga, ou em uma célula eletrolítica, o ânodo é o terminal positivo imposto por uma fonte externa de diferença de potencial. A corrente através de uma bateria recarregada é oposta à direção da corrente durante a descarga; em outras palavras, o eletrodo que era o cátodo durante a descarga da bateria torna-se o ânodo durante a recarga da bateria.
Na engenharia de baterias, é comum designar um eletrodo de uma bateria recarregável como ânodo e o outro como cátodo, de acordo com as funções que os eletrodos desempenham quando a bateria é descarregada. Isso, apesar do fato de que os papéis se invertem quando a bateria é carregada. Quando isso é feito, "ânodo" simplesmente designa o terminal negativo da bateria, "catodo" o terminal positivo.
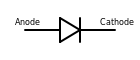
Em um diodo, o ânodo é o terminal representado pela cauda do símbolo de seta (lado plano do triângulo), onde a corrente convencional flui para o dispositivo. Observe que a nomeação do eletrodo para diodos é sempre baseada na direção da corrente direta (aquela da seta, na qual a corrente flui "mais facilmente"), mesmo para tipos como diodos Zener ou células solares onde o corrente de interesse é a corrente reversa.
Em tubos a vácuo ou tubos cheios de gás, o ânodo é o terminal por onde a corrente entra no tubo.
Etimologia
A palavra foi cunhada em 1834 a partir do grego ἄνοδος (anodos), 'subida', por William Whewell, que havia sido consultado por Michael Faraday sobre alguns novos nomes necessários para concluir um artigo sobre o processo recentemente descoberto de eletrólise. Nesse artigo, Faraday explicou que quando uma célula eletrolítica é orientada de modo que a corrente elétrica atravesse o "corpo em decomposição" (eletrólito) em uma direção "de leste a oeste, ou, o que fortalecerá essa ajuda à memória, aquela em que o sol parece se mover", o ânodo é por onde a corrente entra no eletrólito, na Lado leste: "ano para cima, odos um caminho; a maneira como o sol nasce".
O uso de 'Leste' para significar o 'em' direção (na verdade 'in' → 'leste' → 'nascer do sol' → 'para cima') pode parecer artificial. Anteriormente, conforme relatado na primeira referência citada acima, Faraday havia usado o termo mais direto "eisódio" (a porta por onde a corrente entra). Sua motivação para mudá-lo para algo que significa 'o eletrodo leste' (outros candidatos foram "eastode", "oriode" e "anatolode") foi torná-lo imune a uma possível mudança posterior na convenção de direção da corrente, cujo natureza exata não era conhecida na época. A referência que ele usou para esse efeito foi a direção do campo magnético da Terra, que na época se acreditava ser invariante. Ele definiu fundamentalmente sua orientação arbitrária para a célula como sendo aquela em que a corrente interna correria paralela e na mesma direção que um hipotético loop de corrente magnetizante em torno da linha local de latitude que induziria um campo dipolo magnético orientado como a Terra&# 39;s. Isso tornou a corrente interna leste para oeste como mencionado anteriormente, mas no caso de uma mudança de convenção posterior, ela se tornaria oeste para leste, de modo que o eletrodo leste não teria sido o 'caminho de entrada' não mais. Portanto, "eisódio" teria se tornado inapropriado, enquanto "ânodo" que significa 'eletrodo leste' teria permanecido correto em relação à direção inalterada do fenômeno real subjacente à corrente, então desconhecido, mas, pensou ele, inequivocamente definido pela referência magnética. Em retrospecto, a mudança de nome foi lamentável, não apenas porque as raízes gregas sozinhas não revelam mais a função do ânodo, mas mais importante porque, como sabemos agora, a direção do campo magnético da Terra na qual o & #34;ânodo" termo é baseado está sujeito a reversões, enquanto a convenção de direção atual na qual o "eisódio" termo foi baseado não tem motivos para mudar no futuro.
Desde a descoberta posterior do elétron, uma etimologia mais fácil de lembrar e tecnicamente correta, embora historicamente falsa, tem sido sugerida: anodo, do grego anodos, 'para cima' 39;, 'o caminho (para cima) para fora da célula (ou outro dispositivo) para elétrons'.
Ânodo eletrolítico
Na eletroquímica, o ânodo é onde ocorre a oxidação e é o contato de polaridade positiva em uma célula eletrolítica. No ânodo, os ânions (íons negativos) são forçados pelo potencial elétrico a reagir quimicamente e liberar elétrons (oxidação) que então fluem para cima e para o circuito de acionamento. Mnemônicos: LEO Red Cat (perda de elétrons é oxidação, redução ocorre no cátodo), ou AnOx Red Cat (ânodo oxidação, redução cátodo), ou OIL RIG (oxidação é perda, redução é ganho de elétrons), ou católico romano e Ortodoxo (Redução – Catodo, ânodo – Oxidação), ou LEO o leão diz GER (Perder elétrons é Oxidação, Ganhar elétrons é Redução).
Este processo é amplamente utilizado no refino de metais. Por exemplo, no refino de cobre, os ânodos de cobre, um produto intermediário dos fornos, são eletrolisados em uma solução apropriada (como ácido sulfúrico) para produzir cátodos de alta pureza (99,99%). Os cátodos de cobre produzidos usando este método também são descritos como cobre eletrolítico.
Historicamente, quando ânodos não reativos eram desejados para eletrólise, grafite (chamado plumbago na época de Faraday) ou platina eram escolhidos. Eles foram considerados alguns dos materiais menos reativos para ânodos. A platina sofre erosão muito lentamente em comparação com outros materiais, e o grafite se desintegra e pode produzir dióxido de carbono em soluções aquosas, mas de outra forma não participa da reação.
Bateria ou ânodo de célula galvânica
Em uma bateria ou célula galvânica, o ânodo é o eletrodo negativo do qual os elétrons fluem para a parte externa do circuito. Internamente, os cátions carregados positivamente estão fluindo para longe do ânodo (mesmo que seja negativo e, portanto, espera-se que os atraia, isso se deve ao potencial do eletrodo em relação à solução eletrolítica ser diferente para os sistemas ânodo e cátodo metal/eletrólito); mas, externamente à célula no circuito, os elétrons estão sendo empurrados para fora através do contato negativo e, portanto, através do circuito pelo potencial de tensão, como seria de esperar. Nota: numa célula galvânica, ao contrário do que ocorre numa célula eletrolítica, não circulam aniões para o ânodo, sendo a corrente interna inteiramente contabilizada pelos catiões que dele saem (cf. desenho).
Os fabricantes de baterias podem considerar o eletrodo negativo como o ânodo, principalmente em sua literatura técnica. Embora tecnicamente incorreto, resolve o problema de qual eletrodo é o ânodo em uma célula secundária (ou recarregável). Usando a definição tradicional, os interruptores de ânodo terminam entre os ciclos de carga e descarga.
Ânodo do tubo de vácuo
Em dispositivos eletrônicos a vácuo, como um tubo de raios catódicos, o ânodo é o coletor de elétrons carregado positivamente. Em um tubo, o ânodo é uma placa carregada positivamente que coleta os elétrons emitidos pelo cátodo por meio da atração elétrica. Também acelera o fluxo desses elétrons.
ânodo de diodo
Em um diodo semicondutor, o ânodo é a camada dopada com P que inicialmente fornece lacunas para a junção. Na região da junção, os buracos fornecidos pelo ânodo se combinam com os elétrons fornecidos pela região N-dopada, criando uma zona depletada. Como a camada dopada com P fornece buracos para a região depletada, os íons dopantes negativos são deixados para trás na camada dopada com P ('P' para íons portadores de carga positiva). Isso cria uma carga negativa de base no ânodo. Quando uma tensão positiva é aplicada ao ânodo do diodo do circuito, mais buracos podem ser transferidos para a região esgotada, e isso faz com que o diodo se torne condutivo, permitindo que a corrente flua pelo circuito. Os termos ânodo e cátodo não devem ser aplicados a um diodo Zener, pois permite o fluxo em qualquer direção, dependendo da polaridade do potencial aplicado (ou seja, tensão).
ânodo de sacrifício
Na proteção catódica, um ânodo de metal que é mais reativo ao ambiente corrosivo do que o sistema de metal a ser protegido é eletricamente ligado ao sistema protegido. Como resultado, o ânodo de metal corrói parcialmente ou se dissolve em vez do sistema de metal. Por exemplo, o casco de um navio de ferro ou aço pode ser protegido por um ânodo de sacrifício de zinco, que se dissolverá na água do mar e evitará a corrosão do casco. Os ânodos de sacrifício são particularmente necessários para sistemas onde uma carga estática é gerada pela ação de líquidos em fluxo, como tubulações e embarcações. Ânodos de sacrifício também são geralmente usados em aquecedores de água do tipo tanque.
Em 1824, para reduzir o impacto desta ação eletrolítica destrutiva em cascos de navios, suas fixações e equipamentos subaquáticos, o cientista-engenheiro Humphry Davy desenvolveu o primeiro e ainda mais utilizado sistema de proteção de eletrólise marinha. Davy instalou ânodos de sacrifício feitos de um metal mais eletricamente reativo (menos nobre) preso ao casco do navio e conectado eletricamente para formar um circuito de proteção catódica.
Um exemplo menos óbvio deste tipo de proteção é o processo de galvanização do ferro. Este processo reveste estruturas de ferro (como cercas) com um revestimento de zinco metálico. Enquanto o zinco permanecer intacto, o ferro estará protegido dos efeitos da corrosão. Inevitavelmente, o revestimento de zinco se rompe, seja por rachaduras ou danos físicos. Quando isso ocorre, os elementos corrosivos atuam como eletrólito e a combinação zinco/ferro como eletrodos. A corrente resultante garante que o revestimento de zinco seja sacrificado, mas que o ferro base não sofra corrosão. Tal revestimento pode proteger uma estrutura de ferro por algumas décadas, mas uma vez que o revestimento protetor é consumido, o ferro corrói rapidamente.
Se, inversamente, o estanho for usado para revestir o aço, quando ocorre uma ruptura do revestimento, ele na verdade acelera a oxidação do ferro.
Ânodo atual impresso
Outra proteção catódica é usada no ânodo de corrente impressa. É feito de titânio e coberto com óxido de metal misturado. Ao contrário da haste de ânodo de sacrifício, o ânodo de corrente impressa não sacrifica sua estrutura. Essa tecnologia usa uma corrente externa fornecida por uma fonte CC para criar a proteção catódica. Ânodos de corrente impressa são usados em estruturas maiores, como tubulações, barcos e aquecedores de água.
Antônimo relacionado
O oposto de um ânodo é um cátodo. Quando a corrente através do dispositivo é invertida, os eletrodos mudam de função, de modo que o ânodo se torna o cátodo e o cátodo se torna o ânodo, desde que a corrente inversa seja aplicada. A exceção são os diodos em que a nomeação do eletrodo é sempre baseada na direção direta da corrente.
Contenido relacionado
Análise complexa
Amida
Grupo hidroxi