Anestésico geral
Anestésicos gerais (ou anestésicos, veja as diferenças ortográficas) são frequentemente definidos como compostos que induzem a perda de consciência em humanos ou perda do reflexo de endireitamento em animais. As definições clínicas também são estendidas para incluir um coma induzido que causa falta de consciência a estímulos dolorosos, suficientes para facilitar aplicações cirúrgicas na prática clínica e veterinária. Os anestésicos gerais não atuam como analgésicos e também não devem ser confundidos com sedativos. Os anestésicos gerais são um grupo estruturalmente diverso de compostos cujos mecanismos abrangem múltiplos alvos biológicos envolvidos no controle de vias neuronais. O funcionamento preciso é objeto de algum debate e pesquisa em andamento.
Os anestésicos gerais provocam um estado de anestesia geral. Permanece um tanto controverso sobre como esse estado deve ser definido. Os anestésicos gerais, no entanto, normalmente provocam vários efeitos reversíveis importantes: imobilidade, analgesia, amnésia, inconsciência e resposta autonômica reduzida a estímulos nocivos.
Modo de administração
Os anestésicos gerais podem ser administrados na forma de gases ou vapores (anestésicos inalatórios), ou na forma de injeções (anestésicos endovenosos ou mesmo intramusculares). Todos esses agentes compartilham a propriedade de serem bastante hidrofóbicos (ou seja, como líquidos, eles não são livremente miscíveis - ou misturáveis - em água e, como gases, eles se dissolvem em óleos melhor do que em água). É possível administrar a anestesia apenas por inalação ou injeção, mas mais comumente as duas formas são combinadas, com uma injeção administrada para induzir a anestesia e um gás usado para mantê-la.
Inalação
Substâncias anestésicas inalatórias são líquidos ou gases voláteis e geralmente são administradas usando uma máquina de anestesia. Uma máquina de anestesia permite compor uma mistura de oxigênio, anestésicos e ar ambiente, entregando-a ao paciente e monitorando os parâmetros do paciente e da máquina. Os anestésicos líquidos são vaporizados na máquina.
Muitos compostos têm sido usados para anestesia inalatória, mas apenas alguns ainda estão em uso generalizado. Desflurano, isoflurano e sevoflurano são os anestésicos voláteis mais usados atualmente. Eles são frequentemente combinados com óxido nitroso. Os anestésicos voláteis mais antigos e menos populares incluem halotano, enflurano e metoxiflurano. Os pesquisadores também estão explorando ativamente o uso do xenônio como anestésico.
Injeção
Os anestésicos injetáveis são usados para a indução e manutenção de um estado de inconsciência. Os anestesistas preferem usar injeções intravenosas, pois são mais rápidas, geralmente menos dolorosas e mais confiáveis do que injeções intramusculares ou subcutâneas. Entre as drogas mais utilizadas estão:
- Propofol
- Etomidato
- Barbituratos como methohexital e thiopentone/thiopental
- Benzodiazepinas como midazolam
- Ketamine é usado no Reino Unido como "naesthesia de campo", por exemplo, em incidentes de tráfego rodoviário ou situações semelhantes onde uma operação deve ser conduzida no local ou quando não há tempo suficiente para se mover para uma sala de operações, enquanto prefere outros anestésicos onde as condições permitem seu uso. É mais frequentemente usado na configuração operacional nos EUA.
Os benzodiazepínicos são sedativos e são usados em combinação com outros anestésicos gerais
Mecanismo de ação
A indução e a manutenção da anestesia geral e o controle dos vários efeitos colaterais fisiológicos são normalmente alcançados por meio de uma abordagem medicamentosa combinatória. Os anestésicos gerais individuais variam em relação aos seus efeitos fisiológicos e cognitivos específicos. Embora a indução da anestesia geral possa ser facilitada por um anestésico geral, outros podem ser usados em paralelo ou subsequentemente para alcançar e manter o estado anestésico desejado. A abordagem medicamentosa utilizada depende do procedimento e das necessidades dos profissionais de saúde.
Postula-se que os anestésicos gerais exercem sua ação pela ativação dos receptores inibitórios do sistema nervoso central (SNC) e pela inativação dos receptores excitatórios do SNC. Os papéis relativos de diferentes receptores ainda estão em debate, mas existem evidências de alvos específicos envolvidos com certos anestésicos e efeitos de drogas.
Abaixo estão vários alvos principais de anestésicos gerais que provavelmente medeiam seus efeitos:
Agonistas do receptor GABAA
- Os receptores GABAA são canais de cloreto que hiperpolarizam os neurônios e funcionam como receptores inibitórios do SNC. Os anestésicos gerais que os agonizam são normalmente usados para induzir um estado de sedação e / ou inconscienteidade. Tais drogas incluem propofol, etomidato, isoflurane, benzodiazepinas (midazolam, lorazepam, diazepam), e barbiturados (sodium thiopental, methohexital).
Antagonistas do receptor NMDA
- Ketamine, um antagonista do receptor NMDA, é usado principalmente por seus efeitos analgésicos e em uma capacidade off-label para seus efeitos anti-depressivos. Este medicamento, no entanto, também altera a excitação e é frequentemente usado em paralelo com outros anestésicos gerais para ajudar a manter um estado de anestesia geral. Somente a administração de quetamina leva a um estado dissociativo, no qual um paciente pode experimentar alucinações auditivas e visuais. Além disso, a percepção da dor é dissociada da percepção de estímulos nocivos. Ketamina parece ligar preferencialmente aos receptores NMDA em interneurons GABAérgicos, o que pode explicar parcialmente seus efeitos.
Ativação de canais de potássio de dois poros (K2Ps)
- Dois canais de potássio (K2Ps) modulam a condutância de potássio que contribui para o potencial de membrana de repouso em neurônios. A abertura desses canais facilita, portanto, uma corrente hiperpolarizante, que reduz a excitabilidade neuronal. KK2Ps foram encontrados para ser afetados por anestésicos gerais (esp. anestésicos de inalação halogenados) e estão atualmente sob investigação como alvos potenciais. O K2P família de canal compreende seis subfamílias, que inclui 15 membros únicos. 13 destes canais (excluindo os homomers TWIK-1 e TWIK-2) são afetados pela anestesia geral. Embora não tenha sido determinado que os anestésicos gerais se ligam diretamente a esses canais, nem é claro como essas drogas afetam K2P condução, estudos eletrofisiológicos têm demonstrado que certos anestésicos gerais resultam em K2P ativação do canal. Esta ativação do canal com drogas mostrou-se dependente de aminoácidos específicos dentro de certos K2P canais (ou seja, canais TREK-1 e TASK). No caso de TREK-1, a ativação foi mostrada através de uma perturbação anestésica a aglomerados lipídicos da membrana e ativação da fosfolipase D2; a ligação direta de anestésicos a TREK-1 purificado não teve efeito na condução. Os efeitos de certos anestésicos gerais são menos pronunciados em K2P ratos nocaute, em comparação com seus homólogos do tipo selvagem. Cumulativamente, TASK-1, TASK-3 e TREK-1 são particularmente bem suportados como desempenhando um papel na indução da anestesia geral.
Outros
- Os agonistas do receptor do opióide são utilizados principalmente para seus efeitos analgésicos. Estas drogas, no entanto, também podem provocar sedação. Este efeito é mediado por ações opióides em receptores opióides e acetilcolina. Enquanto essas drogas podem levar à diminuição da excitação, elas não provocam uma perda de consciência. Por esta razão, eles são frequentemente usados em paralelo com outros anestésicos gerais para ajudar a manter um estado de anestesia geral. Tais drogas incluem morfina, fentanil, hidromorfo e remifentanil.
- A administração do receptor adrenérgico alfa2 dexmedetomidina agonista leva à sedação que se assemelha ao sono não-REM. É usado em paralelo com outros anestésicos gerais para ajudar a manter um estado de anestesia geral, em uma capacidade off-label. Notavelmente, os pacientes são facilmente despertados deste estado de sono não-REM.
- Os antagonistas do receptor da dopamina têm propriedades sedativas e antieméticas. Anteriormente, eles foram usados em paralelo com opiáceos para elicit anestesia neuroléptica (catalepsia, analgesia e inresponsabilidade). Eles não são mais usados no contexto, porque os pacientes que experimentam anestesia neuroléptica eram freqüentemente conscientes dos procedimentos médicos que estão sendo realizados, mas não podiam mover ou expressar emoção. Tais drogas incluem haloperidol e droperidol.
Estágios da anestesia
Durante a administração de um anestésico, o receptor passa por diferentes estágios de comportamento que levam à inconsciência. Esse processo é acelerado com anestésicos intravenosos, tanto que é insignificante considerá-lo durante o uso. Os quatro estágios da anestesia são descritos usando os sinais de Guedel, significando a profundidade da anestesia. Esses estágios descrevem os efeitos da anestesia principalmente na cognição, na atividade muscular e na respiração.
Estágio I - Analgesia
O receptor da anestesia sente principalmente analgesia seguida de amnésia e uma sensação de confusão passando para o próximo estágio.
Estágio II - Excitação
O estágio II é frequentemente caracterizado pelo delírio e confusão do receptor, com amnésia severa. Irregularidades nos padrões de respiração são comuns nesta fase da anestesia. Náuseas e vômitos também são indicadores de anestesia no estágio II. Luta e pânico às vezes podem ocorrer como resultado do delírio.
Estágio III - Anestesia Cirúrgica
A respiração normal é retomada no início do Estágio III. Perto do final do estágio, a respiração cessa completamente. Os indicadores para a anestesia do estágio III incluem a perda do reflexo ciliar, bem como a respiração regular. A profundidade da anestesia do estágio III geralmente pode ser medida pelo movimento dos olhos e pelo tamanho da pupila.
Estágio IV - Depressão Medular
Nenhuma respiração ocorre no estágio IV. Isso é logo seguido por insuficiência circulatória e depressão dos centros vasomotores. A morte é comum neste estágio da anestesia se nenhum suporte respiratório e circulatório estiver disponível.
Efeitos colaterais fisiológicos
Além dos efeitos clinicamente vantajosos dos anestésicos gerais, há uma série de outras consequências fisiológicas mediadas por essa classe de drogas. Notavelmente, uma redução na pressão arterial pode ser facilitada por uma variedade de mecanismos, incluindo contratilidade cardíaca reduzida e dilatação da vasculatura. Essa queda na pressão arterial pode ativar um aumento reflexo da frequência cardíaca, devido a um mecanismo de feedback mediado por barorreceptores. Alguns anestésicos, no entanto, interrompem esse reflexo.
Pacientes sob anestesia geral correm maior risco de desenvolver hipotermia, pois a vasodilatação mencionada aumenta a perda de calor pelo fluxo sanguíneo periférico. Em geral, essas drogas reduzem o limiar de temperatura corporal interna no qual os mecanismos autonômicos de termorregulação são acionados em resposta ao frio. (Por outro lado, o limiar no qual os mecanismos termorreguladores são acionados em resposta ao calor é normalmente aumentado.)
Os anestésicos geralmente afetam a respiração. Os anestésicos inalatórios provocam broncodilatação, aumento da frequência respiratória e redução do volume corrente. O efeito líquido é a diminuição da respiração, que deve ser controlada pelos profissionais de saúde, enquanto o paciente está sob anestesia geral. Os reflexos que funcionam para aliviar as obstruções das vias aéreas também são amortecidos (por exemplo, engasgo e tosse). Combinado com uma redução no tônus do esfíncter esofágico inferior, que aumenta a frequência de regurgitação, os pacientes são especialmente propensos à asfixia sob anestesia geral. Os profissionais de saúde monitoram de perto os indivíduos sob anestesia geral e utilizam vários dispositivos, como um tubo endotraqueal, para garantir a segurança do paciente.
Os anestésicos gerais também afetam a zona de gatilho quimiorreceptora e o centro de vômito do tronco cerebral, provocando náuseas e vômitos após o tratamento.
Farmacocinética
Anestésicos gerais intravenosos
Indução
Os anestésicos gerais administrados por via intravenosa são tipicamente moléculas pequenas e altamente lipofílicas. Essas características facilitam sua rápida distribuição preferencial no cérebro e na medula espinhal, que são altamente vascularizados e lipofílicos. É aqui que as ações dessas drogas levam à indução da anestesia geral.
Eliminação
Após a distribuição no sistema nervoso central (SNC), a droga anestésica se difunde do SNC para os músculos e vísceras, seguidos pelos tecidos adiposos. Em pacientes que receberam uma única injeção da droga, essa redistribuição resulta no término da anestesia geral. Portanto, após a administração de um único bolus de anestésico, a duração do efeito da droga depende exclusivamente da cinética de redistribuição.
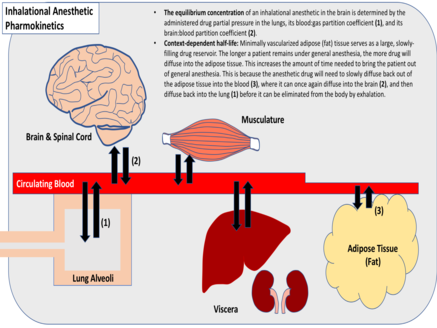
A meia-vida de uma droga anestésica após uma infusão prolongada, no entanto, depende da cinética de redistribuição da droga, do metabolismo da droga no fígado e da concentração da droga existente na gordura. Quando grandes quantidades de uma droga anestésica já foram dissolvidas nas reservas de gordura do corpo, isso pode retardar sua redistribuição para fora do cérebro e da medula espinhal, prolongando seus efeitos no SNC. Por esse motivo, diz-se que as meias-vidas dessas drogas infundidas são dependentes do contexto. Geralmente, as infusões prolongadas de drogas anestésicas resultam em meias-vidas mais longas, eliminação lenta do cérebro e da medula espinhal e término tardio da anestesia geral.
Anestésicos gerais inalatórios
A concentração alveolar mínima (CAM) é a concentração de um anestésico inalatório nos pulmões que impede que 50% dos pacientes respondam à incisão cirúrgica. Este valor é usado para comparar as potências de vários anestésicos gerais inalatórios e afeta a pressão parcial da droga utilizada pelos profissionais de saúde durante a indução e/ou manutenção da anestesia geral.
Indução
A indução da anestesia é facilitada pela difusão de um anestésico inalatório no cérebro e na medula espinhal. A difusão por todo o corpo prossegue até que a pressão parcial da droga dentro dos vários tecidos seja equivalente à pressão parcial da droga dentro dos pulmões. Os profissionais de saúde podem controlar a taxa de indução da anestesia e as concentrações teciduais finais do anestésico variando a pressão parcial do anestésico inspirado. Uma pressão parcial do fármaco mais alta nos pulmões conduzirá a difusão mais rapidamente por todo o corpo e produzirá uma concentração tecidual máxima mais alta. A frequência respiratória e o volume inspiratório também afetarão a rapidez do início da anestesia, assim como a extensão do fluxo sanguíneo pulmonar.
O coeficiente de partição de uma droga gasosa é indicativo de sua solubilidade relativa em vários tecidos. Esta métrica é a concentração relativa da droga entre dois tecidos, quando suas pressões parciais são iguais (gás:sangue, gordura:sangue, etc.). Os anestésicos inalatórios variam amplamente em relação às suas solubilidades teciduais e coeficientes de partição. Os anestésicos altamente solúveis requerem muitas moléculas de fármaco para aumentar a pressão parcial dentro de um determinado tecido, ao contrário dos anestésicos minimamente solúveis, que requerem relativamente poucos. Geralmente, os anestésicos inalatórios minimamente solúveis atingem o equilíbrio mais rapidamente. Os anestésicos inalatórios que apresentam alto coeficiente de partição gordura:sangue, no entanto, atingem o equilíbrio mais lentamente, devido à vascularização mínima do tecido adiposo, que serve como um grande reservatório de enchimento lento para a droga.
Eliminação
Os anestésicos inalatórios são eliminados por expiração, após difusão para os pulmões. Esse processo depende em grande parte do coeficiente de partição sangue:gás do anestésico, solubilidade do tecido, fluxo sanguíneo para os pulmões e frequência respiratória e volume inspiratório do paciente. Para gases com solubilidade tecidual mínima, o término da anestesia geralmente ocorre tão rapidamente quanto o início da anestesia. No entanto, para gases com alta solubilidade tecidual, o término da anestesia geralmente depende do contexto. Assim como nas infusões de anestésicos intravenosos, a entrega prolongada de gases anestésicos altamente solúveis geralmente resulta em meias-vidas mais longas, eliminação lenta do cérebro e da medula espinhal e atraso no término da anestesia.
O metabolismo dos anestésicos inalatórios geralmente não é a principal via de eliminação do fármaco.
Contenido relacionado
Apoptose
Cetamina
Doenças do neurônio motor