Álcool (química)
Em química, um álcool é um tipo de composto orgânico que carrega pelo menos um grupo funcional hidroxila (−OH) ligado a um átomo de carbono saturado. Os álcoois variam de simples, como metanol e etanol, a complexos, como sacarose e colesterol. A presença de um grupo OH modifica fortemente as propriedades dos hidrocarbonetos, conferindo propriedades hidrofílicas (amorosas à água). O grupo OH fornece um local no qual muitas reações podem ocorrer.
História
A natureza inflamável das exalações do vinho já era conhecida por antigos filósofos naturais, como Aristóteles (384–322 aC), Teofrasto (c. 371–287 aC) e Plínio, o Velho (23/24–79 dC). No entanto, isso não levou imediatamente ao isolamento do álcool, mesmo apesar do desenvolvimento de técnicas de destilação mais avançadas no Egito romano dos séculos II e III. Um reconhecimento importante, encontrado pela primeira vez em um dos escritos atribuídos a Jābir ibn Ḥayyān (século IX dC), foi que, ao adicionar sal ao vinho fervente, o que aumenta a relativa volatilidade do vinho, a inflamabilidade dos vapores resultantes pode ser aprimorado. A destilação do vinho é atestada em obras árabes atribuídas a al-Kindī (c. 801–873 EC) e para al-Fārābī (c. 872–950), e no 28º livro de al -Zahrāwī's (latim: Abulcasis, 936–1013) Kitāb al-Taṣrīf (mais tarde traduzido para o latim como Liber servatoris). No século XII, receitas para a produção de aqua ardens ("água ardente", ou seja, álcool) por destilação de vinho com sal começaram a aparecer em várias obras latinas, e no final do século XIII, tornou-se uma substância amplamente conhecida entre os químicos da Europa Ocidental.
Os trabalhos de Taddeo Alderotti (1223–1296) descrevem um método para concentração de álcool envolvendo destilação fracionada repetida através de um alambique refrigerado a água, pelo qual uma pureza de álcool de 90% pode ser obtida. As propriedades medicinais do etanol foram estudadas por Arnald of Villanova (1240–1311 EC) e John of Rupescissa (c. 1310 –1366), este último o considerava uma substância preservadora da vida capaz de prevenir todas as doenças (a aqua vitae ou "água da vida", também chamada por John a quintessência do vinho).
Nomenclatura
Etimologia
A palavra "álcool" deriva do árabe kohl (árabe: الكحل, romanizado: al-kuḥl), um pó usado como delineador. A primeira parte da palavra (al-) é o artigo definido árabe, equivalente a o em inglês. A segunda parte da palavra (kuḥl) tem vários antecedentes nas línguas semíticas, derivando, em última análise, do acadiano 𒎎𒋆𒁉𒍣𒁕 (guḫlum), significando estibina ou antimônio.
Como seus antecedentes em árabe e línguas mais antigas, o termo álcool foi originalmente usado para o pó muito fino produzido pela sublimação do mineral natural estibina para formar trissulfeto de antimônio Sb2S3. Foi considerado a essência ou "espírito" deste mineral. Foi usado como anti-séptico, delineador e cosmético. Mais tarde, o significado de álcool foi estendido para substâncias destiladas em geral, e depois novamente reduzido a etanol, quando "espíritos" era sinônimo de licor forte.
Bartholomew Traheron, em sua tradução de 1543 de João de Vigo, introduz a palavra como um termo usado por "bárbaros" autores para "pó fino." Vigo escreveu: "os autores bárbaros usam álcool, ou (como eu acho que às vezes é escrito) alcofoll, para o mais fino poudre."
O Lexicon Chymicum de 1657, de William Johnson, glosa a palavra como "antimonium sive stibium." Por extensão, a palavra passou a se referir a qualquer fluido obtido por destilação, incluindo "álcool de vinho" a essência destilada do vinho. Libavius em Alchymia (1594) refere-se a "vini alcohol vel vinum alcalisatum". Johnson (1657) glosa álcool vini como "quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat." O significado da palavra ficou restrito a "espírito do vinho" (a substância química conhecida hoje como etanol) no século 18 e foi estendida para a classe de substâncias chamadas de "álcoois" na química moderna depois de 1850.
O termo etanol foi inventado em 1892, misturando "etano" com o "-ol" final de "alcool", que foi generalizado como um libfix.
O termo álcool originalmente se referia ao álcool primário etanol (álcool etílico), que é usado como droga e é o principal álcool presente nas bebidas alcoólicas.
O sufixo -ol aparece no nome químico da União Internacional de Química Pura e Aplicada (IUPAC) de todas as substâncias em que o grupo hidroxila é o grupo funcional com maior prioridade. Quando um grupo de maior prioridade está presente no composto, o prefixo hidroxi- é usado em seu nome IUPAC. O sufixo -ol em nomes não pertencentes à IUPAC (como paracetamol ou colesterol) normalmente também indica que a substância é um álcool. No entanto, alguns compostos que contêm grupos funcionais hidroxila têm nomes triviais que não incluem o sufixo -ol ou o prefixo hidroxi-, por exemplo os açúcares glicose e sacarose.
Nomes sistemáticos
A nomenclatura IUPAC é utilizada em publicações científicas e onde a identificação precisa da substância é importante. Ao nomear álcoois simples, o nome da cadeia de alcano perde o terminal e e adiciona o sufixo -ol, e.g., como em "etanol" do nome da cadeia de alcano "etano". Quando necessário, a posição do grupo hidroxila é indicada por um número entre o nome do alcano e o -ol: propan-1-ol para CH3CH2CH2OH , propan-2-ol para CH3CH(OH)CH3. Se um grupo de maior prioridade estiver presente (como um aldeído, cetona ou ácido carboxílico), então o prefixo hidroxi- é usado, por exemplo, como em 1-hidroxi-2-propanona (CH3C(O)CH2OH). Compostos com mais de um grupo hidroxila são chamados de polióis. Eles são nomeados usando sufixos -diol, -triol, etc., seguindo uma lista dos números de posição dos grupos hidroxila, como em propano-1,2-diol para CH3CH(OH)CH 2OH (propilenoglicol).
Nos casos em que o grupo hidroxila está ligado a um carbono sp2 em um anel aromático, a molécula é classificada separadamente como um fenol e é nomeada de acordo com as regras da IUPAC para nomenclatura de fenóis. Os fenóis têm propriedades distintas e não são classificados como álcoois.
Nomes comuns
Em outros contextos menos formais, um álcool é frequentemente chamado com o nome do grupo alquila correspondente seguido pela palavra "álcool", por exemplo, álcool metílico, álcool etílico. O álcool propílico pode ser álcool n-propílico ou álcool isopropílico, dependendo se o grupo hidroxila está ligado ao carbono final ou intermediário na cadeia linear do propano. Conforme descrito na nomenclatura sistemática, se outro grupo na molécula tiver prioridade, a fração de álcool é frequentemente indicada usando o "hidroxi-" prefixo.
Na nomenclatura arcaica, os álcoois podem ser nomeados como derivados do metanol usando "-carbinol" como o final. Por exemplo, (CH3)3COH pode ser chamado de trimetilcarbinol.
Primário, secundário e terciário
Os álcoois são então classificados em primários, secundários (sec-, s-) e terciários (tert-, t- i>), com base no número de átomos de carbono ligados ao átomo de carbono que possui o grupo funcional hidroxila. (As respectivas abreviações numéricas 1°, 2° e 3° às vezes são usadas em ambientes informais.) Os álcoois primários têm fórmulas gerais RCH 2OH. O álcool primário mais simples é o metanol (CH3OH), para o qual R=H, e o próximo é etanol, para o qual R=CH3, o grupo metil. Os álcoois secundários são aqueles da forma RR'CHOH, sendo o mais simples o 2-propanol (R=R'=CH3). Para os álcoois terciários a forma geral é RR'R"COH. O exemplo mais simples é o terc-butanol (2-metilpropan-2-ol), para o qual cada um de R, R' e R" é CH3. Nessas abreviações, R, R' e R" representam substituintes, alquilo ou outros grupos ligados, geralmente orgânicos.
Exemplos
| Tipo | Fórmula | IUPAC Nome | Nome comum |
|---|---|---|---|
| Monohydric álcool | CH3Oh! | Etanol | Álcool de madeira |
| C2H. H. H.5Oh! | Etanol | Álcool | |
| C3H. H. H.7Oh! | Propan-2-ol | Álcool isopropílico, Esfregando álcool | |
| C4H. H. H.9Oh! | Butan-1-ol | Butanol, Álcool butílico | |
| C5H. H. H.11Oh! | Pentan-1-ol | Pentanol, Álcool Amyl | |
| C16.H. H. H.33Oh! | Hexadecan-1-ol | Álcool Cetilitário | |
| Polímero álcool | C2H. H. H.4(OH)2 | Ethane-1, 2-diol | Etileno glicol |
| C3H. H. H.6(OH)2 | Propane-1, 2-diol | Propilene glicol | |
| C3H. H. H.5(OH)3 | Propane-1,2,3-triol | Glicerina | |
| C4H. H. H.6(OH)4 | Butane-1,2,3,4-tetraol | Erythritol, Threitol | |
| C5H. H. H.7(OH)5 | Pentane-1,2,3,4,5-pentol | Xylitol | |
| C6H. H. H.8(OH)6 | hexano-1,2,3,4,5,6-hexol | Mannitol, Sorbitol | |
| C7H. H. H.9(OH)7 | Heptano-1,2,3,4,5,6,7 heptol | Volemitol | |
| Insaturado Álcoois alifáticos | C3H. H. H.5Oh! | Prop-2-ene-1-ol | Álcool alcoólico |
| C10.H. H. H.17.Oh! | 3,7-Dimethylocta-2,6-dien-1-ol | Geraniol | |
| C3H. H. H.3Oh! | Prop-2-yn-1-ol | Álcool propargyl | |
| Álcoois acíclicos | C6H. H. H.6(OH)6 | Cyclohexane-1,2,3,4,5,6-hexol | Inositol |
| C10.H. H. H.19Oh! | 5-Metil-2-(propan-2-yl)cicloohexan-1-ol | Mentol |
Aplicativos
Os álcoois têm uma longa história de inúmeros usos. Para mono-álcoois simples, que é o foco deste artigo, os seguintes são os álcoois industriais mais importantes:
- metanol, principalmente para a produção de formaldeído e como aditivo de combustível
- etanol, principalmente para bebidas alcoólicas, aditivo de combustível, solvente
- 1-propanol, 1-butanol e álcool isobutílico para uso como solvente e precursor para solventes
- Álcoois C6-C11 utilizados para plastificantes, por exemplo, em polivinilcloridrato
- álcool gorduroso (C12–C18), precursores de detergentes
O metanol é o álcool industrial mais comum, com cerca de 12 milhões de toneladas/ano produzidas em 1980. A capacidade combinada dos outros álcoois é aproximadamente a mesma, distribuída aproximadamente igualmente.
Toxicidade
Com relação à toxicidade aguda, os álcoois simples têm baixas toxicidades agudas. Doses de vários mililitros são toleradas. Para pentanóis, hexanóis, octanóis e álcoois mais longos, o LD50 varia de 2 a 5 g/kg (ratos, oral). O etanol é menos agudamente tóxico. Todos os álcoois são irritantes leves para a pele.
O metabolismo do metanol (e do etilenoglicol) é afetado pela presença de etanol, que tem maior afinidade pela álcool desidrogenase hepática. Desta forma, o metanol será excretado intacto na urina.
Propriedades físicas
Em geral, o grupo hidroxila torna os álcoois polares. Esses grupos podem formar ligações de hidrogênio entre si e com a maioria dos outros compostos. Devido à presença do OH polar, os álcoois são mais solúveis em água do que os hidrocarbonetos simples. Metanol, etanol e propanol são miscíveis em água. O butanol, com uma cadeia de quatro carbonos, é moderadamente solúvel.
Devido à ligação de hidrogênio, os álcoois tendem a ter pontos de ebulição mais altos do que hidrocarbonetos e éteres comparáveis. O ponto de ebulição do álcool etanol é 78,29 °C, em comparação com 69 °C para o hidrocarboneto hexano e 34,6 °C para o éter dietílico.
Ocorrência na natureza
Álcoois simples são amplamente encontrados na natureza. O etanol é o mais proeminente porque é o produto da fermentação, uma das principais vias de produção de energia. Outros álcoois simples, principalmente álcoois fusel, são formados apenas em vestígios. No entanto, álcoois mais complexos são difundidos, como se manifestam em açúcares, alguns aminoácidos e ácidos graxos.
Produção
Hidroxilação
Muitos álcoois são produzidos por hidroxilação, ou seja, a instalação de um grupo hidroxila usando oxigênio ou oxidante relacionado. A hidroxilação é o meio pelo qual o corpo processa muitos venenos, convertendo compostos lipofílicos em derivados hidrofílicos que são mais prontamente excretados. Enzimas chamadas hidroxilases e oxidases facilitam essas conversões.
Muitos álcoois industriais, como o ciclohexanol para a produção de nylon, são produzidos por hidroxilação.
Processos Ziegler e oxo
No processo Ziegler, álcoois lineares são produzidos a partir de etileno e trietilalumínio seguido de oxidação e hidrólise. Uma síntese idealizada de 1-octanol é mostrada:
- Al(C8H17)3}}}" xmlns="http://www.w3.org/1998/Math/MathML">Al.(C2H. H. H.5)3+9C2H. H. H.4⟶ ⟶ ⟶ ⟶ Al.(C8H. H. H.17.)3(Al(C2H5)3 + 9 C2H4 -> Al(C8H17)3}}}
Al(C8H17)3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/d9b6552f7841a81d1cb73bfd9858d56b558eb282" style="vertical-align: -1.005ex; width:37.404ex; height:3.009ex;"/>
- 3 HOC8H17 + Al(OH)3}}}" xmlns="http://www.w3.org/1998/Math/MathML">Al.(C8H. H. H.17.)3+3O+3H. H. H.2O⟶ ⟶ ⟶ ⟶ 3HOC8H. H. H.17.+Al.(Oh!)3(Al(C8H17)3 + 3O + 3 H2O -> 3 HOC8H17 + Al(OH)3}}}
3 HOC8H17 + Al(OH)3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/90449a52abf76a7546b88781f11d7e8be54b9d98" style="vertical-align: -1.005ex; width:54.992ex; height:3.009ex;"/>
O processo gera uma gama de álcoois que são separados por destilação.
Muitos álcoois superiores são produzidos por hidroformilação de alcenos seguida de hidrogenação. Quando aplicado a um alceno terminal, como é comum, obtém-se tipicamente um álcool linear:
- RCH2CH2CHO}}}" xmlns="http://www.w3.org/1998/Math/MathML">RCH= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =CH2+H. H. H.2+CO⟶ ⟶ ⟶ ⟶ RCH2CH2CHO(RCH=CH2 + H2 + CO -> RCH2CH2CHO}}}
RCH2CH2CHO}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/3e85e9b045e3e2e12e0ba2c0cb71574dca9d3bdf" style="vertical-align: -1.005ex; width:44.366ex; height:2.843ex;"/>
- RCH2CH2CH2OH}}}" xmlns="http://www.w3.org/1998/Math/MathML">RCH2CH2CHO+3H. H. H.2⟶ ⟶ ⟶ ⟶ RCH2CH2CH2Oh!(RCH2CH2CHO + 3 H2 -> RCH2CH2CH2OH}}}
RCH2CH2CH2OH}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e943848f9950994e20829f758793840fe0c8fcf1" style="vertical-align: -1.005ex; width:46.862ex; height:2.843ex;"/>
Esses processos fornecem álcoois graxos, que são úteis para detergentes.
Reações de hidratação
Alguns álcoois de baixo peso molecular de importância industrial são produzidos pela adição de água a alcenos. Etanol, isopropanol, 2-butanol e terc-butanol são produzidos por este método geral. Duas implementações são empregadas, os métodos direto e indireto. O método direto evita a formação de intermediários estáveis, normalmente usando catalisadores ácidos. No método indireto, o alceno é convertido no éster sulfato, que posteriormente é hidrolisado. A hidratação direta usando etileno (hidratação de etileno) ou outros alcenos a partir do craqueamento de frações de petróleo bruto destilado.
A hidratação também é usada industrialmente para produzir o diol etilenoglicol a partir do óxido de etileno.
Fermentação
O etanol é obtido pela fermentação da glicose (que geralmente é obtida do amido) na presença de levedura. O dióxido de carbono é cogerado. Como o etanol, o butanol pode ser produzido por processos de fermentação. Sabe-se que a levedura Saccharomyces produz esses álcoois superiores a temperaturas acima de 75 °F (24 °C). A bactéria Clostridium acetobutylicum pode se alimentar da celulose (também um álcool) para produzir butanol em escala industrial.
Substituição
Haletos de alquila primários reagem com NaOH ou KOH aquoso a álcoois em substituição alifática nucleofílica. (Haletos de alquila secundários e especialmente terciários darão o produto de eliminação (alceno)). Os reagentes de Grignard reagem com grupos carbonílicos a álcoois secundários e terciários. As reações relacionadas são a reação de Barbier e a reação de Nozaki-Hiyama.
Redução
Aldeídos ou cetonas são reduzidos com borohidreto de sódio ou hidreto de alumínio e lítio (após um processamento ácido). Outra redução por isopropilatos de alumínio é a redução Meerwein-Ponndorf-Verley. A hidrogenação assimétrica Noyori é a redução assimétrica de β-ceto-ésteres.
Hidrólise
Os alcenos se envolvem em uma reação de hidratação catalisada por ácido usando ácido sulfúrico concentrado como catalisador que geralmente fornece álcoois secundários ou terciários. A formação de um álcool secundário via redução de alceno e hidratação é mostrada à direita:
A hidroboração-oxidação e a oximercuração-redução de alcenos são mais confiáveis na síntese orgânica. Alcenos reagem com N-bromosuccinimida e água na reação de formação de haloidrina. As aminas podem ser convertidas em sais de diazônio, que são então hidrolisados.
Reações
Desprotonação
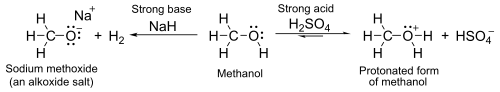
Com valores de pKa aquosos em torno de 16–19, eles são, em geral, ácidos ligeiramente mais fracos que a água. Com bases fortes, como hidreto de sódio ou sódio, formam sais chamados alcóxidos, com a fórmula geral RO−M+ (onde R é um alquil e M é um metal).
- 2 R-O-Na + 2 H2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2R- Sim. - Sim. Oh!+2Não.⟶ ⟶ ⟶ ⟶ 2R- Sim. - Sim. O- Sim. - Sim. Nao+2H. H. H.2(2 R-OH + 2 NaH -> 2 R-O-Na + 2 H2}}}
2 R-O-Na + 2 H2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9705883f5eb63d0f8601cd834de8f1060eeae381" style="vertical-align: -1.005ex; width:41.531ex; height:2.843ex;"/>
- 2 R-O-Na + H2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2R- Sim. - Sim. Oh!+2Nao⟶ ⟶ ⟶ ⟶ 2R- Sim. - Sim. O- Sim. - Sim. Nao+H. H. H.2(2 R-OH + 2 Na -> 2 R-O-Na + H2}}}
2 R-O-Na + H2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/2451b44e60f7cc40fe7ee8f8843691c47f2f4334" style="vertical-align: -1.005ex; width:38.239ex; height:2.843ex;"/>
A acidez dos álcoois é fortemente afetada pela solvatação. Na fase gasosa, os álcoois são mais ácidos do que na água. No DMSO, os álcoois (e a água) têm um pKa de cerca de 29–32. Como consequência, os alcóxidos (e hidróxidos) são bases e nucleófilos poderosos (por exemplo, para a síntese do éter de Williamson) neste solvente. Em particular, RO- ou HO- em DMSO pode ser usado para gerar concentrações de equilíbrio significativas de íons acetileto por meio da desprotonação de alcinos (consulte a reação de Favorskii).
Substituição nucleofílica
Álcoois terciários reagem com ácido clorídrico para produzir cloreto de alquil terciário. Álcoois primários e secundários são convertidos para os cloretos correspondentes usando cloreto de tiionilo e vários reagentes de cloreto de fósforo.
Álcoois primários e secundários, da mesma forma, convertem-se em brometos de alquila, tribrometo de fósforo, por exemplo:
- 3 RBr + H3PO3}}}" xmlns="http://www.w3.org/1998/Math/MathML">3R- Sim. - Sim. Oh!+P.3⟶ ⟶ ⟶ ⟶ 3R.+H. H. H.3PODE3(3 R-OH + PBr3 -> 3 RBr + H3PO3}}}
3 RBr + H3PO3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/fe0e13bdb30ff904fb5411fec6097ed1b9bc2369" style="vertical-align: -1.005ex; width:37.65ex; height:2.843ex;"/>
Na desoxigenação de Barton-McCombie, um álcool é desoxigenado a um alcano com hidreto de tributilestanho ou um complexo trimetilborano-água em uma reação de substituição de radical.
Desidratação
Enquanto isso, o átomo de oxigênio tem pares solitários de elétrons não ligados que o tornam fracamente básico na presença de ácidos fortes como o ácido sulfúrico. Por exemplo, com metanol:
Após o tratamento com ácidos fortes, os álcoois sofrem a reação de eliminação E1 para produzir alcenos. A reação, em geral, obedece à Regra de Zaitsev, que afirma que o alceno mais estável (geralmente o mais substituído) é formado. Os álcoois terciários são eliminados facilmente logo acima da temperatura ambiente, mas os álcoois primários requerem uma temperatura mais alta.
Este é um diagrama da desidratação de etanol catalisada por ácido para produzir etileno:
Uma reação de eliminação mais controlada requer a formação do éster xantato.
Protonólise
Álcoois terciários reagem com ácidos fortes para gerar carbocátions. A reação está relacionada com a sua desidratação, e. isobutileno do álcool terc-butílico. Um tipo especial de reação de desidratação envolve trifenilmetanol e especialmente seus derivados substituídos por amina. Quando tratados com ácido, esses álcoois perdem água para dar carbocátions estáveis, que são corantes comerciais.
Esterificação
O álcool e os ácidos carboxílicos reagem na chamada esterificação de Fischer. A reação geralmente requer um catalisador, como ácido sulfúrico concentrado:
- R'-CO2R + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">R- Sim. - Sim. Oh!+R?- Sim. - Sim. CO2H. H. H.⟶ ⟶ ⟶ ⟶ R?- Sim. - Sim. CO2R+H. H. H.2O(R-OH + R'-CO2H -> R'-CO2R + H2O}}}
R'-CO2R + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/92e5266ee6ca8d5900ba7ff27adb0cdb0a940cb6" style="vertical-align: -1.005ex; width:43.394ex; height:3.176ex;"/>
Outros tipos de éster são preparados de maneira semelhante - por exemplo, ésteres de tosil (tosilato) são produzidos pela reação do álcool com cloreto de p-toluenossulfonil em piridina.
Oxidação
Álcoois primários (R-CH2OH) podem ser oxidados a aldeídos (R-CHO) ou a ácidos carboxílicos (R-CO2H ). A oxidação de álcoois secundários (R1R2CH−OH) normalmente termina na cetona (R1R2C=O). Álcoois terciários (R1R2R3C−OH) são resistentes à oxidação.
A oxidação direta de álcoois primários a ácidos carboxílicos normalmente ocorre através do aldeído correspondente, que é transformado através de um hidrato de aldeído (R−CH(OH)2) por reação com água antes que possa ser ainda mais oxidado ao ácido carboxílico.
Reagentes úteis para a transformação de álcoois primários em aldeídos normalmente também são adequados para a oxidação de álcoois secundários em cetonas. Estes incluem o reagente de Collins e o periodinano de Dess-Martin. A oxidação direta de álcoois primários a ácidos carboxílicos pode ser realizada usando permanganato de potássio ou o reagente de Jones.
Referências gerais
- Metcalf, Allan A. (1999). O mundo em tantas palavras. Houghton Mifflin. ISBN 0-395-95920-9.
Contenido relacionado
Emulsão
Bromo
Decaimento alfa